- Méthane
-
Méthane 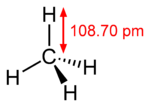


Structure de la molécule de méthane.Général Nom IUPAC méthane Synonymes hydrure de méthyle No CAS No EINECS PubChem SMILES InChI Apparence gaz comprimé ou liquéfié, incolore et inodore[1]. Propriétés chimiques Formule brute CH4 [Isomères] Masse molaire[2] 16,0425 ± 0,0011 g·mol-1
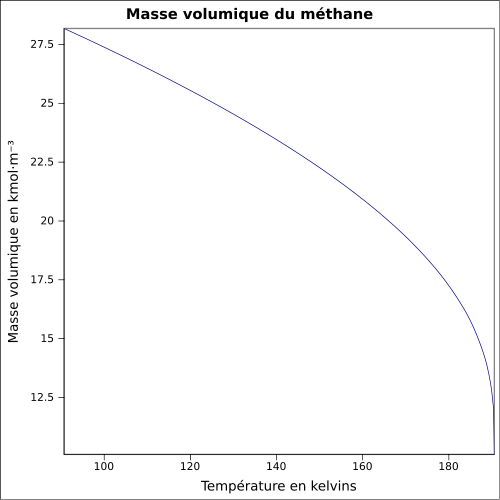
C 74,87 %, H 25,13 %,Propriétés physiques T° fusion -182,47 °C [3] T° ébullition -161,52 °C [3] Solubilité 22 mg·l-1 (eau, 25 °C)[4] Masse volumique 422,62 kg·m-3 (-161 °C, liquide)
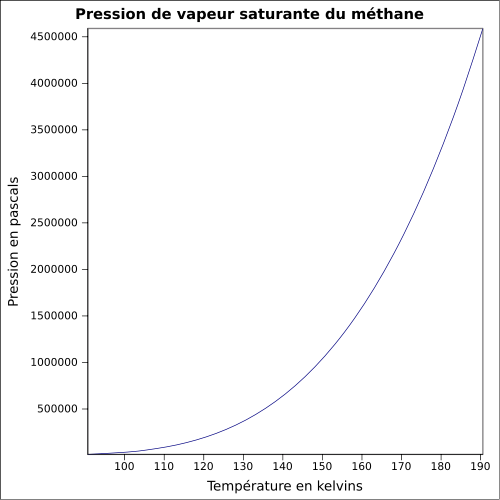
0,6709 kg·m-3 (15 °C,1 bar,gaz)[3]T° d'auto-inflammation 537 °C[1] Point d’éclair Gaz Inflammable[1] Limites d’explosivité dans l’air 4,4–17 %vol[3] Pression de vapeur saturante 2 atm (-152,3 °C);
5 atm (-138,3 °C);
10 atm (-124,8 °C);
20 atm (-108,5 °C);
40 atm (-86,3 °C);
4,66×105 mmHg (25 °C)[4]Point critique 4 600 kPa [6], -82,6 °C [7] Vitesse du son 1 337 m·s-1 (liquide,-161,5 °C)
450 m·s-1 (gaz,27 °C,1 atm)[8]Thermochimie ΔfH0gaz -74,87 kJ·mol-1 [9] Cp PCI 803,3 kJ·mol-1 [11] Propriétés électroniques 1re énergie d'ionisation 12,61 ± 0,01 eV (gaz)[12] Précautions Directive 67/548/EEC 
F+Phrases R : 12, Phrases S : 2, 9, 16, 33, [13] Transport 23 1971
223 1972 SIMDUT[14] 

SGH[15] 

DangerÉcotoxicologie LogP 1,09[1] Unités du SI & CNTP, sauf indication contraire. Le méthane est un composé chimique de formule CH4. Il a été découvert et isolé par Alessandro Volta entre 1776 et 1778 lorsqu'il étudia les gaz s'échappant du lac Majeur. Il s'agit du plus simple des hydrocarbures, et plus précisément du premier terme de la famille des alcanes. Il est assez abondant dans le milieu naturel, ce qui en fait un combustible à fort potentiel. La combustion du méthane dans l'oxygène pur produit du dioxyde de carbone CO2 et de l'eau H2O avec une importante libération d'énergie :
Cependant, le fait qu'il se présente à l'état gazeux aux conditions normales de température et de pression nécessite de le liquéfier pour le transporter, généralement par pipeline et par méthaniers, plus rarement par camions.
D'énormes quantités de méthane sont enfouies dans le sous-sol sous forme de gaz naturel. De grandes quantités, difficiles à évaluer, sont également présentes sur le plancher océanique sous forme d'hydrates de méthane, stables à basse température et haute pression. Du méthane est également produit de façon anaérobie par les archées dites méthanogènes. D'autres sources de méthane sont les volcans de boue, les décharges publiques et la digestion du bétail, notamment des ruminants.
Le méthane est naturellement présent dans l'atmosphère terrestre à des concentrations très faibles, de l'ordre de 1,75 ppm(précisément de 1 748 ppb en 1998[16]). Sa concentration tend à se stabiliser un peu au-dessus de cette valeur, après avoir connu une forte augmentation au cours des dernières décennies. Le méthane a en effet une durée de vie assez brève — moins de dix ans — dans l'atmosphère, où il est détruit par des radicaux hydroxyle OH·.
C'est un gaz à effet de serre considérablement plus puissant que le CO2, responsable, au niveau actuel de sa concentration, de quelques pourcents de l'effet de serre total à l'œuvre dans notre atmosphère[17].
Sommaire
Histoire
Alessandro Volta découvre le méthane en 1776 en s'intéressant au « gaz des marais » (l'ancien nom du méthane)[18].
C'est à cause du grisou, responsable (encore de nos jours) de trop nombreuses catastrophes minières que furent mises au point, les lampes de sûreté dans les mines de charbon, et notamment la lampe de Davy.
Jusqu'aux années 1970, l'impact du méthane sur le climat était inconnu. En 1976, il a été démontré que le méthane était un gaz à effet de serre.
Ce n’est qu’avec l'exploration spatiale que l’on a découvert l’omniprésence de ce corps dans l’Univers.
Formation, stockages naturels
C’est le principal constituant du biogaz issu de la fermentation de matières organiques animales ou végétales en l’absence d’oxygène. Il est fabriqué par des bactéries méthanogènes qui vivent dans des milieux anaérobies c’est-à-dire sans oxygène.
Le méthane est ainsi le seul hydrocarbure classique qui peut être obtenu rapidement et facilement grâce à un processus biologique naturel. Nous utilisons principalement du gaz naturel et donc du méthane fossile, mais l’utilisation du méthane renouvelable, aussi appelé biogaz, est en développement : Suède, Allemagne, Danemark, Viet-Nam, Cambodge, Chine, Inde...
Le méthane se dégage naturellement des zones humides peu oxygénées comme les marais et certains sols longuement inondées. Il se forme aussi dans l'estomac et le tube digestif de nombreux animaux (de certains invertébrés aux mammifères). Ce gaz est présent en faible quantité dans les flatulences humaines[19].
Des quantités importantes de méthane sont piégées sous forme d’hydrates de méthane (clathrates) au fond des océans (où leur exploitation est envisagée) et dans les pergélisols. Ces deux réservoirs pourraient jouer un rôle important dans les cycles climatiques, et ils semblent commencer à perdre une quantité croissante de méthane dans l'atmosphère.
Articles détaillés : Clathrate et pergélisol.Le débullage de méthane à partir des sédiments marins, sur les lignes de fractures du plancher océanique est considéré comme un indice de risque sismique élevé, voire peut-être comme pouvant annoncer un tremblement de (sous réserve de confirmation suite aux expériences en cours, en mer de Marmara, sur la faille nord-anatolienne en cours au large de la Turquie) [20].
Propriétés physico-chimiques
Aux conditions normales de température et de pression, c'est un gaz incolore et inodore. Plus léger que l'air, le méthane en milieu non confiné s'échappe vers la haute atmosphère et n'a pas la tendance des gaz plus lourds que l'air (propane, butane) à former des nuages explosifs. Le méthane est un combustible qui compose jusqu'à 90% le gaz naturel. Sa température d'auto-inflammation dans l'air est de 540 °C [21]. La réaction de combustion du méthane s'écrit :
CH4 + 2O2 → CO2 + 2H2O - La combustion d'1 m³ de méthane à 15 °C (gaz naturel) libère une énergie de 9,89 kWh (35,6 MJ)
- Le gaz naturel, (constitué à plus de 90% de méthane) est transporté par navires (méthaniers) à une température de -162 °C et à une pression voisine de la pression atmosphérique. Les réservoirs sont construits sur le principe de la « bouteille thermos » et leur capacité peut aller jusqu'à 40 000 ou 50 000 m³ de gaz liquide par réservoir. Un méthanier comportant plusieurs réservoirs, sa cargaison peut actuellement atteindre 154 000 m³ de GNL, Gaz Naturel Liquéfié. Les futurs méthaniers pourront transporter jusqu'à 260 000 m³ de GNL. Le volume du méthane à l'état gazeux est égal à 600 fois son volume à l'état liquide, à pression atmosphérique.
- Présent à tous les stades de l'industrie pétrolière, mais mal valorisé, il est fréquemment brûlé dans une torchère ; ce comportement contribuant à l'effet de serre, les pétroliers tentent de plus en plus de restreindre ce procédé.
Dans l'Univers
Dans les nuages interstellaires
Article détaillé : nuage interstellaire.Du méthane a été retrouvé à l'état de traces dans plusieurs nuages interstellaires.
Sur Titan
Articles détaillés : Titan (lune) et atmosphère de Titan.Le méthane est présent partout sur Titan, et même à l'état liquide sous forme de lacs, de rivières, et de mers, particulièrement près du pôle nord de l'astre. Sa présence en a été établie dès 1944. Au point que la chaleur dégagée par la sonde Huygens, lors de l'impact du 14 janvier 2005 a provoqué un notable dégagement de méthane gazeux.
L'atmosphère de Titan, satellite de Saturne, est principalement constituée d'azote avec une proportion de méthane allant de 1,4 % dans la stratosphère jusqu'à 4,9 % au niveau du sol. Il ne pleuvait pas lorsque la sonde Huygens s'est posée sur Titan, mais l'ESA n'exclut pas que des averses de méthane y soient fréquentes. Simplement, l'aridité du sol absorberait rapidement ces précipitations, à la manière des déserts terrestres.
Sur Mars
Articles détaillés : Mars (planète) et atmosphère de Mars.L'un des résultats les plus étonnants de la sonde spatiale Mars Reconnaissance Orbiter, en orbite autour de Mars depuis le 10 mars 2006, provient de l'étude détaillée en 2008 de la région de Nili Fossae, identifiée début 2009 comme source d'importants dégagements de méthane[22]. Le méthane a été détecté dès 2003 dans l'atmosphère de Mars, aussi bien par des sondes telles que Mars Express que depuis la Terre ; ces émissions de CH4 se concentreraient notamment en trois zones particulières de la région de Syrtis Major Planum[23]. Or le méthane est instable dans l'atmosphère martienne, des études récentes suggérant même qu'il soit six cents fois moins stable qu'estimé initialement (on évaluait sa durée de vie moyenne à 300 ans) car le taux de méthane n'a pas le temps de s'uniformiser dans l'atmosphère et demeure concentré autour de ses zones d'émission, ce qui correspondrait à une durée de vie de quelques centaines de jours ; la source de méthane correspondante serait par ailleurs 600 fois plus puissante qu'estimé initialement, émettant ce gaz une soixantaine de jours par année martienne, à la fin de l'été de l'hémisphère nord[24].
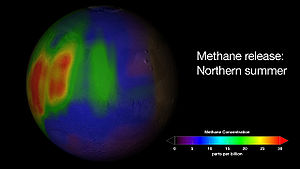 Visualisation d'un dégagement de méthane dans l'atmosphère de Mars début 2009, pendant l'été de l'hémisphère nord martien[25].
Visualisation d'un dégagement de méthane dans l'atmosphère de Mars début 2009, pendant l'été de l'hémisphère nord martien[25].
Les analyses géologiques menées en 2008 par la sonde Mars Reconnaissance Orbiter dans la région de Nili Fossae ont révélé la présence d'argiles ferromagnésiennes (smectites), d'olivine (silicate ferromagnésien (Mg,Fe)2SiO4, détectée dès 2003[26]) et de magnésite (carbonate de magnésium MgCO3)[27], ainsi que de serpentine[28]. La présence simultanée de ces minéraux permet d'expliquer assez simplement la formation de méthane, car, sur Terre, du méthane CH4 se forme en présence de carbonates — tels que le MgCO3 détecté dans la région en 2008 — et d'eau liquide lors du métamorphisme hydrothermal d'oxyde de fer(III) Fe2O3 ou d'olivine (Mg,Fe)2SiO4 en serpentine (Mg,Fe)3Si2O5(OH)4, particulièrement lorsque le taux de magnésium dans l'olivine n'est pas trop élevé et lorsque la pression partielle de dioxyde de carbone CO2 est insuffisante pour conduire à la formation de talc Mg3Si4O10(OH)2 mais aboutit au contraire à la formation de serpentine et de magnétite Fe3O4, comme dans la réaction :
- 24 Mg1,5Fe0,5SiO4 + 26 H2O + CO2 → 12 Mg3Si2O5(OH)4 + 4 Fe3O4 + CH4.
La probabilité de ce type de réactions dans la région de Nili Fossae est renforcée par la nature volcanique de Syrtis Major Planum et par l'étroite corrélation, observée dès 2004, entre le taux d'humidité d'une région et la concentration de méthane dans l'atmosphère[29].
Sur les planètes géantes
Article détaillé : géante gazeuse.On trouve également du méthane sous forme de nuages et de brume sur Uranus et Neptune, de gaz non condensé dans les atmosphères de Jupiter et de Saturne ; ainsi que peut-être sur les exoplanètes Epsilon Eridani c et Fomalhaut b.
Utilisation
Les gisements fossiles de gaz naturel comportent entre 50 et 60 % de méthane, le gaz naturel brut est épuré avant d'être injecté sur le réseau de distribution.
La proportion de méthane présent dans le gaz naturel que nous utilisons est supérieure à 90% dans la plupart des gaz.Le méthane « biologique » ou biogénique, ou biogaz, qui est produit par la fermentation anaérobie de matière organique comporte 50 à 80 % de méthane, (60-65% généralement)
Le biogaz produit dans les décharges pourrait être (bien davantage) récupéré et valorisé sous forme d'électricité, de chaleur ou comme carburant automobile. Pour l'instant, seules quelques expériences isolées (dans des fermes, des déchèteries...) ont vu le jour, spécialement dans les régions les plus froides (nord de l'Allemagne, de la France, Scandinavie...), mais la rentabilité économique de ces installations est loin d'être acquise.[réf. nécessaire] (voir l'expérience en prison rwandaise).
Le méthane est valorisable comme combustible mais d'autres usages en seraient possibles. Par exemple, des chercheurs ont réussi à transformer à température presque ambiante (40 °C) du méthane en un ester (propionate d’éthyle) potentiellement valorisable. Pour ce faire, un carbène (composé très réactif) a été introduit dans une liaison du méthane via un catalyseur organométallique[30].
Environnement : contribution à l'effet de serre
Un gaz à effet de serre
Le méthane est un gaz à effet de serre qui influe sur le climat, pris en compte en tant que tel par la directive 2003/87/CE. Il absorbe une partie du rayonnement infrarouge émis par la Terre, et l'empêche ainsi de s'échapper vers l'espace. Ce phénomène contribue au réchauffement de la Terre.
De plus il contribue aussi indirectement à l'effet de serre en diminuant la capacité de l'atmosphère à oxyder d'autres gaz à effet de serre (comme les fréons). Son utilisation comme combustible émet du CO2 à hauteur de 380 Mt/an (les émissions industrielles avoisinent 6000 Mt/an) et de la vapeur d’eau, autre gaz à effet de serre important.
L'influence du méthane sur le climat est moins importante que celle du dioxyde de carbone mais elle est quand même préoccupante. Une molécule de méthane absorbe en moyenne 23 fois plus de rayonnement qu'une molécule de dioxyde de carbone sur une période de 100 ans, son potentiel de réchauffement global (PRG) est donc de 23 ; à échéance 20 ans, son PRG est même de 62. Le méthane est considéré comme le 3e gaz responsable du dérèglement climatique, après le CO2 et les fréons)[31].
Méthane et ozone
Le méthane interagit avec l'ozone, différemment dans les hautes et les basses couches de l'atmosphère.
Selon les modélisations tridimensionnelles disponibles en chimie de la troposphère, diminuer les émissions anthropiques de CH4 pourrait être « un puissant levier pour réduire à la fois le réchauffement climatique et la pollution de l'air par l'ozone de fond troposphérique » [32].Variations récentes de teneur de l'air
Le taux de méthane actuel dans l'atmosphère terrestre est d'environ 1800 ppb, soit 0,00018%. Il s'est maintenu [33],[34] entre 1780 et 1810 ppb de 2000 à 2010 avec une grande variation suivant la latitude[35]. Dans le passé, le taux de méthane dans l'atmosphère a varié souvent parallèlement à la température[réf. nécessaire]. Ce taux a augmenté d'environ 150 % depuis 1750 et atteint aujourd'hui un taux inégalé[36] dans l'histoire, principalement suite aux activités humaines. Une augmentation des teneurs a été constatée en 2008/2009 [37]. Les modélisations informatiques de la cinétique du CH4 dans l'air ont permis de remonter à la source des émissions pour les 20 dernières années de mesures atmosphériques. Selon ces travaux, la réduction des émissions et/ou une utilisation plus efficace du gaz naturel dans l'hémisphère Nord (amélioration de l'étanchéité des tuyaux de gaz, récupération du grisou ou du gaz de décharge pour produire de l'électricité..) ont permis une baisse des émissions dans les années 1990, mais une nette augmentation des émissions provenant de combustibles fossiles dans le nord de l'Asie a ensuite de nouveau été constatée (2006...). Le recul des zones humides, par drainage entre autres, et, dans une moindre mesure, les feux de brousse, expliquent aussi les variations mesurées du CH4 atmosphérique sur 20 ans[38].
 Augmentation du taux de méthane atmosphérique, en ppb.
Augmentation du taux de méthane atmosphérique, en ppb.
Le méthane serait responsable d'environ 20% du réchauffement moyen enregistré depuis le début de la révolution industrielle.
On estime que sans sa présence, la température moyenne de surface de la Terre serait plus basse de 1,3 °C[réf. nécessaire].
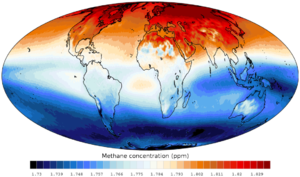
 Taux de méthane à la limite supérieure de la troposphère.Saisonnalité relevée par la NOAA.
Taux de méthane à la limite supérieure de la troposphère.Saisonnalité relevée par la NOAA.Sources
Globalement, les émissions de CH4 vers l’atmosphère s'élèveraient à 500 Mt/an, dont les trois quarts proviennent de sources d’origine anthropique.
Les principales sources (par ordre d'importance quantitative estimée) sont[réf. nécessaire] :
- La fermentation anaérobie sous l'eau : 32% des émissions.
Elles ont surtout lieu dans les zones humides (naturelles ou artificielles avec en particulier les rizières et barrages hydroélectriques qui ont inondé des forêts ou accumulé une importante charge organique. Il peut aussi s'agir d'estuaires devenus dystrophes ou de n'importe quelle zone d'accumulation de pollution organique, décharge par exemple).
Les marais, les mangroves tropicales et les rizières sont sujets à l’action de bactéries méthanogènes en milieu anaérobie.
La température agit sur les émissions, qui atteignent leur valeur maximale entre 37 °C et 48 °C, d’où une amplification des émissions en cas de réchauffement. En présence d'une quantité suffisante d'oxygène, l'activité bactérienne elle-même contribue à échauffer le matériau, mais avec émission de CO2.
L'analyse des gaz piégés il y a 10 000 ans dans les glaces polaires et l'étude du rapport isotopique carbone 13/carbone 12 du carbone de ces molécules de méthane (δ13CH4) ont montré un doublement des taux de CH4 lors de la dernière transition glaciaire-interglaciaire. Ce doublement est dû, à près de 50 %, aux régions marécageuses tropicales, renforcées par les émissions des tourbières boréales favorisées par la transition climatique[39].
 Analyse par satellite montrant les concentrations de méthane (parties par million en volume) en surface (en haut) et dans la stratosphère (en bas).
Analyse par satellite montrant les concentrations de méthane (parties par million en volume) en surface (en haut) et dans la stratosphère (en bas).
- Les pergélisols : ils contiennent du méthane qu'ils libèrent en fondant quand le climat se réchauffe. Dans les années 2000, une étude internationale[40] (2003 - 2008) dans les eaux du plateau arctique de Sibérie orientale (plus de 2 millions de km2) a montré que les pergélisols immergés perdaient des quantités significatives de méthane, plus et plus rapidement qu'il n'était prévu par les modèles existants. Sur les sites étudiés durant ces 5 ans, plus de 50 % des eaux de surface et plus de 80% des eaux profondes présentaient un taux de méthane environ huit fois supérieur à la normale[41]. Le taux actuel moyen de CH4 en Arctique est d'environ 1,85 ppm, soit la plus élevée depuis 400.000 ans alerte Natalia Chakhova[41]. Ce taux est encore plus élevé au dessus du plateau arctique de Sibérie orientale et N Chakhova parle de signes d'instabilité dans le permafrost immergé "S'il continue à se déstabiliser, les émissions de méthane (...) seront beaucoup plus importantes" [41].
- Les énergies fossiles : 21 % des émissions.
Le gaz naturel est composé à 90 % de méthane. Les fuites dans l'atmosphère lors de son extraction, de son transport, de son traitement et de sa distribution pourraient représenter jusqu'à 2 % de la production de gaz naturel, les 3/4 de ces fuites ayant lieu chez le client, après le compteur. Le graphe ci-contre montre également l'importance des pertes lors de la production : on distingue clairement certains champs gaziers de grande taille, entre autres la mer Caspienne et la Sibérie.
De même, le gaz piégé dans les filons de charbon lors de sa formation (le grisou) est relâché lors de l’extraction du minerai. Si l'on ne veut pas réduire l’utilisation de ces énergies fossiles et sans un investissement massif dans les énergies alternatives, il faut donc rechercher des solutions pour limiter les fuites.
- Les ruminants : 16 % des émissions.
Le méthane est un produit de la digestion incomplète lors de la fermentation gastro-entérique des ruminants. Une seule vache peut émettre 100 à 500 litres de méthane par jour. À cela s’ajoutent les émissions liées aux déchets (excréments, fumier d'étable) qui continuent leur décomposition avec une méthanisation plus ou moins marquée selon le contexte. Parmi les solutions étudiées : améliorer l'alimentation animale, éviter le stockage des déchets qui ne produisent du méthane qu'à l'abri de l'air, ou au contraire récupérer ce méthane et le valoriser énergétiquement. L’apport de lipides alimentaires riches en acides gras polyinsaturés dans la ration des ruminants est une piste prometteuse. Des essais menés sur vaches laitières au centre INRA de Clermont ont montré qu’un apport de 6 % de lipides issus de la graine de lin a diminué la production de méthane des animaux de 27 à 37 % [42].
- Les déchets humains : 12 % des émissions.
Les décharges fermentent et émettent de grandes quantité de méthane ; ce gaz pourrait être réutilisé comme source d’énergie[43].
- La biomasse : 10 % des émissions.
Le méthane émis provient surtout de l'oxydation incomplète des végétaux, lors de certains processus de décomposition organique naturelle (comme les feuilles mortes des sous-bois accumulées sous l'eau, fermentation de vases riches en matière organique). Certaines espèces (Termites) peuvent produire des quantités significatives de méthane.
- Les sédiments et océans : 4 % des émissions, mais qui pourrait fortement augmenter.
Les hydrates contenant du méthane (clathrates) pourraient émettre du gaz en cas de perturbation de la température océanique et/ou du dégel de certains sols riches de la toundra sibérienne et canadienne, mais ces émissions sont limitées actuellement.
Toutefois, une augmentation de température entraine une augmentation de l'émission de CH4 par les clathrates. Cette source pourrait donc constituer une véritable bombe à retardement climatique en cas de réchauffement des fonds océaniques.
Prospective : Les variations futures de ces émissions sont incertaines, mais on prévoit une augmentation des apports de l’énergie fossile, des déchets, des sources agricoles et marines du fait du développement de la population mondiale, de l’industrialisation de certains pays et de la demande croissante en énergie, ainsi que du réchauffement climatique. Mais, comme indiqué plus haut, le fait est, en contradiction avec ces « prévisions », que la concentration du méthane n'augmente plus.
Les puits de méthane
Les différents mécanismes d’élimination du méthane atmosphérique retirent environ 515 Mt/an. Le principal puits à CH4 est le radical hydroxyle OH. contenu dans l’atmosphère, qui contribue à 90% de la disparition de CH4 . Le radical OH•, agent oxydant des principaux polluants de l’atmosphère (CH4, CO, NOx, composés organiques), provient de la dissociation photochimique de O₃ et de H2O. La teneur en radical hydroxyle est donc influencée par la concentration atmosphérique en CH4 mais aussi par celle de ses produits, dont CO. De même, divers mécanismes affectent la teneur en OH. :
- l’augmentation de concentration urbaine en NOx engendre plus de formation d’O3 et donc plus de dissociation en OH. ;
- la chute de la concentration d’O3 stratosphérique induit plus de rayonnement UV atteignant la troposphère et donc plus de dissociation d’O3 troposphérique ;
- l’augmentation de la vapeur d’eau résultant de l’augmentation de la température moyenne produit plus de nuages bloquant les flux de protons, effet réduisant la formation d’OH•, et plus de vapeur d’eau, réactif de formation d’OH•.
On a constaté que depuis 1750, le niveau d’OH• a diminué d’environ 20% du fait de l’augmentation en CO et CH4, et est aujourd’hui stable. D’ici 2050, ce niveau devrait encore diminuer de 25%, ce qui aura un impact important sur les teneurs en éléments traces gazeux. Les 10% restants sont dus à l’oxydation du méthane en terrain sec par des bactéries méthanotrophes qui l’utilisent comme source de carbone, ainsi que par son transfert vers la stratosphère.
L'évolution de la concentration en méthane semble marquer le pas[44] (2007) ; cela pourrait s'expliquer par une destruction accélérée de molécules d'ozone O3, catalysée par des radicaux NO. en plus grande quantité[45],[46].
Réduire les émissions de méthane et/ou en faire un carburant
Il existe des moyens de diminuer les émissions de méthane pour diminuer son action sur l'effet de serre :
- capter le méthane, ou biogaz, émis au niveau des décharges d'ordures ou stations d'épuration et le brûler (la combustion forme du CO2 qui a un effet de serre moins important). Cela permettrait de remplacer en partie d'autres énergies fossiles au lieu de le brûler en torchère comme c'est souvent le cas actuellement ;
- capter et utiliser le méthane, ou biogaz, produit au niveau des systèmes de stockage des effluents d'élevages ; récupérer le méthane émis lors de l'exploitation minière et après celle-ci ;.
- Développer une riziculture moins productrice de méthane, diminuer les taux de fertilisants, lutter contre la turbidité des eaux et la production de sédiments méthanogènes, et donc en amont contre l'érosion, la régression et dégradation des sols.
- au niveau personnel :
- réduire sa consommation de viande (en particulier bovine);
- réduire sa consommation de riz (voir le lien entre riziculture et l'effet de serre);
- composter ses déchets en veillant à ce que le compost soit suffisamment aéré et drainé.
Biocarburant de troisième génération
Pour produire un méthane de décharge assez pur et pour faire un bon biocarburant de troisième génération, un « digesteur anaérobie » inspirée de la digestion anaérobie à l'œuvre dans la panse des bovins est expérimenté au Canada. Des microorganismes méthanogènes vivant en symbiose avec les vaches savent produire plus de méthane que de CO2, mais ils ont des exigences précises, en température et humidité notamment. La difficulté est de conserver les conditions de vies optimales de ces organismes dans un milieu constitué de déchets, ce qu'on tente ici de faire au moyen d'électrodes spéciales régulant la température du milieu. Ce sont ensuite des fibres creuses constituées d'une membrane perméable qui devraient séparer le CO2 du méthane qui pourra ensuite être brûlé comme source d'énergie, utilisé par la carbochimie ou compressé et stocké[47].
Notes et références
- METHANE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- Entrée de « Methane » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 26 mai 2009 (JavaScript nécessaire)
- METHANE sur Hazardous Substances Data Bank
- (en) Robert H. Perry et Donald W. Green, Perry's Chemical Engineers' Handbook, USA, McGraw-Hill, 1997, 7e éd., 2400 p. (ISBN 0-07-049841-5), p. 2-50
- (en) Iwona Owczarek et Krystyna Blazej, « Recommended Critical Pressures. Part I. Aliphatic Hydrocarbons », dans J. Phys. Chem. Ref. Data, vol. 35, no 4, 18 septembre 2006, p. 1461 [lien DOI]
- (en) Iwona Owczarek et Krystyna Blazej, « Recommended Critical Temperatures. Part I. Aliphatic Hydrocarbons », dans J. Phys. Chem. Ref. Data, vol. 32, no 4, 4 août 2003, p. 1411 [lien DOI]
- (en) William M. Haynes, CRC Handbook of Chemistry and Physics, Boca Raton, CRC Press/Taylor and Francis, 1er juillet 2010, 91e éd., 2610 p. (ISBN 9781439820773) [présentation en ligne], p. 14-40
- (en) Irvin Glassman, Richard A. Yetter, Combustion, Elsevier, 2008, 4e éd., 773 p. (ISBN 978-0-12-088573-2), p. 6
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams, vol. 1, 2 et 3, Huston, Texas, Gulf Pub. Co., 1996 (ISBN 0-88415-857-8, ISBN 978-0-88415-858-5, ISBN 978-0-88415-859-2)
- Magalie ROY-AUBERGER, Pierre MARION, Nicolas BOUDET, Gazéification du charbon, ed. Techniques de l'Ingénieur, Référence J5200, 10 Dec 2009, p. 4
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, Boca Raton, CRC Press/Taylor and Francis, 17 juin 2008, 89e éd., 2736 p. (ISBN 9781420066791) [présentation en ligne], p. 10-205
- « méthane » sur ESIS, consulté le 15 février 2009
- « Méthane » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- (en) United Nations Environment Programme (UNEP) GRID-Arendal – 2003 Climate Change 2001: Working Group I: The Scientific Basis. 4.2 Trace Gases: Current Observations, Trends, and Budgets – 4.2.1 Non-CO2 Kyoto Gases – 4.2.1.1 Methane (CH4).
- (en) J. T. Kiehl et Kevin E. Trenberth, « Earth’s Annual Global Mean Energy Budget », dans Bull. Am. Meteorol. Soc., vol. 78, no 2, février 1997, p. 197-208 [texte intégral, lien DOI (pages consultées le 19 décembre 2010)]
- Biographie | http://www.cartage.org.lb/en/themes/biographies/MainBiographies/V/Volta/1.html
- (en) F. Suarez, J. Furne, J. Springfield et M Levitt, « Insights into human colonic physiology obtained from the study of flatus composition », dans Am J Physiol, vol. 272 (5 Pt 1), 1997, p. G1028–33.
- Présentation du programme MARMESONET par IFREMER
- Température d'auto-inflammation du méthane dans l'air
- (en) NASA Explores the Red Planet – 15 janvier 2009 Martian Methane Reveals the Red Planet is not a Dead Planet.
- (en) Michael J. Mumma, Geronimo L. Villanueva, Robert E. Novak, Tilak Hewagama, Boncho P. Bonev, Michael A. DiSanti, Avi M. Mandell, et Michael D. Smith, « Strong Release of Methane on Mars in Northern Summer 2003 », dans Science, vol. 323, no 5917, 20 février 2009, p. 1041-1045 (ISSN 0036-8075) [texte intégral, lien DOI (pages consultées le 25 décembre 2009)]
- (en) Franck Lefèvre et François Forget, « Observed variations of methane on Mars unexplained by known atmospheric chemistry and physics », dans Nature, vol. 40, 6 août 2009, p. 720-723 (ISSN 0028-0836) [texte intégral (page consultée le 26 décembre 2009)]
DOI:10.1038/nature08228 - (en) NASA Explores the Red Planet – 15 janvier 2009 Mars Methane Press Conference - Media Page.
- (en) Todd M. Hoefen, Roger N. Clark, Joshua L. Bandfield, Michael D. Smith, John C. Pearl et Philip R. Christensen, « Discovery of Olivine in the Nili Fossae Region of Mars », dans Science, vol. 203, no 5645, 24 octobre 2003, p. 627-630 (ISSN 0036-8075) [texte intégral (page consultée le 26 décembre 2009)]
DOI:10.1126/science.1089647 - (en) NASA Mars Reconnaissance Orbiter – 18 décembre 2008 Mineral Spectra from Nili Fossae, révélant la présence d'argiles riches en fer et en magnésium, d'olivine et de carbonate de magnésium.
- (en) 40th Lunar and Planetary Science Conference – 2009 B. L. Ehlmann, J. F. Mustard et S.L. Murchie, Detection of serpentine on Mars by MRO-CRISM and possible relationship with olivine and magnesium carbonate in Nili Fossae.
- (en) ESA News – 20 septembre 2004 Water and methane maps overlap on Mars: a new clue?
- Brève d’Actualité Pour la science, n° 405, Juillet 2011, page 7 (Brève non bourcée)
- Benjamin Dessus, Hervé Le Treut et Bernard Laponche, « Effet de serre, n'oublions pas le méthane » dans La Recherche (ISSN 0029-5671) n°417 (mars 2008) [lire en ligne (page consultée le 25 juillet 2008)]
- Fiore, A. M., D. J. Jacob, B. D. Field, D. G. Streets, S. D. Fernandes, and C. Jang (2002), Linking ozone pollution and climate change: The case for controlling methane, Geophys. Res. Lett., 29(19), 1919, doi:10.1029/2002GL015601 (Résumé)
- Concentration du méthane mesurée à Mauna Loa (Hawaï)
- Site du CSIRO (graphique montrant une stabilisation du CH4 atmosphérique (à l'époque non expliquée) de 2000 à 2003
- Évolution du taux de méthane atmosphérique
- http://www.ipcc.ch/pdf/assessment-report/ar4/wg1/ar4-wg1-spm-fr.pdf
- Bulletin ADIT pour l'Australie numéro 61 (2009 01 15) - Ambassade de France en Australie / ADIT, reprenant une information du CSIRO
- Communiqué (daté de 2006) du CSIRO intitulé "Explaining the methane mystery", Reference: 06/188
- Nature, Avril 2008
- étude dirigée par Natalia Chakhova et Igor Semiletov, Université de Fairbanks en Alaska
- http://lci.tf1.fr/science/environnement/2010-03/climat-la-menace-venue-du-fond-des-oceans-5758974.html TF1, rubrique Science/Environnement], mars 2010, consulté 2010 04 29
- Journal of Animal Science, 2007
- AFP. Des bus roulent déjà à Stockholm, et en essai à Oslo et Lille.
- Evolution de la concentration de méthane dans l'atmosphère
- Réactivité du méthane et de l'ozone en haute atmosphère
- Inversion des sources et puits de gaz dans l'atmospgère
- Brève avec Interview d'Edith Labelle, de l'Institut de technologie des procédés chimiques et de l'environnement du CNRC par nrc-cnrc. 2010-05-19, consulté 2010/07/14
Voir aussi
- Gaz à effet de serre
- Changement climatique
- Pyrolyse
- Gazogène
- Environnement
- Hydrate de méthane
- Méthanisation
- Archea méthanogène (espèce produisant du méthane);
- Méthanotrophes (espèces consommant du méthane pour s'en nourrir)
Catégories :- Produit chimique extrêmement inflammable
- Alcane linéaire
- Gaz combustible
- Gaz organique
- Gaz à effet de serre
- Réfrigérant
Wikimedia Foundation. 2010.