- Uranium
-
Uranium Protactinium ← Uranium → Neptunium Nd 
92U ↑ U ↓ Uqb Table complète • Table étendue Informations générales Nom, symbole, numéro Uranium, U, 92 Série chimique Actinides Groupe, période, bloc L/A, 7, f Masse volumique 19,1 g·cm-3 [1] Couleur Gris métallique No CAS No EINECS Propriétés atomiques Masse atomique 238,02891 ± 0,00003 u[1] Rayon atomique (calc) 175 pm Rayon de covalence 1,96 ± 0,07 Å [2] Rayon de van der Waals 186 Configuration électronique [Rn] 7s2 5f3 6d1 Électrons par niveau d’énergie 2, 8, 18, 32, 21, 9, 2 État(s) d’oxydation +3, +4, +5, +6 Oxyde base faible Structure cristalline Orthorhombique Propriétés physiques État ordinaire Solide Point de fusion 1 135 °C [1] Point d’ébullition 4 131 °C [1] Énergie de fusion 15,48 kJ·mol-1 Énergie de vaporisation 477 kJ·mol-1 Volume molaire 12,49×10-6 m3·mol-1 Pression de vapeur 1,63×10-8 Pa à 453,7 K [réf. nécessaire] Vitesse du son 3 155 m·s-1 à 20 °C Divers Électronégativité (Pauling) 1,38 Chaleur massique 120 J·kg-1·K-1 Conductivité électrique 3,8×106 S·m-1 Conductivité thermique 27,6 W·m-1·K-1 Énergies d’ionisation[3] 1re : 6,1941 eV 2e : 10,6 eV Isotopes les plus stables iso AN Période MD Ed PD MeV 232U {syn.} 68,9 a α
FS
cluster5,414
—
?228Th
PF
Pb233U {syn.} 159,2 ka α
FS
cluster4,909
—
?229Th
PF
Pb234U 0,0056 % 245,5 ka α
FS
clusters4,859
—
?230Th
PF
Pb ; Hg235U 0,720 % 703,8 Ma α
FS
clusters4,679
—
?231Th
PF
Pb ; Hg236U {syn.} 23,42 Ma α
FS
cluster4,572
—
?232Th
PF
206Hg238U 99,2745 % 4,4688 Ga α
FS4,270
—234Th
PFPrécautions 
Élément radioactifDirective 67/548/EEC[4] 
T+Phrases R : 26/28, 33, 53, Phrases S : (1/2), 20/21, 45, 61, SIMDUT[5] Produit non classifié SGH[6] 

DangerUnités du SI & CNTP, sauf indication contraire. L'uranium est un élément chimique de symbole U et de numéro atomique 92. C'est un élément naturel assez fréquent, d'abondance supérieure à celle de l'argent, comparable à celle du molybdène ou de l'arsenic, quatre fois moins abondant que le thorium. Il se trouve partout à l'état de traces, y compris dans l'eau de mer.
C'est un métal lourd radioactif (émetteur alpha) de période très longue (~ 4,5 milliards d'années pour l'uranium 238 et ~ 700 millions pour l'uranium 235). Sa faible radioactivité, additionnée à celle de ses descendants dans sa chaîne de désintégration, génère une puissance de 0,1 Watt par tonne, ce qui en fait, avec le thorium (quatre fois plus abondant, mais trois fois moins radioactif), la principale source de chaleur qui tend à maintenir les hautes températures du manteau terrestre, en ralentissant de beaucoup son refroidissement.
L'isotope 235U est le seul isotope fissile naturel. Sa fission libère une énergie voisine de 200 MeV par atome fissionné. Cette énergie est plus d'un million de fois supérieure à celle des combustibles fossiles pour une masse équivalente. De ce fait, l'uranium est devenu la principale matière première utilisée par l'industrie nucléaire.
Les réserves 3P (prouvées + probables + possibles) d'uranium étaient estimées par l'AIEA à 5,4 millions de tonnes dans le monde en 2009[7] réparties essentiellement entre l'Australie (31 %), le Kazakhstan (12 %), le Canada (9 %) et la Russie (9 %) ; la production mondiale s'est élevée quant à elle à environ 50 000 tonnes en 2009[8] répartis entre le Kazakhstan (28 %), le Canada (20 %), l'Australie (16 %), la Namibie (9 %), la Russie (7 %), le Niger (6 %) et l'Ouzbékistan (5 %).
Sommaire
Uranium naturel
Abondance
L'uranium est une ressource non renouvelable, pas toujours facilement exploitable dans des conditions économiques acceptables.
L'uranium est répandu dans les profondeurs du globe terrestre. La désintégration d'uranium 238 et 235 et d'autres radionucléides[9] entretiennent encore en énergie thermique le noyau terrestre, mais surtout[10] le manteau rocheux terrestre, et donc toute la géothermie.
Il est plus abondant dans la nature que l'or ou l'argent[11]. Il est également présent dans toute l'écorce terrestre, surtout dans les terrains granitiques et sédimentaires, à des teneurs d'environ 3 g/tonne[12]. Ainsi, le sous-sol d'un jardin sur un carré de 20 m de côté peut-il en contenir, sur une profondeur de 10 m, environ 24 kg. Ce qui fait de l'ordre du millier de milliards de tonnes rien que pour l'écorce terrestre, sans compter le manteau. En termes de réserve mondiale, cependant, l'immense majorité de cette masse est bien sûr inexploitable dans les conditions économiques actuelles. La gamme de valeur est très large selon les roches, et varie de 0,1 ppm dans les carbonates à 350 ppm dans les phosphates[13].
L'eau de mer contient environ 3 mg d'uranium par m3 selon le CEA et la COGEMA[14], soit 4,5 milliards de tonnes d'uranium dissous dans les océans.
Les eaux douces en contiennent souvent aussi en diverses concentrations ; dont par exemple le Rhône qui en charrie environ 29 t/an, provenant essentiellement du ruissellement des roches uranifères des Alpes. Pourtant, en extraire de l'eau ne serait pas énergétiquement rentable[15].
La production mondiale a commencé son expansion après 1945 et a atteint les 10 000 t. dès 1953, 50 000 t. en 1958, décroit jusqu'à 30 000 t en 1965, remontre jusqu’à un plateau de 65 000 en 1980, redescend jusqu’à 30 000 t. dans les années 1990 et remonte dans les années 2000.
Au niveau mondial, la production de 2009 est estimée à 50 572 tonnes, dont 27,3 % extraites du Kazakhstan, État qui a vu sa production en très forte hausse dans les années 2000 passant de 3 300 t en 2003 à 17 803 t en 2001. D'autres ressources importantes sont détenues par le Canada (20,1 %), l'Australie (15,7 %), la Namibie (9,1 %), la Russie (7,0 %), et le Niger (6,4 %). Elle est [16].
À consommation constante, les réserves exploitables dans les conditions actuelles seront à sec dans moins d'un siècle, estiment les experts du Energy Watch Group. Et encore, c'est une prévision optimiste, tant la demande augmente, poussant déjà les pays producteurs à exploiter des gisements jugés peu rentables autrefois. Cependant, les quantités exploitables peuvent être multipliées par un facteur de l'ordre de 40 grâce à la surgénération, qui permet de recycler aussi bien l'uranium appauvri que les actinides produits.
Article détaillé : Réserves mondiales.Dans la mer et les eaux naturelles
Les concentrations en uranium (l'élément chimique uranium) dans les eaux « naturelles » sont les suivantes :
- La mer : 3,3 µg/l[17]
- Le Rhône : 0,56 µg/l (débit annuel d’uranium = 29 tonnes)
- L'Indus : 4,94 µg/l
- Le Gange : 7 µg/l
- Le Huang He : 7,5 µg/l
Dans les eaux de boisson :
- Eau de Badoit : 58 µg/l à la source, 5,45 µg/l après traitement[18]
- Eau de Vichy : 20 µg/l
- Le seuil OMS pour les eaux de boisson est fixé temporairement à 2 µg/l[19]
Ce seuil temporaire de 2003 de l'OMS est maintenant obsolète, le nouveau seuil est de 1,4 mg/l avec une recommandation à 15 µg/l depuis 2006 (voir aussi en fin d'article pour les références).
Découverte
 L'uranite, ou pechblende, est le minerai d'uranium le plus commun.
L'uranite, ou pechblende, est le minerai d'uranium le plus commun.
L'uranium est mis en évidence en 1789 par le chimiste prussien Martin Heinrich Klaproth qui examine un morceau de roche qu'on lui a apporté de Saint Joachimsthal[20]. Cette roche est de la pechblende (UO2), un minerai d'uranium. Klaproth donna le nom d'« urane » ou « uranite » au composé qu'il venait d'identifier, en référence à la découverte de la planète Uranus faite par William Herschel 8 ans plus tôt (1781).
Ce n'est qu'en 1841 que le chimiste français Eugène-Melchior Péligot établit que l'urane était composé de deux atomes d'oxygène et d'un de métal qu'il isola et nomma uranium. Il estima alors[21] la masse volumique de l'uranium à 19 g/cm3.
Le Français Henri Becquerel ne découvrit la radioactivité de l’uranium que beaucoup plus tard, en 1896, lorsqu'il constata que des plaques photographiques placées à côté de sels d'uranium avaient été impressionnées sans avoir été exposées à la lumière. Les plaques avaient été noircies par les rayonnements émis par les sels : c'était la manifestation d'un phénomène jusqu'alors inconnu, la radioactivité naturelle.
Gisements et exploitation
Article détaillé : Extraction de l'uranium.La solubilité de l’uranium est liée aux conditions d’oxydoréduction du milieu. Dans des conditions oxydantes (augmentation de la concentration en oxygène dissous), l’uranium devient plus facilement soluble (passage de la valence IV à la valence VI). Les conditions oxydantes favorisent la complexation de l’uranium en solution avec certains ligands[13]. Les principaux ligands sont, par ordre d’affinité décroissante:
- les carbonates,
- les groupements hydroxyles,
- les phosphates.
L’uranium présente une très forte affinité pour les oxyhydroxydes de fer[13]. Cette adsorption peut s’effectuer très rapidement lors de changements des conditions d’oxydoréduction, une diminution de la teneur en oxygène (condition réductrice) engendre une précipitation rapide de l’uranium sous formes d’oxyde (UO2)[13]. C'est une telle précipitation qui est par exemple à l'origine du gisement d'Oklo.
Le minerai d'uranium est appelé uraninite, ou pechblende. Ce minerai, extrait notamment au Congo, au Canada, en Russie, au Kazakhstan, en Namibie et au Niger, est néanmoins trop peu concentré en isotope fissile pour être utilisé directement dans les centrales nucléaires de type Pressurized Water Reactor. C'est la raison pour laquelle il doit être purifié sous forme de yellowcake puis enrichi en uranium 235 dans des centrifugeuses. Les centrales de type CANDU utilisent l'uranium naturel mais exigent beaucoup d'eau lourde comme modérateur.
Procédé de synthèse
Deux étapes sont nécessaires à la synthèse :
- le raffinage :
- Le minerai d'uranium pulvérisé « yellowcake » — est dissous dans l'acide nitrique, fournissant une solution de nitrate d'uranyle UO2(NO3)2.
- éventuellement filtration.
- Le nitrate d'uranyle pur est obtenu par extraction par solvant, avec une solution de TBP.
Cette étape permet d'obtenir un nitrate d'uranyle UO2(NO3)2 de grande pureté (>99,95 %).
- la conversion en elle-même :
- précipitation du nitrate d'uranyle par l'ammoniac gazeux pour obtenir du diuranate d'ammonium (NH4)2U2O7 (DUA),
- calcination du diuranate d'ammonium, vers 400 °C, pour produire l'UO3,
- réduction de l'UO3 par l'hydrogène pour obtenir de l'UO2,
- hydrofluoration d'UO2 par l'acide fluorhydrique HF dans un four pour produire du tétrafluorure d'uranium UF4,
- réduction de l'UF4 avec Calcium finalement à obtenir du metal pure
-
Yellowcake + nitrate d'uranyle
Propriétés
Propriétés radiologiques
Article connexe : médecine nucléaire.Produit fissible naturel
L'uranium 235 est le seul nucléide naturel qui soit fissile, ou fissible, autrement dit il peut, par capture de neutron, se scinder en deux noyaux fils avec émission de neutrons (fission nucléaire). Par suite, l'uranium enrichi en cet isotope est aujourd'hui utilisé comme combustible nucléaire dans les réacteurs nucléaires (voir cycle du combustible nucléaire) ou encore dans les armes nucléaires, que ce soient les bombes atomiques, ou comme amorce dans les bombes H.
Au contraire de l'uranium 235, l'uranium 238, lorsqu'il capture un neutron, ne fissionne pas (sauf neutrons rapides). Il devient de l'uranium 239 instable qui, par désintégration β-, va se transformer en neptunium 239. Or ce dernier est lui aussi radioactif β-, et va alors donner naissance à un nouveau noyau, le plutonium 239. Ce radioisotope est fissile, comme l'uranium 235. L'uranium 238 est un isotope fertile, qui peut produire des produits fissiles.
L'uranium 234 n'est, lui, ni fissile, ni fertile, et provient de la décomposition radioactive de l'uranium 238 comme indiqué dans la précédente section.
La fission d'un atome d'uranium 235 libère de l'ordre de 200 MeV (la valeur exacte dépendant des produits de fission). De même, la fission d'un atome de plutonium 239 libère de l'ordre de 210 MeV. Ces valeurs sont à comparer avec celles de la combustion de carburants fossiles, qui libèrent de l'ordre de 5 eV par molécule de CO2 produit[22]: l'ordre de grandeur des énergies libérées par les combustibles nucléaires est un million de fois plus importante que celle des énergies fossiles chimiques.
Le potentiel d'énergie de l'uranium n'est exploité que très partiellement dans les réacteurs actuels, mais la différence reste nette : 1 kg d'uranium naturel permet la production d'environ 500 000 MJ[23] dans un réacteur conventionnel, à comparer avec les 49 MJ obtenus par 1 kg de gaz naturel, 45 MJ pour 1 kg de pétrole, et 20 à 30 MJ pour le charbon[24].
Les isotopes de l'uranium naturel
L'uranium a 17 isotopes, tous radioactifs, dont 3 seulement sont présents à l'état naturel : 238U ; 235U et 234U. On trouve dans une tonne d'uranium naturel pur 7,1 kg d'uranium 235 et 54 g d'uranium 234, le reste étant de l'uranium 238.
- Les isotopes 238U et 235U ont beaucoup d'applications, militaires notamment, mais aussi civiles, comme, par exemple, la datation de l'âge de la Terre à partir de la datation radiométrique à l'uranium-plomb ou à l'uranium-thorium.
Quelles que soient les teneurs en uranium des milieux, les proportions entre les deux principaux isotopes formant l'uranium naturel sont pratiquement les mêmes : 238U : 99,28 % ; 235U : 0,71 %.
- La proportion d'235U décroît à l'échelle des temps géologiques. Leur rapport de formation dans une supernova est de un à 1,65[25], c'était (approximativement) la proportion de l'uranium présent sur Terre il y a ~4,5 milliards d'années, ce qui est juste inférieur à l'âge de la formation de ces isotopes (voir formation et évolution du système solaire).
Il y a deux milliards d'années, lors de la période de fonctionnement du réacteur nucléaire naturel d'Oklo, la proportion d'235U était encore de près de 4 %, ce qui a permis à ce gisement d'atteindre la criticité, lors de la précipitation des composés dissouts formant le nouveau minerai.
- Le troisième isotope, 234U, appartient à la chaîne de désintégration de l'238U.
L'isotope 234 est toujours présent sur Terre, à l'état de traces, bien qu'il ait une demi-vie de seulement 245 500 ans ; car il est constamment généré par désintégration radioactive de l'isotope 238 (après 3 étapes : une transition α donnant 234Th, puis deux transitions β- donnant 234Pa, puis 234U). Quand il est à l'équilibre séculaire, la proportion entre 238U et 234U est égale au rapport des demi-vies, soit 0,0056 %.Cependant, les rapports isotopique peuvent varier légèrement d'un gisement à l'autre, entre 0,005 % et 0,006 % pour l'234U[26], du fait d'une légère différence de comportement dans le changement U6+↔ U4+[27]. Le rapport isotopique 234U/238U peut être perturbé par différents processus environnementaux, tandis que le rapport 235U/238U reste assez largement constant[11].
L'industrie nucléaire produit deux autres isotopes artificiels de l'uranium, relativement stables à échelle humaine :
- L'isotope 236 est produit en réacteur par irradiation de l'isotope 235, qui dans près de 18 % des cas ne fissionne pas mais absorbe un neutron. Il tend à s'accumuler dans l'uranium de recyclage, dont il augmente fortement la radioactivité, et dont (étant neutrophage) il diminue le potentiel énergétique.
Bien qu'ayant une demi-vie de 23 millions d'années, presque du centuple de celle de l'isotope 234, cet isotope a disparu depuis longtemps dans la nature. Son produit est du thorium 232, qui s'est « confondu » au thorium 232 « initial » et se trouve à présent majoritairement sous cette forme ainsi que des éléments de sa chaîne de désintégration. - L'isotope 233 est un élément fissile produit en réacteur par irradiation du thorium. Il est à la base du cycle du thorium. Sa demi-vie de 159 000 ans est largement supérieure à celle du plutonium.
Activité massique
 Spectre gamma d'un minerai d'uranium, permet d'identifier la présence des radionucléides 226Ra, 214Pb, 214Bi de la chaîne de désintégration de l'uranium 238 (lui-même non émetteur gamma).
Spectre gamma d'un minerai d'uranium, permet d'identifier la présence des radionucléides 226Ra, 214Pb, 214Bi de la chaîne de désintégration de l'uranium 238 (lui-même non émetteur gamma).
L'uranium pur est radioactif, son activité massique dépendant à la fois de son enrichissement, et de la fraîcheur de sa purification chimique.
Si l'on considère les isotopes purs de l'uranium, 238U a une activité massique de 12,4 Bq/mg, 235U de 80 Bq/mg, et 234U de 230 Bq/µg, soit 230 000 Bq/mg — quatre ordres de grandeur au-dessus des précédents.
- L'uranium naturel, quand il est chimiquement purifié (essentiellement composé de 235U et de 238U en équilibre avec son descendant 234U), a une activité spécifique de l'ordre de 25 Bq/mg. En amont, à poids égal d'uranium, la radioactivité d'un minerai, où il est en équilibre avec tous les éléments radioactifs de sa chaîne de désintégration, est naturellement 3 (si le Radon peut s'échapper) à 7 fois plus importante.
- L'uranium enrichi est plus actif, partiellement du fait de l'activité plus importante de 235U (6,33 fois plus radioactif que l'238U), mais surtout à cause de la concentration différentielle en 234U (10 000 fois plus radioactif que 238U), toujours présent à l'état de traces dans la chaîne de désintégration de l'isotope 238. Elle atteint typiquement 2 500 Bq/mg pour un enrichissement de 90 % (uranium dit de qualité militaire). Pour les enrichissements de l'ordre de 3 %, destinés aux centrales nucléaires, l'activité spécifique est de l'ordre de 60 Bq/mg.
- Inversement, l'uranium appauvri est presque entièrement débarrassé non seulement de sa fraction de l'isotope 235, mais également de son descendant l'isotope 234. Immédiatement après l'enrichissement, son activité massique tend à se rapprocher de celle de 238U pur, c'est-à-dire de l'ordre de 12,5 Bq/mg (en pratique, un peu plus du fait de la présence résiduelle d'235U). Cependant, l'équilibre entre 238U et ses deux premiers descendants (le thorium 234 de période 24 jours, et le protactinium 234) est atteint rapidement, en 2 mois. La radioactivité spécifique à l'équilibre (avec ses deux premiers descendants) étant déjà de 41,5 Bq/mg[28].
Propriétés chimiques
De symbole U, l'uranium est le dernier élément naturel du tableau périodique. Chaque atome d'uranium possède 92 protons et entre 125 et 150 neutrons.
À l'état pur, l'uranium solide est un métal radioactif gris à blanc (voire argenté), qui rappelle la couleur du nickel. Il est dur et très dense. De plus, l'uranium est l'atome le plus lourd (qui contient le plus de nucléons) présent naturellement sur la Terre.
En raison de son affinité pour l'oxygène, l'uranium s'enflamme spontanément dans l'air à température élevée, voire à température ambiante lorsqu'il se trouve sous forme de microparticules. Il est pyrophorique.
L’uranium a quatre valences possibles (+III à +VI), les valences IV et VI étant les plus répandues dans les minerais. Les conditions de passage de la valence IV à la valence VI dépendent du potentiel d’oxydoréduction du milieu[13].
Ainsi dans la nature, l'élément uranium se retrouve toujours combiné à d’autres éléments, tels l'oxygène, l'azote, le soufre, le carbone sous forme d'oxydes, de nitrates, de sulfates ou de carbonates. On le trouve, par exemple, combiné à l'oxygène dans l'uranite et la pechblende, deux des principaux minerais d'uranium, constitués d'oxyde uraneux (UO2).
Enfin, les ions uranyle UO22+ se dissolvent très bien dans la plupart des acides, comme dans l'acide nitrique HNO3 ou l'acide fluorhydrique HF en donnant des sels d'uranyle tels que le nitrate d'uranyle UO2(NO3)2. L'équation de la dissolution de l'ion uranyle en sel d'uranyle dans l'acide nitrique est la suivante :
Dérivé organo-uranien
Comme la plupart des métaux, l'uranium a une chimie organo-métallique et de nombreux complexes organo-métalliques tel l'uranocène sont connus.
Applications
Utilisations historiques
Le minerai d'uranium a été utilisé comme pigment dans la verrerie, la céramique et la faïence, sous forme de diuranate de sodium ou d'ammonium[11]. Dans le verre, l'uranium est typiquement utilisé à des concentrations de 0,1 % à 2 % en masse pour produire de l'ouraline, solide d'un jaune fluorescent ou légèrement vert facile à identifier[11]. Il a été utilisé pour colorer des céramiques dentaires à de très faibles concentrations[11]. Il produit une pigmentation jaune à faibles concentrations, puis crème, orange, brun, vert, ou noir, quand la concentration augmente[11].
Il sert également de catalyseur dans certaines réactions chimiques spécialisées et dans des films photographiques[11].
L'uranium appauvri a également été utilisé pour ces emplois physico-chimiques[11]. Sous forme d'acétate d'uranyle et de zinc (réactif de Blanchetière), il donne des cristaux jaune-verts fluorescents avec les ions sodium Na+. Il permet donc de caractériser facilement ce métal lors des analyses en chimie minérale.
Industrie nucléaire
Historiquement, la première utilisation du minerai d'uranium par l'industrie nucléaire a été d'en extraire le radium, pour des applications médicales.
Le principal usage contemporain de l'uranium exploite ses propriétés nucléaires.
- L'uranium 235 est le seul isotope fissile naturel, ce qui permet l'exploitation de l'uranium dans les réacteurs nucléaires (après un éventuel enrichissement), ainsi que pour la fabrication d'armes nucléaires (après un fort enrichissement).
- L'uranium 238 est à la fois fissible dans les réacteurs à neutrons rapides, et fertile : par capture neutronique il se transforme finalement en plutonium 239, fissile. Il est envisagé d'exploiter cette double possibilité dans le cycle du combustible nucléaire, pour des cycles fondés sur la combustion du plutonium.
- L'uranium 233, qui peut être artificiellement produit par irradiation du thorium, est également fissile en neutrons thermiques. Cette possibilité est à la base d'un cycle surgénérateur fondé sur le thorium.
Contrôle des matières nucléaires
L'uranium est une matière nucléaire dont la détention est réglementée (Article R1333-1 du code de la défense).
Uranium appauvri
L'uranium appauvri, un sous-produit de l'enrichissement de l'uranium, est très prisé pour sa dureté et sa densité. Il est pyrophorique, employé comme arme antichar dotée d'un fort pouvoir à la fois pénétrant et incendiaire : à très haute vitesse, il perfore aisément les blindages en s'enflammant lors de l'impact, provoquant un incendie qui fait exploser le véhicule touché. Ainsi, des munitions à base d'uranium appauvri (obus de 20 à 30 mm des avions ou hélicoptères chasseurs de chars) ont été utilisées lors des guerres du Golfe (guerre du Koweït et guerre en Irak) et du Kosovo.
Dans ses emplois militaires, l'uranium appauvri est également utilisé pour faire des plaques de blindages[11].
L'uranium appauvri a aussi été utilisé comme contrepoids en aviation, sur les premiers Boeing 747, les McDonnell Douglas DC-10, les Lockheed L-1011 TriStar par exemple[11], ce qui pose le problème du recyclage de ces avions qui, pour beaucoup, arrivent en fin de vie. Dans cet emploi, il est progressivement remplacé par le tungstène[11]. La quille de certains voiliers de compétition ont contenu ce matériaux.
Il est également plus efficace que le plomb[11] pour les écrans de protection radiologique.
Avec un complément de plutonium, l'uranium appauvri constitue un combustible nucléaire appelé « combustible MOX ». Il sert d'élément fertile dans les réacteurs, où l'238U se transforme par irradiation en 239Pu fissile.
Toxicité
Toxicité chimique
L'uranium présente une toxicité comparable à celle d'autres métaux lourds, du même ordre que celle du plomb. La dose létale pour l'homme semble être de quelques grammes[29].
La majeure partie de l’uranium pénétrant dans l’organisme (plus de 95 %) n’est pas absorbée et s’élimine dans les fèces. Environ 67 % de l’uranium sanguin est filtré par les reins et excrété dans les urines dans les 24 heures[30].
Le système digestif absorbe globalement entre 0,2 et 2 % de l’uranium présent dans l’eau et les aliments. Les composés solubles de ce métal sont plus facilement absorbés que les composés insolubles[30]. Le contenu normal d'un corps humain en équilibre avec son environnement est de l'ordre de 90 à 150 µg d'uranium[31], résultant d'un apport journalier de l'ordre de 1 à 2 µg/jour par l'eau courante et l'alimentation. Les deux tiers s'accumulent dans les os, 16 % dans le foie, 8 % dans les reins et 10 % dans les autres tissus[30].
Le rein est l'organe critique pour la toxicité chimique. Les études à long terme portant sur des professionnels exposés à l’uranium ont signalé certains troubles de la fonction rénale selon l’intensité de l’exposition. Il semblerait néanmoins d’après certaines données que ces troubles puissent être transitoires et que la fonction rénale revienne à la normale après élimination de la source d’une exposition excessive[30]. Le seuil de toxicité chimique rénale est estimé à 70 µg/kg de poids corporel ou 16 µg/g de rein (limite de 3 µg/g de rein pour la protection des travailleurs)[32].
Radiotoxicité
Quel que soit son enrichissement, la radioactivité de l'uranium est toujours du type alpha de l'ordre de 4,5 MeV. Sa radiotoxicité dépend donc de son activité massique et faiblement de sa composition. Elle est de l'ordre de 0,6 µSv/Bq (F) à 7 µSv/Bq (S) en inhalation, 0,05 µSv/Bq (F) à 0,008 µSv/Bq (S) en ingestion, les poumons et les os étant alors les organes critiques[33].
La radiotoxicité de l'uranium serait du même ordre de grandeur que celle de la toxicité chimique : elle l'emporte pour des enrichissements supérieurs à 6 %, la toxicité chimique étant sinon prépondérante[28].
Effets sur la reproduction
L'uranium est aussi reprotoxique via notamment un effet délétère sur les organes reproducteurs ; soit du fait de sa radioactivité, soit du fait de sa chimiotoxicité, et peut-être des deux.
L'uranium a chez l'animal des effets démontrés ; sur le système reproducteur: Chez le rongeur de laboratoire, la barrière hémato-testiculaire (ou BHT) qui était réputée protéger le testicule peut en être franchie par le plutonium, l'américium et le polonium au moins grâce à la transferrine.- De l'uranium est significativement trouvé dans les testicules de rats ayant reçu un implant d'uranium dans le muscle d'une des pattes. Les récepteurs à la transferrine présent dans l'épithélium séminifère humain pourrait donc expliquer la présence d'uranium dans le sperme de soldats blessés par des munitions à l'uranium appauvri.
- Des rats ayant des implants sous-cutanés d'uranium, et des souris abreuvées d'eau contenant de l'uranium produisent des cellules de Leydig altérées, ce qui perturbe la production d'hormones stéroïdes et se traduit par un sperme dégradé (spermatozoïdes moins nombreux et moins mobiles), expliquant les observations faites dès 1949 de diminution du nombre de portées et du nombre de petits par portée chez plusieurs espèces d'animaux ayant régulièrement ingéré de faibles doses de nitrate d'uranyle[34],[35].
Effets sur le développement
- il induit une toxicité fœtale et embryonnaire chez la souris chez laquelle un implant d'uranium a été posé dans le muscle d'une patte.
- il est tératogène à doses plus élevées, avec mort de l'embryon exposé à une concentration 50 mg·kg-1·j-1 durant 9 jours, 20 % inférieure à la dose létale pour l'adulte.
- une souris gestante abreuvée avec une eau correspondant à une ingestion de 25 mg d'uranium/kg/j produit moins de jeunes. Ceux-ci ont ensuite des problèmes de développement et de survie[36].
La plupart des études et réglementations se fondent sur les effets sur l'animal, or les premières études ex vivo permises par les nouvelles techniques de cultures cellulaires laissent penser que les gonades humaines seraient plus sensibles à l'uranium que ne le sont celles des rongeurs utilisés en laboratoire. Le testicule fœtal humain pourrait aussi être plus sensible que ceux des rongeurs de labo[37].
Normes
Il n'y a pas de consensus sur les normes ni la NOEL (dose sans effet nocif observé) de l'uranium, certains estimant que les effets délétères de la radioactivité peuvent exister quelle que soit la dose.
Pour la potabilité de l'eau, l'OMS a fixé une teneur maximale de 1,4 mg·l-1[38], tout en recommandant dans ses lignes directrices une concentration en uranium cent fois plus faible, inférieure à 15 µg/l, pour les eaux de boisson courante[39].
Prix
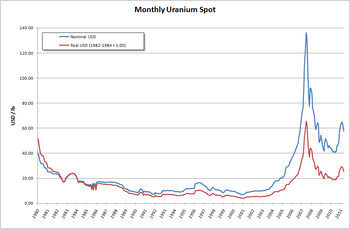 Prix « spot » mensuel de l'uranium en US$[40].
Prix « spot » mensuel de l'uranium en US$[40].
Le prix de l'uranium a baissé dans les années 1980 et 1990 pour plusieurs raisons :
- Les politiques d'économie d'énergie ont permis de limiter la consommation d'électricité,
- Des gisements d'uranium économiquement exploitable ont été découverts,
- Les stocks d'uranium militaire constitués dans le contexte de la guerre froide ont été convertis en stocks civils et utilisés dans les réacteurs nucléaires suite à l'assouplissement des tensions américano-soviétiques[41].
Le prix de l'uranium a progressivement augmenté depuis 2001 pour atteindre un pic à 135 $ en juin 2007. Ce pic s'explique par la diminution des stocks, la faible augmentation de production, et par des événements ponctuels tels que l'inondation de la mine de Cigar Lake au Canada et l'incendie de la mine Olympic Dam en Australie[42].
L'uranium est redescendu à 46,50 $ en août 2010. En janvier 2011, il se situait à environ 63 $. Il est à prévoir une tendance à la hausse en raison de l'épuisement des stocks militaires prévu vers 2015[43].
Le prix de revient du kWh est peu sensible au prix de l’uranium. Certes, le coût du cycle du combustible représente environ 20 % du prix de revient du kWh, mais ce cycle comprend toutes les transformations physiques et chimiques qu’il faut faire subir à l’uranium naturel pour en faire un combustible utilisable. En conséquence, le prix du minerai d’uranium ne dépasse guère 7 % du coût total du kWh[44]. Cependant, des études économiques montrent que le prix de l'uranium commence à avoir un effet significatif sur le coût du kWh d'électricité nucléaire à partir de 50 ou 100 € par livre de U3O8[45].
Notes et références
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, CRC Press Inc, 2009, 90e éd., Relié, 2804 p. (ISBN 978-1-420-09084-0)
- (en) Beatriz Cordero, Verónica Gómez, Ana E. Platero-Prats, Marc Revés, Jorge Echeverría, Eduard Cremades, Flavia Barragán et Santiago Alvarez, « Covalent radii revisited », dans Dalton Transactions, 2008, p. 2832 - 2838 [lien DOI]
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, CRC, 2009, 89e éd., p. 10-203
- Entrée dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais) (JavaScript nécessaire)
- « Uranium » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- (en) World Nuclear Association – décembre 2010 « Supply of Uranium. »
- (en) http://www.iaea.org/OurWork/ST/NE/NEFW/documents/RawMaterials/RTC-Ghana-2010/5.RedBook.pdf AIEA Red Book – juillet 2010] « Uranium: Resources, Production and Demand. »
- Avant la découverte de la radioactivité, Lord Kelvin avait estimé l'âge de la Terre à quelque 20 millions d'années, en supposant que la seule source d'énergie capable de s'opposer au refroidissement était la chaleur résiduelle, initialement produite lors de la formation de la Terre. Un âge de seulement quelques dizaines de millions d'années fut considéré beaucoup trop court par les géologues, et un vif débat s'ensuivit entre géologues et physiciens. Celui-ci ne devait prendre fin qu'une vingtaine d'années après la découverte de la radioactivité, trop tard pour Kelvin de faire amende honorable.
Plus tard, les physiciens ont pu apporter aux géologues des méthodes de datation absolue des roches qui se basent sur la radioactivité et les abondances actuelles de certains radioéléments et de leurs produits de désintégration (voir radiochronologie). - L'uranium est présent sur Terre essentiellement sous forme d'oxydes, donc incorporé dans les roches et très peu dans le noyau métallique. Mais la chaleur dégagée dans le manteau retarde le refroidissement du noyau.
- Depleted Uranium: Sources, Exposure and Health Effects - Full Report WHO, Geneva 2001 (WHO/SDE/PHE/01.1)
- CNDP Commission particulière du débat public Gestion des Déchets Radioactifs : Débat public sur les déchets radioactifs ; Réponses aux questions
- Etude sur l’origine du marquage par l’uranium dans la nappe alluviale de la plaine du Tricastin, IRSN, septembre 2010
- Uranium : l'abondance au rendez-vous Les défis du CEA ; Décembre-Janvier 2002 N°94 p.4-5 par Olivier Donnars.
- Lorsque nous tomberons dans le gouffre énergétique (p.46) : De l'uranium jusqu'à quand ? - Revue du Réseau Sortir du Nucléaire N°37 déc-janvier 2008.
- (en) World Uranium Mining, World Nuclear Association. Consulté le 2010-06-11
- Mentionné par comparaison dans un document portant sur l'incident du Tricastin
- (fr) Retour d’expérience des interventions de l’IRSN – Présentation de quelques cas (chaufferie, industrie métallurgique, industrie du verre, eaux minérales), par P Doremus et J.P. Pierre (IRSN) (PDF - 279.1 ko)
- (fr) Recommandation concernant l'uranium par le Groupe scientifique sur l'eau de l'Institut national de santé publique du Québec (inspq), PDF
- Erwin Erasmus Koch (trad. André Pougetoux), Uranium, Paris, André Bonne Paris, coll. « L'homme et l'univers », 1960, 225 p., p. 15
- Guide de la technique : l'énergie, Presses polytechniques et universitaires romandes, 1993.
- Données citées par la World Nuclear Association.
- « Théoriquement » la fission complète d'1 kg d'uranium libère une chaleur de 80 TJ. Mais dans un réacteur nucléaire, seulement environ 1 % (à quelques %) de l'uranium initialement présents subit réellement la fission, avant d'être remplacé.
- (en) D'après The Strategic Importance of Australia’s Uranium Resources, débat parlementaire australien.
- The Cosmic Origins of Uranium, World nuclear association.
- Uranium isotopes, Globalsecurity.
- D'après Exploration of the mechanisms that cause uranium isotope fractionation and the implications for nuclear forensics, Mr Greg Brennecka, Arizona State University, 17 April 2010.
- D'après l'Uranium, propriété et toxicité.
- Voir Health Physics - Abstract: Volume 94(2) February 2008; p.170-179
- Uranium appauvri: sources, exposition et effets sur la santé, OMS 2001
- Aide-mémoire OMS sur l'uranium appauvri]
- D'après présentation de l'ISPN, « L’uranium, propriétés et toxicité. »
- Publication N° 68 de la CIPR, citée par l'IPSN dans sa présentation.
- JL Domingo, 2001 reprod toxicol. 15, 603-9
- Arfsten DP et al. 2001, Toxicology in Health, 17 5610
- Article de la Revue Biofutur, signé S.Barillet, M.Carrière, H.Coffigny, V.Rouiller Fabre, B.Lefèvre, R.Habert, voir page 35 du Dossier spécial Toxicologie nucléaire.
- Article de la Revue Biofutur, signé S.Barillet, M.Carrière, H.Coffigny, V.Rouiller Fabre, B.Lefèvre, R.Habert, in Conclusion page 37 du Dossier spécial Toxicologie nucléaire.
- Site LENNTECH : Comparaison de normes sur l'eau potable.
- Voir le tableau des recommandations de l'OMS.
- NUEXCO Exchange Value (Monthly Uranium Spot)
- . Le prix de l'uranium a atteint un minimum en janvier 2001 à 6,40 $ par livre de U3O8Impact des cours de l'uranium sur les prix de l'électricité
- L'impact des cours de l'uranium sur les prix de l'électricité
- Production et consommation d'uranium
- Prix internationaux du pétrole, du gaz naturel, de l'uranium et du charbon, 17 février 2009
- Prix de l'uranium et coût de l'électricité nucléaire
Voir aussi
Articles connexes
- Contrôle des matières nucléaires
- Énergie nucléaire
- Tableau périodique des éléments
- Table des isotopes
- Extraction de l'uranium
- Cycle du combustible nucléaire
- Réacteur nucléaire naturel d'Oklo
Liens externes
- [PDF] Note d'information. L'uranium et les risques associés, IRSN, 24 juillet 2008
- [PDF] (en) Uranium resources and nuclear energy (Ressources d'uranium et énergie nucléaire)
- Tableau des données concernant l'uranium
- Caractéristiques de l'uranium
- (en) Toxicological Profile for Uranium, ATSDR, U.S. Department of Health and Human Services
s1 s2 g f1 f2 f3 f4 f5 f6 f7 f8 f9 f10 f11 f12 f13 f14 d1 d2 d3 d4 d5 d6 d7 d8 d9 d10 p1 p2 p3 p4 p5 p6 1 H He 2 Li Be B C N O F Ne 3 Na Mg Al Si P S Cl Ar 4 K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr 5 Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Xe 6 Cs Ba La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Rn 7 Fr Ra Ac Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr Rf Db Sg Bh Hs Mt Ds Rg Cn Uut Uuq Uup Uuh Uus Uuo 8 Uue Ubn * Ute Uqn Uqu Uqb Uqt Uqq Uqp Uqh Uqs Uqo Uqe Upn Upu Upb Upt Upq Upp Uph Ups Upo Upe Uhn Uhu Uhb Uht Uhq Uhp Uhh Uhs Uho ↓ g1 g2 g3 g4 g5 g6 g7 g8 g9 g10 g11 g12 g13 g14 g15 g16 g17 g18 * Ubu Ubb Ubt Ubq Ubp Ubh Ubs Ubo Ube Utn Utu Utb Utt Utq Utp Uth Uts Uto Métalloïdes Non-métaux Halogènes Gaz rares Métaux alcalins Métaux alcalino-terreux Métaux de transition Métaux pauvres Lanthanides Actinides Superactinides Éléments non classés Catégories :- Produit chimique très toxique
- Produit chimique dangereux pour l'environnement
- Élément chimique
- Actinide
- Matériau nucléaire
- Uranium
Wikimedia Foundation. 2010.








