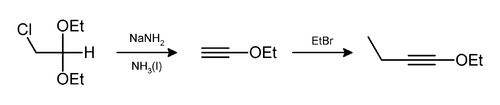- 7782-92-5
-
Amidure de sodium
Amidure de sodium 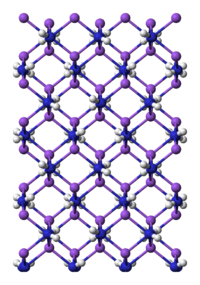
Amidure de sodium : en bleu, les atomes d'azote, en violet, les sodium et en blanc, les hydrogène Général Nom IUPAC sodium amide No CAS No EINECS PubChem Apparence poudre grisâtre, incolore quand elle est pure Propriétés chimiques Formule brute H2NNa Masse molaire 39,0123 g∙mol-1
H 5,17 %, N 35,9 %, Na 58,93 %,pKa 38 [1] Propriétés physiques T° fusion 210 °C T° ébullition 400 °C Solubilité soluble dans l'ammoniac, réagit avec l'eau Masse volumique 1,39 g∙cm-3 T° d’auto-inflammation 450 °C Point d’éclair 4,44 °C Cristallographie Structure type orthogonal Précautions Directive 67/548/EEC 
C
FNFPA 704 Unités du SI & CNTP, sauf indication contraire. L'amidure de sodium est le composé chimique de formule semi-développée NaNH2. Ce composé qui réagit violemment avec l'eau, est blanc quand il est pur mais dans le commerce, il est typiquement gris ce qui est dû à la présence d'une petite quantité de fer métallique issue du processus de préparation. De telles impuretés n'affectent généralement pas la réactivité de l'amidure de sodium. NaNH2 est très largement employé en synthèse organique comme base forte.
Sommaire
Préparation et structure
L'amidure de sodium peut être préparé par la réaction du sodium sur l'ammoniac gazeux (NH3)[2] mais généralement la réaction dans ammoniac liquide en utilisant du nitrate de fer III comme catalyseur est préférée. En effet, cette réaction est plus rapide au point d'ébullition de l'ammoniac, i.e. -33 °C[3] :
- 2 Na + 2 NH3 → 2 NaNH2 + H2
NaNH2 est un composé plutôt ionique et comme tel cristallise en un polymère tridimensionnel et infini[4]. La géométrie autour des atomes de sodium est tétraédrique[5]. Dans l'ammoniac, l'amide de sodium forme des solutions conductrices, ce qui s'explique par la présence des ions Na(NH3)6+ et des anions NH2-.
Emplois
L'amidure de sodium est utilisé dans les productions industrielles d'indigo, d'hydrazine et de cyanure de sodium[6]. C'est un réactif de choix pour l'assèchement de l'ammoniac (liquide ou gazeux) mais son emploi principal est celui d'une base forte en chimie organique, souvent en solution dans l'ammoniac liquide. L'un des principaux avantages de l'utilisation de l'amidure de sodium est qu'il est une excellente base et un mauvais nucléophile. Cependant, du fait de sa faible solubilité, il est souvent remplacé par des réactifs comme l'hydrure de sodium, le bis(triméthylsilyl)amidure de sodium (NaHMDS) ou le diisopropylamidure de lithium (LDA).
Synthèse des alcynes
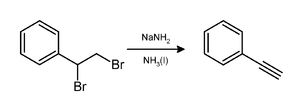
L'amidure de sodium induit la perte de deux molécules de bromure d'hydrogène (HBr) sur les dibromoalcanes vicinaux pour donner une triple liaison carbone-carbone, comme dans la synthèse du phényléthyne[7]:
Normalement deux équivalents d'amidure de sodium produisent l'alcyne désiré. Cependant, trois équivalents sont nécessaires pour la préparation d'un alcyne terminal parce que dans ce type d'alcyne, l'atome d'hydrogène terminal est acide et est immédiatement déprotoné par un équivalent de la base.
Du chlorure d'hydrogène (HCl) et/ou de l'éthanol (C2H5OH) peuvent aussi être éliminés de la même façon[8] comme dans la préparation du 1-éthoxy-but-1-yne[9]:
Réactions de cyclisation
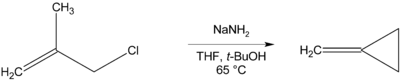
S'il n'y a pas d'atome d'hydrogène en β pouvant être éliminé, des composés cycliques peuvent être formés, comme dans la préparation du méthylènecyclopropane[10]:
Des cyclopropènes[11], des aziridines[12] et des cyclobutanes[13] peuvent être formés de cette manière.
déprotonation de carbone et d'azote acides
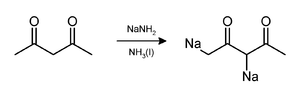
Les atomes de carbone acides qui peuvent être déprotonés par l'amidure de sodium dans l'ammoniac liquide sont, entre autres, les alcynes terminaux[14], les méthyl cétones[15], les cyclohexanones[16], l'acide phénylacétique et ses dérivés[17] et les diphénylméthanes[18]. L'acétylacétone perd deux protons et forme un dianion[19]:
L'amidure de sodium déprotone aussi les indoles[20] et les pipéridines[21]
Autres réactions
- Réarrangement avec ortho-déprotonation[22].
- Synthèse d'oxiranes (via carbène?)[23]
- synthèse d'indoles[24]
- Réaction de Chichibabin
Sécurité
L'amidure de sodium réagit violemment avec l'eau pour produire de l'ammoniac et de l'hydroxyde de sodium et brûle dans l'air en donnant des oxydes de sodium et d'azote:
Dans le cas d'une quantité limitée d'air et d'humidité, comme par exemple dans un conteneur mal fermé, un mélange explosif de produits d'oxydation, caractérisé par un jaunissement ou un brunissement du solide, peut se former. Ainsi l'amidure de sodium doit toujours être conservé dans des conteneurs scrupuleusement fermés et si possible, sous azote. Les parts d'amidure de sodium qui sont de couleur jaune à marron doivent être détruits immédiatement. Une méthode de destruction est d'additionner précautionneusement de l'éthanol à une suspension de cet amidure de sodium dans un solvant hydrocarbure.
L'amidure de sodium est soupçonnée d'être corrosif sur la peau, les yeux et les muqueuses. Des précautions doivent être prises pour empêcher la dispersion de poussière d'amidure de sodium.
Notes
- (en) Cet article est partiellement ou en totalité issu d’une traduction de l’article de Wikipédia en anglais intitulé « Sodium amide ».
- ↑ Buncel, Menon; J. Organomet. Chem., 1977, 141, 1
- ↑ Sodium amide, Bergstrom, F. W.; Org. Synth., 1955, vol. 3, p. 778.
- ↑ Sodium Amide, Greenlee, K. W.; Henne, A. L.; Inorganic Syntheses, 1946, vol. 2, pp. 128-35.
- ↑ The Crystal Structure of Sodium Amide, Zalkin, A.; Templeton, D. H.; Journal of Physical Chemistry, 1956, vol. 60, pp 82 -823. DOI:10.1021/j150540a042.
- ↑ Structural Inorganic Chemistry, Wells, A.F.; 1984, Oxford: Clarendon Press. (ISBN 0-19-855370-6).
- ↑ Merck Index (12th Edn.)
- ↑ Phenylacetylene, Campbell, Kenneth N.; Campbell, Barbara K.; Org. Synth., 1950, vol. 4, p. 72.
- ↑ Ethoxyacetylene, Jones, E. R. H.; Eglinton, Geoffrey; Whiting, M. C.; Shaw, B. L.; Org. Synth., 1954, vol. 4, p.404.
Dialkoxyacetylenes: di-tert-butoxyethyne, a valuable synthetic intermediate, Bou, Anna; Pericàs, Miquel A.; Riera, Antoni; Serratosa, Fèlix; Org. Synth., 1987, vol.8, p. 161.
Phenylthioacetylene, Magriotis, Plato A.; Brown, John T.; Org. Synth., 1995, vol. 9, p. 656.
2-Butyn-1-ol, Ashworth, P. J.; Mansfield, G. H.; Whiting, M. C.; Org.Synth., 1955, Vol. 4, p. 128. - ↑ 1-Ethoxy-1-butyne, Newman, Melvin S.; Stalick, W. M., Org. Synth., 1977, vol. 6, p. 564.
- ↑ Cyclobutanone from methylenecyclopropane via oxaspiropentane, Salaun, J. R.; Champion, J.; Conia, J. M., Org. Synth., 1977, vol. 6, p. 320.
- ↑ Synthesis and (3+2)-cycloaddition of a 2,2-dialkoxy-1-methylenecyclopropane: 6,6-dimethyl-1-methylene-4,8-dioxaspiro(2.5)octane and cis-5-(5,5-dimethyl-1,3-dioxan-2-ylidene)hexahydro-1(2H)-pentalen-2-one, Nakamura, Masuharu; Wang, Xio Qun; Isaka, Masahiko; Yamago, Shigeru; Nakamura, Eiichi ; Org. Synth., 2003, vol. 80, p. 144.
- ↑ N-Ethylallenimine, Bottini, Albert T.; Olsen, Robert E.; Org. synth., 1964, vol. 5, p. 541.
- ↑ 1-Cyanobenzocyclobutene, Skorcz, J. A.; Kaminski, F. E.; Org. synth., 1968, vol. 5, p. 263.
- ↑ 1-Ethynylcyclohexanol, Saunders, J. H.; Org. Synth., 1949, vol. 3, p. 416.
(Z)-4-Chloro-4-hexenyl trifluoroacetate, Peterson, P. E.; Dunham, M.; Org. Synth., 1977, vol. 6, p. 273.
Tetrolic acid, Kauer, J. C.; Brown, M.; Org. synth., 1962, vol. 5, p. 1043. - ↑ Dimethylethynylcarbinol, Coffman, Donald D.; Org. synth., 1940, vol. 3, p. 320.
Diisovalerylmethane, Hauser, C. R.; Adams, J. T.; Levine, R.; Org. Synth., 1948, vol. 3, p. 291. - ↑ 2-Allylcyclohexanone, Vanderwerf, Calvin A.; Lemmerman, Leo V.; Org. Synth., 1948, vol. 3, p. 44.
- ↑ α,β-Diphenylpropionic acid, Hauser, Charles R.; Dunnavant, W. R.; Org. Synth., 1960, vol.5, p. 526.
Ethyl 2,4-diphenylbutanoate, Kaiser, Edwin M.; Kenyon, William G.; Hauser, Charles R.; Org. Synth., 1967, vol. 5, p. 559.
α,β-Diphenylcinnamonitrile, Wawzonek, Stanley; Smolin, Edwin M.; Org. Synth., 1957, vol. 4, p. 387. - ↑ 1,1-Diphenylpentane, Murphy, William S.; Hamrick, Phillip J.; Hauser, Charles R.; Org. Synth., 1968, vo. 5, p. 523.
- ↑ Phenylation of diphenyliodonium chloride: 1-phenyl-2,4-pentanedione, Hampton, K. Gerald; Harris, Thomas M.; Hauser, Charles R.; Org. Synth., 1971, vol. 6, p. 928.
- ↑ 1-Methylindole, Potts, K. T.; Saxton, J. E; Org. Synth., 1960, vol. 5, p. 769.
- ↑ N-β-Naphthylpiperidine, Bunnett, J. F.; Brotherton, T. K.; Williamson, S. M.; Org. Synth., 1960, vol. 5, p. 816.
- ↑ 2-Methylbenzyldimethylamine, Brazen, W. R.; Hauser, C. R.; Org. Synth., 1954, vol. 4, p. 585.
- ↑ Phenylmethylglycidic ester, Allen, C. F. H.; VanAllen, J.; Org. Synth., 1944, vol. 3, p. 727.
- ↑ 2-Methylindole, Allen, C. F. H.; VanAllen, James; Org. Synth., 1942, vol. 3, p. 597.
- Portail de la chimie
Catégories : Composé du sodium | Produit chimique corrosif | Produit chimique facilement inflammable | Produit chimique qui réagit avec l'eau | Amidure | Base | Réactif pour la chimie organique
Wikimedia Foundation. 2010.