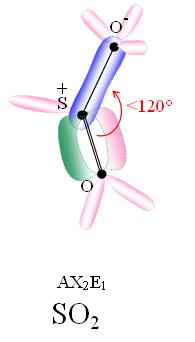
- Gaz sulfureux
-
Dioxyde de soufre
Dioxyde de soufre En bleu les domaines de gravitation des électrons liants (liaisons σ).
En rose les domaines de gravitation des doublets non liants ou hybridations.
En vert les domaines de gravitaion des électrons liants (liaison πy).Général Synonymes Oxyde sulfureux
Anhydride sulfureux
Oxyde de soufreNo CAS No EINECS No E E220 FEMA SMILES InChI Apparence gaz incolore ou gaz comprimé liquefié, d'odeur âcre.[1] Propriétés chimiques Formule brute SO2 Masse molaire 64,064 g∙mol-1
O 49,95 %, S 50,05 %,Propriétés physiques T° fusion -75,5 °C[1] T° ébullition -10 °C[1] Solubilité dans l'eau à 25 °C : 8.5 ml/100 ml[1] Masse volumique 1.354 g/cm³ à -30 °C
1.434 g/cm³ à 0 °C
1.25 g/mL à 25 °C
2.26 à 21 °C par rapport à l'airT° d’auto-inflammation ininflammable Point d’éclair ininflammable Limites d’explosivité dans l’air non-explosif Pression de vapeur saturante -10 °C : 1.013 bar
20 °C : 3.3 bar
40 °C : 4.4 barThermochimie S0gaz, 1 bar 248,21 J/mol·K ΔfH0gaz -296,84 kJ/mol Précautions Directive 67/548/EEC 
TPhrases R : 23, 34, Phrases S : 1/2, 9, 26, 36/37/39, 45, [2] Transport 268 1079 NFPA 704 SIMDUT[4] 

SGH[5] 


DangerClassification du CIRC Groupe 3 : Inclassable quant à sa cancérogénicité pour l'Homme[3] Inhalation Très toxique, mort, produit de l'acide sulfureux dans les poumons. Peau Dangereux, corrosif, formation d'acide au contact de surfaces humides. Yeux Dangereux, corrosif, formation d'acide au contact de surfaces humides. Ingestion Toxicité relativement faible, effets à long terme inconnus. Écotoxicologie CL50 3000 ppm/30 minutes souris, inhalation Unités du SI & CNTP, sauf indication contraire. Le dioxyde de soufre (ou anhydride sulfureux) est un composé chimique constitué de deux atomes d'oxygène et d'un atome de soufre ; sa formule brute est : SO2. Le SO2 est un gaz dense, incolore et toxique ; son inhalation est fortemment irritante.
Le dioxyde de soufre est utilisé comme désinfectant, antiseptique et antibactérien ainsi que comme gaz réfrigérant, agent de blanchiment et comme conservateur de produits alimentaires, notamment pour les fruits secs, dans la production de boissons alcoolisées et plus spécialement dans la fabrication du vin.
Sommaire
Production
- Combustion du soufre
- S8 + 8 O2 → 8 SO2
- Combustion de sulfure d'hydrogène ou de composés organosulfurés
- 2 H2S(g) + 3 O2(g) → 2 H2O(g) + 2 SO2(g)
- Grillage des minéraux sulfurés comme la pyrite, la sphalérite ou le cinabre
- 4 FeS2(s) + 11 O2(g) → 2 Fe2O3(s) + 8 SO2(g)
- 2 ZnS(s) + 3 O2(g) → 2 ZnO(s) + 2 SO2(g)
- HgS(s) + O2(g) → Hg(g) + SO2(g)
- Produit résiduel de la fabrication du ciment : CaSiO3 et CaSO4 sont chauffés avec du coke et du sable
- 2 CaSO4(s) + 2SiO2(s) + C(s) → 2 CaSiO3(s) + 2 SO2(g) + CO2(g)
- Acide sulfurique chaud sur de la limaille de cuivre
- Cu(s) + 2H2SO4(aq) → CuSO4(aq) + SO2(g) + 2H2O(l)
Le dioxyde de soufre en œnologie
Article détaillé : Dioxyde de soufre en œnologie.Dans le vin, le dioxyde de soufre est présent sous forme libre hydratée : H2SO3 ou acide sulfureux, ou sous forme combinée avec les aldéhydes (éthanal), les cétones (acide alpha-cétoglutarique) et certains sucres. Le dioxyde de soufre est également utilisé pour la vinification car il inhibe ou arrête le développement des levures et bactéries, arrêtant ainsi la fermentation au moment voulu et assure une stérilisation du vin. En fait lors de la vinification, l'introduction de dioxyde de soufre permet de sélectionner les levures car celles nécessaires à la vinification sont plus résistantes au dioxyde de soufre que les autres levures présentes. Le corps formé par combinaison entre l’anhydride sulfureux et l’éthanal est l’acide aldéhyde-sulfureux ou acide éthanolsulfonique, qui est un acide fort, selon la réaction suivante :
- CH3CHO + NaH SO3 → CH3CHOH-O-SO2Na
Il n’est pas possible de conserver à coup sûr un vin, c’est-à-dire d’éviter les refermentations, les maladies microbiennes ou la madérisation, sans un contrôle répété de sa teneur en anhydride sulfureux libre, qui est à l’état de gaz sulfureux SO2, et dont l’odeur et le goût sont désagréables.
Le dioxyde de soufre dans l'industrie
Dans l'industrie, le dioxyde de soufre sert surtout pour la production d'acide sulfurique. L'acide sulfurique possède d'innombrables applications et est le produit chimique le plus utilisé. Le dioxyde de soufre est obtenu par combustion de soufre ou de pyrites, puis transformé en trioxyde de soufre (SO3) très pur par oxydation avec de l'air, catalysée par le platine ou du pentoxyde de vanadium. Le SO3 ainsi obtenu permet la fabrication directe d'acide sulfurique très concentré par simple hydratation.
La pollution atmosphérique en dioxyde de soufre issue de l'industrie provient principalement de la consommation de combustibles fossiles. En effet, du soufre est naturellement contenu dans ces combustibles, et leur combustion génère du SO2. Il peut aussi provenir de l'industrie métallurgique, des procédés de fabrication d'acide sulfurique, de la conversion de la pulpe de bois en papier, de l'incinération des ordures et de la production de soufre élémentaire.
La combustion du charbon est la source synthétique la plus importante et représente environ 50 % des émissions globales annuelles. Celle du pétrole représente encore 25 à 30 %.
Les rejets industriels de dioxyde de soufre peuvent être réduits grâce à la mise en place de procédés de désulfuration.
Le dioxyde de soufre dans l'environnement
Le SO2 est produit par les volcans et divers procédés industriels.
La houille de mauvaise qualité et le pétrole contiennent des composés de soufre et génèrent du dioxyde de soufre lors de leur combustion.Le dioxyde de soufre peut jouer un rôle refroidissant pour la planète, car il sert de noyau de nucléation à des aérosols dont l'albédo est assez élevé, c’est-à-dire réfléchissant les rayons du soleil sans les absorber. Pour certains scientifiques, une solution pour enrayer le réchauffement climatique global serait de "climatiser" la planète avec du dioxyde de soufre. Mais cela pourrait aussi avoir des conséquences dramatiques, car lorsqu'il se combine avec l'eau et l'oxygène atmosphérique, le dioxyde de soufre et avec le dioxyde d'azote est l'une des principales causes des pluies acides, perturbant, voire détruisant des écosystèmes fragiles. De plus, le SO2 entraine l'acidification des océans, ce qui met ainsi l'existence des planctons, animaux à coquille calcaires et récifs coralliens en péril. Les planctons produisent la moitié de l'oxygène terrestre, en tuant ces producteurs d'oxygène, on réduit considérablement la quantité d'oxygène sur Terre, un fait alarmant. La Chine est devenue le premier émetteur de dioxyde de soufre dans le monde[6].
Voir aussi
Articles connexes
Liens externes
- Institut français de l'environnement
- Atmosphere, Climate & Environment Information Programme du gouvernement du Royaume-Uni
Notes et références
- ↑ a , b , c et d DIOXYDE DE SOUFRE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- ↑ « dioxyde de soufre » sur ESIS, consulté le 13 février 2009
- ↑ IARC Working Group on the Evaluation of Carcinogenic Risks to Humans, « Evaluations Globales de la Cancérogénicité pour l'Homme, Groupe 3 : Inclassables quant à leur cancérogénicité pour l'Homme » sur http://monographs.iarc.fr, 16 janvier 2009, CIRC. Consulté le 22 août 2009
- ↑ « Dioxyde de soufre » dans la base de données de produits chimiques Reptox de la CSST (organisme canadien responsable de la sécurité et de la santé au travail), consulté le 23 avril 2009
- ↑ Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- ↑ Michel Temman, « Victime de ses rejets, Tokyo aide Pékin à se mettre au vert », dans Libération du 16/04/2007, [lire en ligne]
- Portail de la chimie
- Portail de l’écologie
Catégories : Produit chimique toxique | Produit chimique corrosif | Composé du soufre | Agent conservateur | Oxyde | Réfrigérant
Wikimedia Foundation. 2010.