- Acide formique
-
Acide méthanoïque
Acide méthanoïque 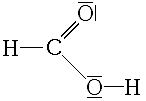
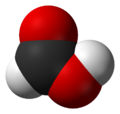
formules semi-développée et 3D de l'acide méthanoïque Général Nom IUPAC Acide méthanoïque Synonymes Acide formique
Acide hydroxycarboxyliqueNo CAS No EINECS PubChem No E E236 FEMA SMILES InChI Apparence liquide incolore, fumant, d'odeur âcre.[1] Propriétés chimiques Formule brute CH2O2 [Isomères] Masse molaire 46,0254 g∙mol-1
C 26,1 %, H 4,38 %, O 69,52 %,pKa 3.751 (25 °C) [2] Propriétés physiques T° fusion 8,3 °C [2] T° ébullition 101 °C [2] Solubilité 1000 g/L (eau, 25 °C)[2],
miscible avec l'éthanol,
l'acétone et l'étherMasse volumique 1.22 à 25 °C T° d’auto-inflammation 520 °C[1] Point d’éclair 69 °C[1] Limites d’explosivité dans l’air en volume % dans l'air : 14-34[1] Pression de vapeur saturante 42,6 mmHg (25 °C) [2] Viscosité dynamique 1,57.10-3 Pa.s à 26 °C Point triple 281,45 K (8,3 °C)
23,6 mbarThermochimie S0gaz, 1 bar 248,7 J⋅mol-1⋅K-1 S0liquide, 1 bar 131,8 J⋅mol-1⋅K-1 ΔfH0gaz -378,6 kJ⋅mol-1 ΔfH0liquide -425,1 kJ⋅mol-1 Cp 45,7 J⋅mol-1⋅K-1 (vapeur)
99,0 J⋅mol-1⋅K-1 (liquide)Précautions Directive 67/548/EEC 
CPhrases R : 35, Phrases S : (1/2), 23, 26, 45, Transport - 1779 NFPA 704 SIMDUT[3] 
SGH[4] 
DangerInhalation Les vapeurs concentrées sont corrosives Ingestion Toxique, peut provoquer des réactions allergiques. Agent mutagène suspecté Écotoxicologie DL50 700mg/kg (souris, oral)
145mg/kg (souris, i.v.)
940mg/kg (souris, i.p.) [2]LogP -0.54[1] Unités du SI & CNTP, sauf indication contraire. L'acide méthanoïque (appelé aussi acide formique) est le plus simple des acides carboxyliques. Sa formule chimique est CH2O2 ou HCOOH. Sa base conjuguée est l'ion méthanoate (formiate) de formule HCOO-. Il s'agit d'un acide faible qui se présente sous forme de liquide incolore à odeur pénétrante.
Dans la nature on le trouve dans le dard et les piqûres de plusieurs insectes de l'ordre des hyménoptères, comme les abeilles et les fourmis, mais aussi sur les poils qui composent les feuilles de certaines plantes de la famille des urticacées (orties). Son nom vient du mot latin formica qui signifie fourmis, car sa première isolation a été réalisée par distillation de corps de fourmis.
Sommaire
Histoire
Dès le XVe siècle, quelques alchimistes et naturalistes avaient connaissance que certaines fourmis produisaient une vapeur acide. La première personne à avoir décrit l'isolation de cette substance (par distillation d'un grand nombre de cadavres de fourmis) est le naturaliste anglais John Ray en 1671. Sa première synthèse fut faite par le chimiste français Gay-Lussac à partir de l'acide hydrocyanique. En 1855, un autre chimiste français Marcellin Berthelot, développa une méthode de synthèse à partir du monoxyde de carbone, similaire à celle utilisée de nos jours
Chimie
Propriétés réductrices
Chauffé avec de l'acide sulfurique, l'acide formique se décompose en eau et en monoxyde de carbone, si bien qu'il possède des propriétés réductrices très marquées (réduction des sels d'or, d'argent, de cuivre, etc.). Sous l'action de la seule chaleur, il se décompose vers 160 °C en dihydrogène et en dioxyde de carbone, d'où de nouveau, des propriétés réductrices.
Acide faible
Bien qu'il soit plus ionisé que ses homologues supérieurs d'acides carboxyliques, c'est un acide faible, mais malgré cela il est capable de déplacer l'acide nitrique de ses sels. Si l'on ajoute de l'acide formique à un mélange de nitrate de potassium et de brucine, le mélange est instantanément porté au rouge. Il ne donne ni halogénure d'acyle ni anhydride d'acide.
Fabrication
En chauffant en tube scellé de la potasse et de monoxyde de carbone, Berthelot a fait la synthèse de l'acide formique : CO + KOH → H-CO2K. La suite du procédé actuellement utilisé dans l'industrie (sous pression de 7 atm. et à 170 °C) est l'hydrolyse du formiate de potassium H-CO2K par l'acide sulfurique ; le produit obtenu par distillation sous pression réduite contient 80 à 85 % d'acide formique.
Utilisations
L'acide méthanoïque est utilisé dans les industries suivantes : textile (teintures, traitement du cuir), insecticides, laques, solvants, tannage, électroplaquage, fumigènes. Il sert également à argenter les miroirs.
Stockage de l'hydrogène
Une recherche de l’Institut Leibniz de catalyse de Rostock a montré qu'il peut être utilisé pour le stockage de dihydrogène pour alimenter en combustible une pile à combustible (PAC)[5].
En 2006, une équipe de recherche de l’EPFL (Suisse) a présenté l'utilisation de l'acide formique comme solution de stockage de l’hydrogène[6]. Un système catalytique homogène, basé sur une solution aqueuse de catalyseurs au ruthénium décompose l'acide formique (HCOOH) en dihydrogène H2 et dioxyde de carbone (CO2)[7]. Le dihydrogène peut être ainsi produit dans une large plage de pression (1 – 600 bars) et la réaction ne génère pas de monoxyde de carbone. Ce système catalytique résout les problèmes des catalyseurs existants pour la décomposition de l'acide formique (faible stabilité, durée de vie des catalyseurs limitée, formation de monoxyde de carbone) et viabilise cette méthode de stockage d'hydrogène[8]. Le coproduit de cette décomposition, le dioxyde de carbone, peut être utilisé dans un deuxième temps pour générer à nouveau de l’acide formique par hydrogénation. L'hydrogénation catalytique du CO2 a été longuement étudiée et des méthodes efficaces ont été développées[9],[10]. L'acide formique contient 53 g/L d'hydrogène à température et pression ambiante, ce qui est deux fois la capacité de l’hydrogène compressé à 350 bars. Pur, l'acide formique est un liquide inflammable à + 69 °C, ce qui est supérieur à l’essence (-40 °C) ou l'éthanol (+13 °C). Dilué dès 85%, il n'est plus inflammable. L'acide formique dilué est même inscrit sur la liste des additifs alimentaires de l'administration américaine des denrées alimentaires et des médicaments (FDA)[11].
Notes et références
- ↑ a , b , c , d et e ACIDE FORMIQUE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- ↑ a , b , c , d , e et f (en) « Formic acid » sur ChemIDplus, consulté le 8 février 2009
- ↑ « Acide formique » dans la base de données de produits chimiques Reptox de la CSST (organisme canadien responsable de la sécurité et de la santé au travail), consulté le 24 avril 2009
- ↑ Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- ↑ http://www.bulletins-electroniques.com/actualites/54627.htm
- ↑ Gábor Laurenczy, Céline Fellay, Paul J. Dyson, Hydrogen production from formic acid. PCT Int. Appl. (2008), 36pp. CODEN: PIXXD2 WO 2008047312 A1 20080424 AN 2008:502691
- ↑ Céline Fellay, Paul J. Dyson, Gábor Laurenczy, A Viable Hydrogen-Storage System Based On Selective Formic Acid Decomposition with a Ruthenium Catalyst, Angew. Chem. Int. Ed., 2008, 47, 3966–3970.
- ↑ Ferenc Joó, Breakthroughs in Hydrogen Storage – Formic Acid as a Sustainable Storage Material for Hydrogen, ChemSusChem 2008, 1, 805–808.
- ↑ P. G. Jessop, in Handbook of Homogeneous Hydrogenation (Eds.: J. G. de Vries, C. J. Elsevier), Wiley-VCH, Weinheim, Germany, 2007, pp. 489–511.
- ↑ P. G. Jessop, F. Joó, C.-C. Tai, Recent advances in the homogeneous hydrogenation of carbon dioxide, Coord. Chem. Rev., 2004, 248, 2425–2442.
- ↑ US Code of Federal Regulations: 21 CFR 186.1316, 21 CFR 172.515
- Portail de la chimie
Catégories : Produit chimique corrosif | Acide carboxylique | Biochimie de l'insecte
Wikimedia Foundation. 2010.

