- Dichlore
-
Dichlore 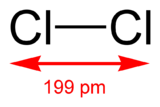
Général Nom IUPAC Dichlore No CAS No EINECS No E E925 Apparence gaz jaune-verdatre, d'odeur acre[1]. Propriétés chimiques Formule brute Cl2 [Isomères] Masse molaire[2] 70,906 ± 0,004 g·mol-1
Cl 100 %,Propriétés physiques T° fusion -101 °C[1] T° ébullition -34,6 °C[1] Solubilité 14,6 g·l-1 dans l'eau à 0 °C,
7,3 g·l-1 à 20 °C,
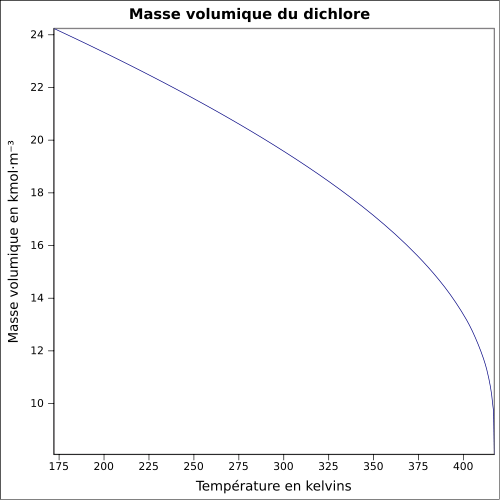
5,7 g·l-1 à 30 °CMasse volumique 2,48 (par rapport à l'air)
à 20 °C 6.864atm : 1.4085(liq)
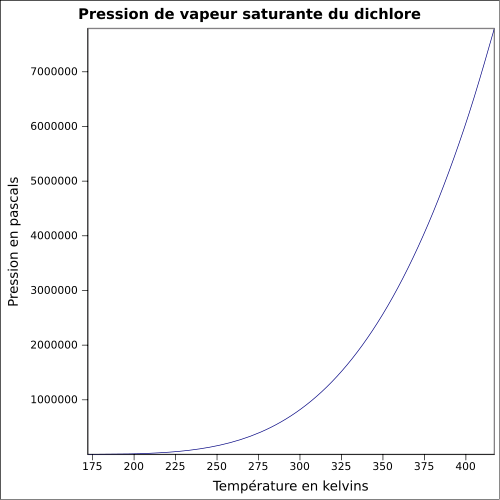
à -35 °C 0.9949atm : 1.5649(liq)Pression de vapeur saturante 6,776 bar à 20 °C
8,8 bar à 30 °C
14,3 bar à 50 °CPoint critique 143,81 °C
79,914 bar
0,57688 kg·l-1Point triple -100,98 °C
0,01387 barVitesse du son 206 m·s-1 (0 °C,1 atm) [4] Thermochimie ΔvapH° 20,41 kJ·mol-1 (1 atm, -34,04 °C);
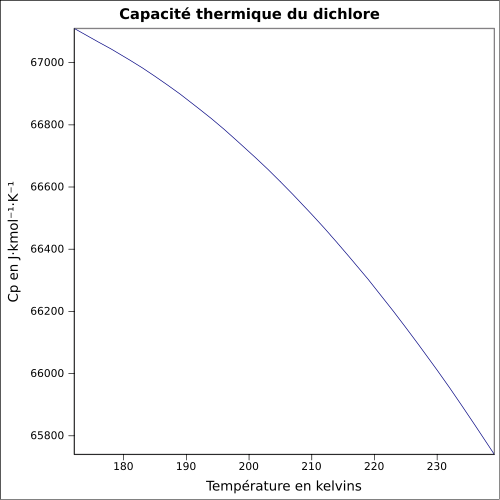
17,65 kJ·mol-1 (1 atm, 25 °C)[5]Cp Propriétés électroniques 1re énergie d'ionisation 11,480 ± 0,005 eV (gaz)[6] Cristallographie symbole de Pearson  [7]
[7]Classe cristalline ou groupe d’espace Cmca (n°64) [7] Strukturbericht A14[7] Structure type I2 [7] Précautions Directive 67/548/EEC 
T
NPhrases R : 23, 36/37/38, 50, Phrases S : (1/2), 9, 45, 61, Transport 268 1017 NFPA 704 SIMDUT[8] 

SGH[9] 



DangerInhalation odeur suffocante Écotoxicologie CL50 1 heure :
rats 293 ppm
souris 137 ppmSeuil de l’odorat bas : 0,02 ppm
haut : 3,4 ppm[10]Unités du SI & CNTP, sauf indication contraire. Le dichlore (Cl2) est un gaz jaune-vert dans les conditions normales de pression et de température (chloros signifie « vert » en grec). Il est 2,5 fois plus dense que l'air. Il a une odeur suffoquante très désagréable et est extrêmement toxique.
Le dichlore a été découvert par Carl Wilhelm Scheele en 1774. Il a été utilisé lors de la Première Guerre mondiale en tant que gaz de combat, la bertholite.
Le dichlore est soluble dans l'eau formant l'eau de chlore, mais il n'est pas soluble dans l'eau salée.
La molécule de dichlore (Cl2) est formée de deux atomes de chlore.
Sommaire
Production
Le dichlore peut être produit facilement en électrolysant une solution de chlorure de sodium.
- 2Na+ + 2Cl- + 2H2O → 2NaOH + Cl2 + H2
Scheele le synthétisa en faisant réagir du dioxyde de manganèse avec de l'acide chlorhydrique.
On peut également en fabriquer de petites quantités grâce à la réaction de l'acide chlorhydrique sur le permanganate de potassium.
Utilisation
Le dichlore est utilisé comme matière première pour produire de l'acide chlorhydrique (HCl) par réaction entre le dichlore et le dihydrogène.
- Cl2 + H2 → 2HCl
Il est aussi utilisé pour produire du polychlorure de vinyle (PVC).
Il sert dans la fabrication des produits avec une liaison carbone chlore comme le fluide frigorigènes R12 dichlorodifluorométhane.[réf. nécessaire]
Propriétés
Le dichlore a la propriété de décolorer la solution d'indigo[11] et plusieurs autres substances organiques. La couleur de plusieurs colorants organiques vient des différences entre les nombreux niveaux d’énergie de leurs liaisons conjuguées. Or le dichlore oxyde les doubles liaisons carbone-carbone qui constituent les systèmes de liaisons conjuguées.
Voir aussi
Références
- CHLORE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- (en) Robert H. Perry et Donald W. Green, Perry's Chemical Engineers' Handbook, USA, McGraw-Hill, 1997, 7e éd., 2400 p. (ISBN 0-07-049841-5), p. 2-50
- (en) W. M Haynes, Handbook of chemistry and physics, CRC, 2010-2011, 91e éd., 2610 p. (ISBN 9781439820773), p. 14-40
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, CRC Press Inc, 2009, 90e éd., Relié, 2804 p. (ISBN 978-1-4200-9084-0)
- (en) David R. Lide, Handbook of chemistry and physics, CRC, 2008, 89e éd., 2736 p. (ISBN 978-1-4200-6679-1), p. 10-205
- The Molecular Iodine (I2) Crystal Structure (A14) sur http://cst-www.nrl.navy.mil/. Consulté le 17 décembre 2009
- « Chlore » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- Chlorine sur hazmap.nlm.nih.gov. Consulté le 14 novembre 2009
- Chimie, terminale S obligatoire, programme 2002, Nathan, coll. « Sirius », 2008, 351 p. (ISBN 978-2-09-172496-6), p. 248
Catégories :- Produit chimique toxique
- Produit chimique dangereux pour l'environnement
- Produit chimique corrosif
- Produit chimique comburant
- Gaz inorganique
- Composé du chlore
- Gaz toxique
Wikimedia Foundation. 2010.