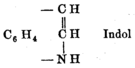- 120-72-9
-
Indole
Indole 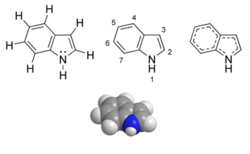
Structure Général Synonymes 2,3-benzopyrrole
ketole
1-benzazoleNo CAS No EINECS SMILES InChI Apparence solide blanc Propriétés chimiques Formule brute C8H7N [Isomères] Masse molaire 117,1479 g∙mol-1
C 82,02 %, H 6,02 %, N 11,96 %,pKa 16,2 pKb 17,6 Propriétés physiques T° fusion 52,5 °C [1] T° ébullition 254 °C [1] Solubilité 3,56 g/L (eau, 25 °C) [1] Masse volumique 1,22 g/cm³ (solide)
5,6 (gaz, air=1)Point d’éclair 110 °C Pression de vapeur saturante 1,6 Pa à 25 °C Précautions Yeux Irritant Unités du SI & CNTP, sauf indication contraire. L'indole est un composé organique aromatique hétérocyclique. Le nom indole est dérivé de l'indigo, un pigment bleu dont la molécule contient deux groupements indoles soudés. Il peut être décrit schématiquement comme étant formé d'un cycle benzénique et d'un cycle pyrrole accolés. Le doublet électronique porté par l'atome d'azote dans la représentation de Lewis participe à la délocalisation aromatique. Contrairement aux amines classiques, l'indole n'est donc pas une base puisque le caractère aromatique est perdu en cas de réaction chimique mettant en jeu ce doublet.
L'indole est un composé solide à la température ambiante, qui possède une odeur intense de matière fécale. En revanche à faibles concentrations, il possède une odeur fleurie, et est un constituant d'un grand nombre de parfums.
L'indole est naturellement présent dans le goudron de houille. La structure indole est présente dans de nombreux composés organiques comme le tryptophane (un acide aminé) ainsi que dans les protéines contenant du tryptophane, dans des alcaloïdes et des pigments.
L'indole peut subir une substitution électrophile aromatique, principalement en position 3. Les composés de type indole substitué constituent les blocs de base des alcaloïdes de type tryptamine comme la sérotonine (un neurotransmetteur), la mélatonine, la psilocybine (une substance hallucinogène), la diméthyltryptamine, le 5-MeO-DMT ou encore le LSD. Parmi les autres composés dérivés de l'indole, on peut citer l'auxine (une hormone des plantes), l'indométacine (un anti-inflammatoire) ou le pindolol (un bêta-bloquant)
Sommaire
- 1 Historique
- 2 Synthèse et production de l'indole
- 3 Utilisation de l'Indole
- 4 Réactions chimiques mettant en jeu l'Indole
- 5 Sécurité
- 6 Références générales
- 7 Voir aussi
Historique
La chimie de l'indole a commencé à se développer avec l'étude de l'indigo, pigment de couleur bleue. Celui-ci était transformé en isatine puis en oxindole (oxyde d'indole). En 1866, Adolf von Baeyer (prix Nobel de chimie en 1917), parvint à réduire l'oxindole en indole en utilisant de la poussière de zinc comme réducteur. Il proposa une formule chimique pour ce nouveau composé en 1869 (gauche).[2]
Certains dérivés de l'indole étaient utilisés comme colorants jusqu'à la fin du XIXe siècle. L'intérêt pour se composé s'accrut au cours des années 1930, lorsque l'on découvrit que l'indole est une brique constitutive d'un grand nombre d'alcaloïdes, ainsi que d'auxines et de la tryptophane. L'indole demeure un composé très étudié et utilisé à l'heure actuelle.
Synthèse et production de l'indole
La principale méthode industrielle de production d'indole est la distillation du goudron de houille, dont l'indole est l'un des constituants importants. L'indole est contenu dans la fraction de distillat obtenue entre 220 °C et 260 °C.
L'indole et ses dérivés peuvent également être synthétisés par une grande variété de réactions chimiques. Ce chapitre ne présente pas toutes les techniques de synthèse de manière exhaustive mais un panorama historique.Synthèse de Bischler-Möhlau
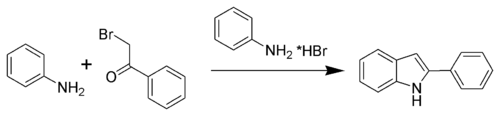
Développée au cours de la décennie 1880, la méthode de Bischler-Möhlau est l'une des toutes premières techniques de synthèse de l'indole. Au cours de la réaction, de l'α-bromo-acétophénone réagit avec un excès d'aniline en milieu acide pour former un 2-aryl-indole. Cependant, elle ne permet pas de préparer directement de l'indole non substitué.
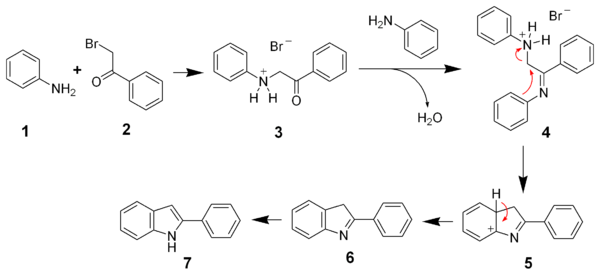
Mécanisme de la synthèse de Bischler-Möhlau
Bien que la réaction mette en œuvre des réactifs simples, son mécanisme est relativement complexe. Les deux premières étapes sont constituées par la réaction de l'α-bromo-acétophénone avec deux molécules d'aniline pour former l'intermédiaire 4. Dans cet intermédiaire, l'aniline chargé positivement est un bon groupe partant et le composé peut se cycliser pour former l'intermédiaire 5. Celui-ci subit une déprotonation rapide qui le rend aromatique, puis une tautomérie conduisant à l'indole substitué.
Références
- Bischler, A. et al.; Chemische Berichte 1892, 25, 2860.
- Bischler, A. et al.; Chemische Berichte 1893, 26, 1336.
- Möhlau, R.; Chemische Berichte 1881, 14, 171.
- Möhlau, R.; Chemische Berichte 1882, 15, 2480.
Synthèse de Fischer
Article détaillé : synthèse de Fisher de l'indole.La réaction Fisher indole est une réaction remarquable qui a été découverte par un des plus grands chimistes organiciens, Hermann Emil Fischer 1852-1919 (prix Nobel en 1902). La synthèse indolique de Fisher consiste à une addition de phenylhydrazine sur une cétone ou aldéhyde en milieu acide.
Synthèse de Reissert
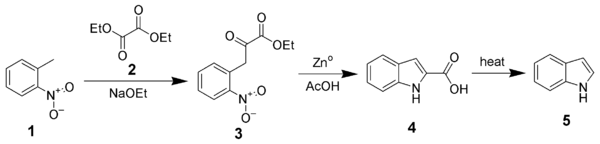
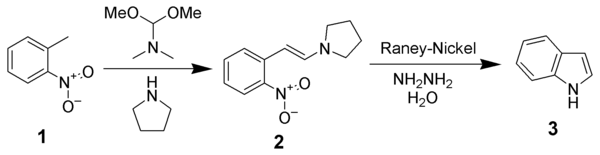
Proposée en 1897, la synthèse de Reissert est l'une des première à permettre la synthèse d'indole non substitué, en trois étapes à partir d'ortho-nitrotoluène (1).
Mécanisme de la synthèse de Reissert
Au cours de la première étape, le groupement méthyle de l'ortho-nitrotoluène (1) est déprotoné en milieu fortement basique (présence d'éthanolate sous la forme NaOEt), ce qui permet sa condensation avec le diéthyloxalate (2) pour former l'éthyl o-nitrophénylpyruvate (3) (avec régénération de NaOEt). La seconde étape consiste en une réduction/cyclisation en présence de zinc dans l'acide acétique pour former du 2-carboxy-indole (4). Celui-ci peut être décarboxylé par simple chauffage pour former l'indole (5).
Référence
- Reissert, A. Chemische Berichte 1897, 30, 1030.
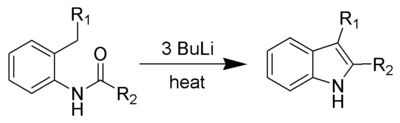
Synthèse de Madelung
La synthèse de Madelung, développée en 1912, est une réaction permettant la fabrication d'indole (substitué ou non substitué) par la cyclisation intramoléculaire d'un N-phénylamide. Elle se fait à haute température en présence d'une base forte.
Cette méthode a l'inconvénient de s'effectuer à partir d'un réactif de départ devant être lui-même synthétisé. Elle ne constitue donc que la dernière étape d'une chaîne de réaction passant par un N-phénylamide.
Références
- Madelung, W.; Chemische Berichte 1912, 45, 1128.
Synthèse de Leimgruber-Batcho
La méthode de synthèse de l'indole de Leimgruber-Batcho, découverte et brevetée en 1976, permet de préparer de l'indole et des dérivés substitués avec un bon rendement. Elle est tout particulièrement utilisée dans l'industrie pharmaceutique pour préparer des médicaments dont la structure contient des dérivés indolés.
Cette synthèse s'effectue en deux étapes, à partir de l'ortho-nitrotoluène. Celui-ci est d'abord transformé en une énamine, qui est ensuite réduite pour obtenir l'indole.
L'étape de réduction ci-dessus (2 à 3) utilise du nickel de Raney et de l'hydrazine. Ceux-ci peuvent être remplacés indifféremment par du chlorure d'étain II ou du fer dans l'acide acétique.
Cette synthèse a été très utilisée dans l'industrie bien avant que la méthode soit publiée dans la littérature scientifique. La bonne maîtrise d'une méthode de synthèse de l'indole est en effet importante pour l'industrie pharmaceutique, de nombreux dérivés de l'indole étant utilisés comme principe actif dans des médicaments. Cette méthode est devenue une alternative très populaire à la méthode de Fischer, car de nombreux dérivés de l'ortho-nitrotoluène sont disponibles commercialement ou aisés à préparer. De plus, cette méthode est caractérisée par un rendement élevée dans des conditions de synthèse "douces".
Mécanisme de la synthèse de Leimgruber-Batcho
Au cours de la première étape de la réaction (formation de l'énamine), la pyrrolidine réagit avec le diméthylformamide diméthylacétal en éliminant de la diméthylamine (DMA, gaz), ce qui permet de la rendre plus réactive. Le groupement méthyle du nitrotoluène peut être déprotoné, et le carbanion qui en résulte peut attaquer la pyrrolidine activée, ce qui conduit à l'énamine avec une élimination simultanée de méthanol. La réaction peut également être mise en œuvre sans pyrrolidine en utilisant de la N,N-diméthylenamine, mais la réaction est alors nettement plus lente.
Au cours de la seconde étape, le groupement -NO2- est réduit en -NH2 en utilisant du dihydrogène et du nickel de Raney comme catalyseur, réduction suivie par une élimination de la pyrrolidine conduisant à l'indole. Le dihydrogène est généralement produit in-situ par la décomposition spontanée de l'hydrazine en présence de nickel.
Références
- Batcho, A. D.; Leimgruber, W. U.S. Patent # 3,976,639
- Batcho, A. D.; Leimgruber, W. Organic Syntheses 1985, 63, 214-220. (Article)
Utilisation de l'Indole
L'essence naturelle de jasmin utilisé en parfumerie contient environ 2,5 % d'indole. La production de 1 kg d'essence naturelle requiert plusieurs millions de fleurs et coûte de l'ordre de 10 000 $. L'indole est donc utilisé (parmi d'autres composés) pour fabriquer de l'essence de jasmin synthétique, pour un coût de l'ordre de 10 $/kg.
L'indole est également le réactif de départ de la synthèse d'un grand nombre de composés organiques : pigments, composants de parfums, médicaments...
Réactions chimiques mettant en jeu l'Indole
Caractère basique du doublet de l'azote
Bien que l'atome d'azote possède un doublet libre (deux électrons ne participant pas aux liaisons chimiques), l'indole est nettement moins basique que les amines ou que l'aniline. En effet, ce doublet d'électron est délocalisé et participe à l'aromaticité du système. La forme basique (l'indole) est donc nettement plus stable que la forme acide (protonée) pour laquelle l'aromaticité est perdue. La forme protonée possède une constante d'acidité pKa=-3,6. Il faut donc utiliser un acide fort (comme l'acide chlorhydrique), pour protoner une fraction significative d'indole.
Substitution électrophile aromatique
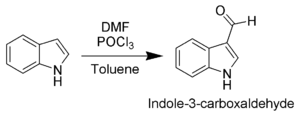
Du fait de son caractère aromatique, l'indole peut subir une substitution électrophile aromatique (substitution d'un atome d'hydrogène par un groupement électrophile. La position la plus réactive vis à vis de la substitution électrophile aromatique est la position C-3 (qui est environ 1000 fois plus réactive que celles situées sur le cycle benzénique). Par exemple, lors d'une formylation de Vilsmeier-Haack[3] effectuée à la température ambiante, seule la position C-3 est substituée (voir schéma).
Les positions situées sur le cycle pyrrole étant plus réactives, les substitutions électrophiles aromatiques du cycle benzénique ne peuvent avoir lieu que lorsque les positions N-1, C-2 et C-3 ont subi une substitution.
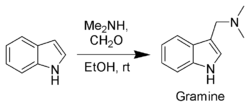
Parmi les composés obtenus par ce type de réactions on peut citer la gramine, un intermédiaire de synthèse important, fabriqué à partir d'indole, de diméthylamine et de formaldéhyde par la réaction de Mannich.
Caractère acide de l'atome d'hydrogène lié à l'azote
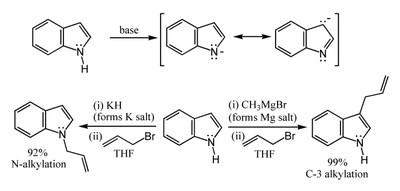
L'atome d'hydrogène porté par l'azote possède un faible caractère acide, avec une constante d'acidité pKa=21 dans le DMSO. La déprotonation de l'atome d'azote nécessite donc l'utilisation d'une base très forte comme l'hydrure de sodium ou le butyl lithium, et un milieu totalement anhydre. Les sels résultant de la déprotonation peuvent réagir de deux manières. Les sels très ioniques comme les sels de sodium ou de potassium réagissent préférentiellement par une attaque électrophile sur l'atome d'azote (voie de gauche sur le schéma). À l'inverse, les sels plus covalents, notamment les organo-magnésiens (réactif de Grignard) et les complexes à base de zinc, réagissent préférentiellement par l'intermédiaire du carbone C-3 (voie de droite sur la schéma). De même, le solvant utilisé influe sur la réaction : les solvants polaires et aprotiques comme le DMF ou le DMSO favorisent une réaction par l'atome d'azote, tandis que les solvants apolaires comme le toluène favorisent une réaction par le carbone C-3.[4]
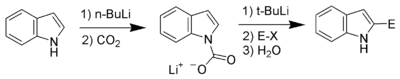
Acidité du carbone, lithiation de la position 2
En termes d'acidité, l'atome d'hydrogène le plus acide après celui lié à l'atome d'azote est celui lié à l'atome de carbone en position 2. À condition d'effectuer en premier lieu une protection de la fonction azotée, il est donc possible de déprotoner le carbone en position 2, en utilisant par exemple du butyl lithium ou du diisopropylamide lithium (LDA). Le carbanion résultant est un nucléophile très puissant, qui peut donc réagir avec des composés électrophiles. (exemple :[5]
Oxydation de l'indole
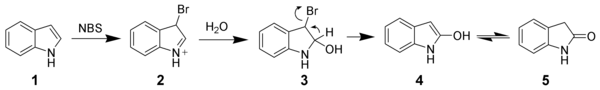
L'indole est un composé riche en électrons (10 électrons délocalisés sur les cycles) qui peut être facilement oxydé. Par exemple, le N-Bromosuccinimide permet d'oxyder l'indole (1) de manière sélective pour former l'oxindole (4 en équilibre avec 5).
Cycloadditions
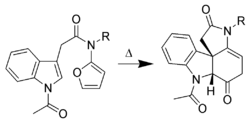
Les liaisons π portées par les atomes de carbone en positions C-2 et C-3 peuvent réagir dans des réactions de type cycloaddition (Réaction de Diels-Alder). Les réactions intermoléculaires ne sont pas favorables. En revanche, les réactions intramoléculaires (utilisant des dérivés substitués de l'indole) permettent d'obtenir de bons rendements. Dans l'exemple présenté ci-dessous[6], l'indole est le diénophile et le 2-aminofurane est le diène.
Sécurité
L'indole peut réagir fortement avec les oxydants forts. C'est un composé irritant pour les yeux. En cas d'ingestion, il est irritant pour la bouche, la gorge, l’œsophage et le tube digestif.
Phrases de risque et conseils de prudence
- R: 21/22 (Nocif par contact avec la peau et par ingestion)
- R: 36 (Irritant pour les yeux)
- R: 50 (Très toxique pour les organismes aquatiques)
- S: 36/37 (Porter un vêtement de protection et des gants appropriés)
- S: 61 (Éviter le rejet dans l’environnement. Consulter les instructions spéciales/la fiche de données de sécurité)
Références générales
- ↑ a , b et c (en) « Indole » sur ChemIDplus, consulté le 8 février 2009
- ↑ A. Baeyer, A. Emmerling, Chemische Berichte, 2, 679 (1869).
- ↑ Organic Syntheses, Coll. Vol. 4, p.539; Vol. 39, p.30 Article
- ↑ Organic Syntheses, Coll. Vol. 6, p.104; Vol. 54, p.58 Article
- ↑ Bergman, J.; Venemalm, L. J. Org. Chem. 1992, 57, 2495 - 2497.
- ↑ Lynch, S. M. ; Bur, S. K.; Padwa, A.; Org. Lett. 2002, 4, 4643 - 4645. Abstract
- Indoles Part One, W. J. Houlihan (ed.), Wiley Interscience, New York, 1972.
- J. A. Joule, K. Mills Heterocyclic Chemistry, 4th edition, Blackwell Science, Oxford, UK, 2000.
Voir aussi
- Portail de la chimie
Catégories : Composé aromatique | Azole | Composé indolé | Arôme
Wikimedia Foundation. 2010.