- Dioxyde D'azote
-
Dioxyde d'azote
Dioxyde d'azote 
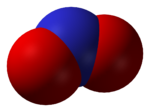
Général Nom IUPAC dioxyde d'azote Synonymes No CAS No EINECS PubChem SMILES InChI Apparence gaz brun rougeatre ou liquide brun ou jaune, d'odeur âcre[1]. Propriétés chimiques Formule brute NO2 [Isomères] Masse molaire 46,0055 g∙mol-1
N 30,45 %, O 69,55 %,Propriétés physiques T° fusion -11,2 °C[1] T° ébullition 21,2 °C[1] Solubilité dans l'eau : réaction[1] Masse volumique (eau = 1) : 1,45 (liquide)[1] Pression de vapeur saturante à 20 °C : 96 kPa[1] Précautions Directive 67/548/EEC 
T+Phrases R : 26, 34, Phrases S : (1/2), 9, 26, 28, 36/37/39, 45, Transport 265 1067 SIMDUT[2] 


SGH[3] 


DangerInhalation Mortel, apparition d'acide nitrique dans les poumons par réaction avec l'eau Unités du SI & CNTP, sauf indication contraire. Le dioxyde d'azote (NO2) est une molécule de masse molaire égale à 46 g/mol et composée de deux atomes d'oxygène et d'un atome d'azote. C'est un gaz brun-rougeâtre, suffocant dans les conditions normales de température et de pression. Il est également très réactif vis-à-vis des molécules organiques puisqu'il se présente sous forme d'un radical comme l'indique sa mésomérie :
Il présente une coloration brunâtre (vapeurs rutilantes) et une odeur douçâtre. C'est une des odeurs que l'on perçoit dans les rues polluées par la circulation automobile.
Sommaire
Équilibre monomère-dimère
Ce gaz a un équilibre permanent, mais dépendant des conditions de température et de pression, avec son dimère le peroxyde d'azote (N2O4).
Équation d'équilibre :
2 NO2 ↔ N2O4
Cet équilibre est caractérisé par une enthalpie de : ΔH = -57,23 kJ/mol.Cette dimérisation est donc favorisée à basses températures. Le peroxyde d'azote N2O4, corps diamagnétique transparent peut être obtenu en un solide fondant à –11,2°C[4].
Et il se retransforme réversiblement en NO2, le monomère paramagnétique coloré, en une réaction endothermique à plus hautes températures.
NO2 comme polluant
L'électron non-apparié du dioxyde d'azote en fait un oxydant et un poison assez violent : son inhalation donne une réaction instantanée avec l'eau de la muqueuse interne des poumons, conduisant à la production d'acide nitrique.
Les moteurs diesel comptent parmi les premières sources d'émission de ce gaz. Les cartes satellitaires de la pollution par NO2 montrent 3 foyers principaux comme sources, mais aussi que les routes des navires marchands et de guerre sont tracées par le NO2, notamment en Mer Rouge et dans l'Océan Indien entre la pointe sud de l’Inde et l’Indonésie. Au-dessus de la mer, le taux d'UV est augmenté et les moteurs marins n'ont pas bénéficié des progrès de l'automobile. Leur fioul est de plus de mauvaise qualité.
Le charbon actif adsorbe très efficacement NO2, tant qu'il n'est pas saturé. L'évaluation des taux de dioxyde d'azote se fait grâce à des capteurs spécifiques.
Lien externe
- (fr) Pollution de l'air par le dioxyde d'azote et santé résumé de GreenFacts de rapports scientifiques de l'OMS
Références
- ↑ a , b , c , d , e et f DIOXYDE D'AZOTE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- ↑ « Dioxyde d'azote » dans la base de données de produits chimiques Reptox de la CSST (organisme canadien responsable de la sécurité et de la santé au travail), consulté le 23 avril 2009.
- ↑ Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008).
- ↑ Holleman, A. F.; Wiberg, E. "Inorganic Chemistry" Academic Press: San Diego, 2001. ISBN 0-12-352651-5.
- Portail de la chimie
Catégories : Produit chimique très toxique | Produit chimique corrosif | Produit chimique comburant | Oxyde | Gaz inorganique | Composé de l'azote | Pollution de l'air
Wikimedia Foundation. 2010.






