- Acétylacétonate
-
Acétylacétone
Acétylacétone 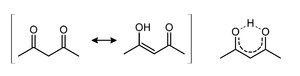
Général Nom IUPAC Pentane-2,4-dione Synonymes diacétylméthane
β,δ-dioxopentane
AcAcNo CAS No EINECS SMILES Apparence liquide incolore, d'odeur caractéristique.[1] Propriétés chimiques Formule brute C5H8O2 [Isomères] Masse molaire 100,1158 g∙mol-1
C 59,98 %, H 8,05 %, O 31,96 %,Propriétés physiques T° fusion -23 °C[1] T° ébullition 140 °C[1] Solubilité dans l'eau : 16 g/100 ml[1] Masse volumique (eau = 1) : 0.98[1] T° d’auto-inflammation 340 °C[1] Point d’éclair 34 °C[1] Limites d’explosivité dans l’air en volume % dans l'air : 2.4-11.6[1] Pression de vapeur saturante à 20 °C : 0.93 kPa[1] Précautions Directive 67/548/EEC 
XnPhrases R : 10, 22, Phrases S : (2), 21, 23, 24/25, NFPA 704 Stockage Catégorie 4
(stocker entre +15 °C et +25 °C)SGH[2] 

AttentionÉcotoxicologie DL50 790 mg/kg (voie dermale)
575 mg/kg (voie orale)Unités du SI & CNTP, sauf indication contraire. L'acétylacétone est un composé organique de formule chimique C5H8O2. Cette dicétone nommée selon la nomenclature IUPAC : pentane-2,4-dione, bien que cette dénomination puisse être soumise à délibération (voir ci-après), puisqu'elle ne décrit pas exactement la structure du composé.
Sommaire
Propriétés
 Figure 1 : tautomérie de l'acétylacétone.
Figure 1 : tautomérie de l'acétylacétone.
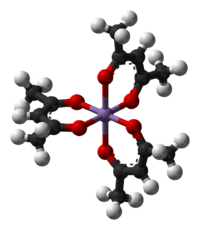
Les formes tautomères énol et cétone de l'acétylacétone coexistent en solution, comme montré figure 1. La symétrie C2v de la forme énol (forme à droite pour l'équilibre décrit figure 1) a été observée via différentes méthodes incluant la spectroscopie micro-ondes[3]. La liaison hydrogène de l'énol réduit la répulsion stérique entre les deux groupes carbonyles. La constante d'équilibre K entre les deux formes tautomères est de 11,3 en phase gazeuse. Cette constante tend à croître dans les solvants apolaires : dans le cyclohexane : 42; dans le toluène : 10; dans le THF : 7,2; diméthylsulfoxyde : 2; et dans l'eau : 0,23[4].
Préparation
Deux procédés classiques sont utilisés pour synthétiser l'acétylacétone. Dans le premier, l'acétone et l'anhydride acétique réagissent grâce à l'addition de BF3 utilisé comme catalyseur.
- (CH3CO)2O + CH3C(O)CH3 → CH3C(O)CH2C(O)CH3
Le second procédé implique la condensation catalysée par base de l'acétone et de l'acétate d'éthyle, suivie par une acidification :
- NaOEt + EtO2CCH3 + CH3C(O)CH3 → NaCH3C(O)CHC(O)CH3 + 2 EtOH
- NaCH3C(O)CHC(O)CH3 + HCl → CH3C(O)CH2C(O)CH3 + NaCl
En raison de la facilité de procéder à ces synthèses, de nombreux analogues des acétylacétonates sont connus. On peut ainsi citer : C6H5C(O)CH2C(O)C6H5 (dbaH) et (CH3)3CC(O)CH2C(O)CC(CH3)3. L'hexafluoroacétylacétonate est très largement utilisé, en particulier pour générer des complexes de métaux volatiles.
Ion acétylacétonate
L'« ion acétylacétonate » C5H7O2− est la base conjuguée du pentane-2,4-dione. En réalité, l'ion libre n'existe pas en solution, mais est lié à un cation comme Na+. En pratique, l'existence de l'anion libre, communément abrévié en acac−, est un modèle utile.
Chimie de coordination
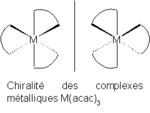
L'anion acétylacétonate forme des complexes avec de nombreux ions de métaux de transition dans lesquels les deux atomes d'oxygène se lient au métal pour former un anneau de chélation à six membres. On peut citer parmi ces complexes : Mn(acac)3[5], le , Fe(acac)3, et Co(acac)3. Tout complexe de la forme M(acac)3 est chiral (ils ne sont pas superposables à leurs images dans un miroir), comme indiqué sur la figure 2.
De plus, les complexes M(acac)3 peuvent être réduits par voie électrochimique, avec un taux de réduction dépendant du solvant et du centre métallique[6]. Les complexes double ou triple du type M(acac)2 et M(acac)3 sont typiquement solubles dans des solvants organiques, contrairement aux halogénures de métaux liés. En raison de ces propriétés, ces complexes sont très largement utilisés comme précurseurs ou réactifs de catalyse. Les applications les plus importantes incluent leur utilisation en tant que « réactifs de déplacement » RMN, comme catalyseurs pour les synthèses organiques, et comme précurseurs pour les catalyseurs d'hydroformylation.
C5H7O2− se lie parfois aux métaux par son atome de carbone central; ce mode de liaison est plus commun pour les métaux de transition de la troisième période comme le platine (II) ou l'iridium (III).Exemples d'acétylacétonates de métaux
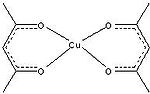
Acétylacétonate de cuivre II
Le Cu(acac)2, préparé par traitement de l'acétylacétone avec du Cu(NH3)42+ et disponible dans le commerce, catalyse les réactions de couplage et de transferts de carbènes.
Acétylacétonate de cuivre I
Contrairement au chélate de cuivre II, l'acétylacétonate de cuivre I est une espèce oligomérique réactive à l'air. Il est employé pour catalyser les réactions de Michaels[7].
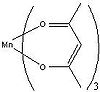
Acétylacétonate de manganèse III
 Modèle ball-and-stick de Λ-Mn(acac)3, avec une élongation quadratique de Jahn-Teller.
Modèle ball-and-stick de Λ-Mn(acac)3, avec une élongation quadratique de Jahn-Teller.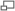
Mn(acac)3, oxydant monoélectronique, est communément utilisé pour le couplage des phénols[5]. Il est préparé par réaction directe de l'acétylacétone et du permanganate de potassium. En termes de structure électronique, Mn(acac)3 est un composé haut-spin. Sa structure octaédrique distordue traduit les distorsions géométriques dues à l'effet Jahn-Teller. Les deux structures les plus communes de ce complexe sont les suivantes : une avec une élongation quadratique, l'autre avec une compression quadratique. Dans l'élongation, deux liaisons Mn-O mesurent 2,12 Å alors que les quatre autres mesurent 1,93 Å. Dans le cas de la compression , deux liaisons Mn-O mesurent 1,95 Å alors que les quatre autres mesurent 2,00 Å. Les effets de l'élongation quadratique sont plus signicatifs que les effets de la compression quadration[8].
Acétylacétonate de nickel
Ce composé n'est le composé de formule Ni(acac)2, mais le trimère [Ni(acac)2]3. C'est un solide vert émeraude soluble dans le benzène, qui est très utilisé dans la préparation des complexes Ni(O). Exposé à l'atmosphère, [Ni(acac)2]3 se transforme en l'hydrate monomère vert crayeux.
Acétylacétonates à liaisons carbone
C5H7O2− se lie parfois aux métaux par le carbone central (C3) : ce mode de liaison est plus courant pour les métaux de transitions de la troisième période comme le platine (II) et l'iridium (III). Les complexes Ir(acac)3 et les bases de Lewis adduites correspondantes Ir(acac)3L (ou L est une amine) comprennent un ligand acac carbone-lié. Le spectre infrarouge des acétylacétonates oxygène-liés sont caractérisés par des bandes νCO d'énergie relativement basse (1535 cm−1), alors que dans les acétylacétonates carbone-liés, la vibration du carbonyle se produit plus près de la gamme d'énergie pour le C=O cétonique, c'est-à-dire à 1655 cm−1.
Autres réactions avec l'acétylacétone
Parmi les autres réactions impliquant l'acétylacétone, on peut citer :
- les déprotonations : des bases très fortes déprotoneront l'acétylacétone doublement, démarrant en C3 et mais aussi en C1. Les espèces résultantes peuvent être ensuite alkylées en C-1.
- comme précurseur pour hétérocycles : l'acétylacétone est un précurseur versatile pour les hétérocycles. L'hydrazine réagit pour donner des pyrazols, l'urée donne des pyridimines.
- comme précurseur pour les imino-ligands liés : l'acétylacétone se condense avec les amindes pour donner, de manière successive, les mono- et di-dicétimines dans lesquelles les atomes d'oxygène dans l'acétylacétone sont remplacés par NR (ou R = aryl, alkyl).
- dépression enzymatique : l'enzyme acétylacétone dioxygénase coupe la liaison carbone-carbone de l'acétylacétone, produisant ainsi de l'acétate et le 2-oxopropanal. L'enzyme est dépendante au Fe (II), mais il a cependant été prouvé qu'elle pouvait lier aussi le zinc. La dégradation de l'acétylacétone a été caractérisée pour la bactérie Acinetobacter johnsonii[9].
- C5H8O2 + O2 → C2H4O2 + C3H4O2
- Arylation : l'acétylacétonate déplace les halogénures depuis certains acides benzoïques halogéno-substitués. Cette réaction est catalysée par le cuivre.
- 2-BrC6H4CO2H + NaC5H7O2 → 2-(CH3CO)2HC)-C6H4CO2H + NaBr
Références
Références citées
- ↑ a , b , c , d , e , f , g , h et i 2, 4 - PENTANEDIONE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- ↑ Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- ↑ W. Caminati, J.-U. Grabow, « The C2v Structure of Enolic Acetylacetone », dans Journal of the American Chemical Society, vol. 128, no 3, 2006, p. 854 - 857 [lien DOI]
- ↑ Solvents and Solvent Effects in Organic Chemistry, Christian Reichardt Wiley-VCH; 3 edition 2003 ISBN 3-527-30618-8
- ↑ a et b B. B. Snider, "Manganese(III) Acetylacetonate" in Encyclopedia of Reagents for Organic Synthesis (Ed: L. Paquette) 2004, J. Wiley & Sons, New York. DOI:10.1002/047084289
- ↑ W. Fawcett, M. Opallo, « Kinetic parameters for heterogeneous electron transfer to tris(acetylacetonato)manganese(III) and tris(acetylacetonato)iron(III) in aproptic solvents », dans Journal of Electroanalytical Chemistry, vol. 331, 1992, p. 815-830 [lien DOI]
- ↑ E. J. Parish, S. Li "Copper(I) Acetylacetonate" in Encyclopedia of Reagents for Organic Synthesis (Ed: L. Paquette) 2004, J. Wiley & Sons, New York. DOI:10.1002/047084289X.rc203
- ↑ Cotton, F. Albert; Wilkinson, Geoffrey; Murillo, Carlos A.; Bochmann, Manfred (1999). Advanced Inorganic Chemistry (6th Edn.) New York:Wiley-Interscience. ISBN 0-471-19957-5.
- ↑ Straganz, G.D., Glieder, A., Brecker, L., Ribbons, D.W. and Steiner, W. "Acetylacetone-Cleaving Enzyme Dke1: A Novel C-C-Bond-Cleaving Enzyme." Biochem. J. 369 (2003) 573-581 DOI:10.1042/BJ20021047
Références utilisées
- E. J. Parish, S. Li "Copper(II) Acetylacetonate" in Encyclopedia of Reagents for Organic Synthesis (Ed: L. Paquette) 2004, J. Wiley & Sons, New York. DOI:10.1002/047084289
- N. Barta, "Bis(acetylacetonato)zinc(II)" in Encyclopedia of Reagents for Organic Synthesis (Ed: L. Paquette) 2004, J. Wiley & Sons, New York. DOI:10.1002/047084289X.rb097
Lectures supplémentaires
- Bennett, M. A.; Heath, G. A.; Hockless, D. C. R.; Kovacik, I.; Willis, A. C. "Alkene Complexes of Divalent and Trivalent Ruthenium Stabilized by Chelation. Dependence of Coordinated Alkene Orientation on Metal Oxidation State" Journal of the American Chemical Society 1998: 120 (5) 932-941. DOI:10.1021/ja973282k
- Albrecht, M. Schmid, S.; deGroot, M.; Weis, P.; Fröhlich, R. "Self-assembly of an Unpolar Enantiomerically Pure Helicate-type Metalla-cryptand" Chemical Communications 2003: 2526–2527. DOI:10.1039/b309026d
- Charles, R. G., "Acetylacetonate manganese (III)" Inorganic Synthesis, 1963, 7, 183-184.
- Richert, S. A., Tsang, P. K. S., Sawyer, D. T., "Ligand-centered redox processes for manganese, iron and cobalt, MnL3, FeL3, and CoL3, complexes (L = acetylacetonate, 8-quinolinate, picolinate, 2,2'-bipyridyl, 1,10-phenanthroline) and for their tetrakis(2,6-dichlorophenyl)porphinato complexes[M(Por)]"Inorganic Chemistry, 1989, 28, 2471-2475. DOI:10.1021/ic00311a044
- Wong-Foy, A. G.; Bhalla, G.; Liu, X. Y.; Periana, R. A.. "Alkane C-H Activation and Catalysis by an O-Donor Ligated Iridium Complex." Journal of the American Chemical Society, 2003: 125 (47) 14292-14293. DOI:10.1021/ja037849a
- Tenn, W. J., III; Young, K. J. H.; Bhalla, G.; Oxgaard. J.; Goddard, W. A., III; Periana, R. A. "CH Activation with an O-Donor Iridium-Methoxo Complex." Journal of the American Chemical Society, 2005: 127 (41) 14172-14173. DOI:10.1021/ja051497l
Liens externes
- (en) Cet article est partiellement ou en totalité issu d’une traduction de l’article de Wikipédia en anglais intitulé « Acetylacetone ».
- Portail de la chimie
Catégories : Produit chimique nocif | Cétone | Agent chélatant
Wikimedia Foundation. 2010.