- 7782-50-5
-
Dichlore
Dichlore 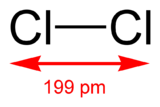
Général Nom IUPAC Dichlore No CAS No EINECS No E E925 Apparence gaz jaune-verdatre, d'odeur acre.[1] Propriétés chimiques Formule brute Cl2 [Isomères] Masse molaire 70,906 g∙mol-1
Cl 100 %,Propriétés physiques T° fusion -101 °C[1] T° ébullition -34,6 °C[1] Solubilité 14,6 g/l dans l'eau à 0 °C,
7,3 g/l à 20 °C,
5,7 g/l à 30 °CMasse volumique 2,48 (par rapport à l'air)
à 20 °C 6.864atm : 1.4085(liq)
à -35 °C 0.9949atm : 1.5649(liq)Pression de vapeur saturante 6,776 bar à 20 °C
8,8 bar à 30 °C
14,3 bar à 50 °CPoint critique 143,81 °C
79.914 bar
0,57688 kg/lPoint triple -100,98 °C
0,01387 barPrécautions Directive 67/548/EEC 
T
NPhrases R : 23, 36/37/38, 50, Phrases S : (1/2), 9, 45, 61, Transport 268 1017 NFPA 704 SIMDUT[2] 

SGH[3] 



DangerInhalation odeur suffocante Écotoxicologie CL50 1 heure :
rats 293ppm
souris 137ppmUnités du SI & CNTP, sauf indication contraire. Le dichlore (Cl2) est une molécule formée de deux atomes de chlore. C'est un gaz dans les conditions normales de pression et de température.
C'est un gaz jaune-vert (chloros signifie « vert » en grec). Il est 2,5 fois plus lourd que l'air. Il a une odeur suffoquante très désagréable et est extrêmement toxique.
Le dichlore a été découvert par Scheele en 1774. Il a été utilisé lors de la Première Guerre mondiale en tant que gaz de combat, la bertholite.
Le dichlore est soluble dans l'eau formant l'eau de chlore, mais il n'est pas soluble dans l'eau salée.
Sommaire
Production
Le dichlore peut être produit facilement en électrolysant une solution de chlorure de sodium.
- 2Na+ + 2Cl- + 2H2O → 2NaOH + Cl2 + H2
Il est très toxique.
Utilisation
Le dichlore est utilisé comme matière première pour produire de l'acide chlorhydrique (HCl) par réaction entre le dichlore et le dihydrogène .
- Cl2 + H2 → 2HCl
Il est aussi utilisé pour produire du Polychlorure de vinyle (PVC).
Voir aussi
Références
- ↑ a , b et c CHLORE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- ↑ « Chlore » dans la base de données de produits chimiques Reptox de la CSST (organisme canadien responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- ↑ Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- Portail de la chimie
Catégories : Produit chimique toxique | Produit chimique dangereux pour l'environnement | Produit chimique corrosif | Produit chimique comburant | Gaz inorganique | Composé du chlore | Gaz toxique
Wikimedia Foundation. 2010.



