- Extinction Crétacé-Tertiaire
-
Une roche du Wyoming (États-Unis) avec une couche intermédiaire d'argile qui contient 1000 fois plus d'iridium que les couches supérieures et inférieures ; photo prise au musée d'histoire naturelle de San Diego.

L’extinction Crétacé-Tertiaire ou extinction K-T (de l'allemand Kreide-Tertiär) qui marque la fin du Crétacé est une extinction massive et à grande échelle d'espèces animales et végétales qui s'est produite il y a 65,5 Ma environ, dans une courte période de temps à l'échelle géologique. Cet évènement marque la fin de l'ère mésozoïque et le début de l'ère cénozoïque[1]. Largement connue comme l’extinction K-T, elle est associée à une signature géologique connue sous le nom de limite K-T, habituellement une couche mince d'argile présentant un taux anormal d'iridium que l'on retrouve dans diverses régions du monde. K est l'abréviation traditionnelle pour la période du crétacé (dérivé du nom allemand Kreidezeit), et T est l'abréviation du tertiaire, terme historique qui désigne la période maintenant couverte par les périodes paléogène et néogène. L'emploi du terme « Tertiaire » étant maintenant déconseillé comme unité formelle de temps ou de roche par la Commission internationale sur la stratigraphie, l'évènement de K-T est maintenant désigné comme l'extinction du Crétacé-Paléogène (ou K-Pg) par beaucoup de chercheurs[2].
La plupart des fossiles de dinosaures non-aviaires se trouvent au-dessous de la limite du K-T, les paléontologues estiment majoritairement que les dinosaures non aviaires se sont éteints juste avant, ou pendant l'évènement[3]. Les quelques fossiles de dinosaures découvert au-dessus de la limite K-T étaient supposés être là du fait du remaniement des sédiments, c'est-à-dire que l'érosion les a ramenés à la surface puis ils ont été recouvert par un dépôt de sédiments plus récents[4],[5],[6]. Cependant, cette théorie n'est pas certaine, les systèmes de datation utilisés jusqu'au début des années 2010 ne permettant pas de dater directement les ossements[7]. Les mosasaures, les plésiosaures, les ptérosaures et de nombreuses espèces de plantes et d'invertébrés se sont également éteints. Les clades de mammifères et d'oiseaux ont survécu avec peu d'extinctions, et une radiation évolutive des taxons du Maastrichtien s'est produite bien après la limite. Les taux d'extinctions et de radiations ont varié à travers différents clades[8].
Les théories scientifiques expliquent les extinctions de K-T par un ou plusieurs évènements catastrophiques, tels que des impacts massifs d'astéroïdes, ou une activité volcanique accrue. La datation de plusieurs cratères d'impact (comme l'impact de Chicxulub[9]) et d'une activité volcanique massive (dans les trapps du Deccan), coïncide avec la période approximative de l'évènement d'extinction. Ces évènements géologiques auraient réduit la lumière du Soleil et gêné la photosynthèse, menant à une rupture massive dans l'écologie de la Terre. D'autres chercheurs croient que l'extinction a été plus progressive, résultant de changements plus lents du niveau de la mer ou du climat[8].
En mars 2010, un groupe de 41 scientifiques se sont accordés dans la revue Science sur le fait que la chute de l'astéroïde à l'origine du cratère de Chicxulub avait été l'événement déclencheur de l'extinction K-Pg[10].
Sommaire
Schémas d'extinction
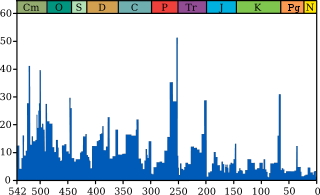
Intensité des extinctions marines à travers le tempsLe graphique bleu indique le pourcentage apparent (pas en nombre absolu) de genres d'animaux marins ayant disparus au cours d'un intervalle de temps. Il ne représente pas toutes espèces marines, mais seulement les espèces marines fossiles. Les 5 plus grandes extinctions sont liées, voir les extinction massives pour plus de détails.
Source et information sur le graphique
Bien que l'évènement de la limite K-T ait été de grande ampleur, il y eut une variabilité significative du taux d'extinction entre les différents groupes d'espèces. On suppose que des particules atmosphériques ont bloqué la lumière du Soleil, réduisant la quantité d'énergie solaire pouvant atteindre la Terre. Les effectifs des espèces dépendant de la photosynthèse ont donc diminué, certaines espèces se sont même éteintes. Vers la fin du crétacé, les organismes qui photosynthétisent, dont le phytoplancton et les plantes terrestres, étaient à la base de la chaîne alimentaire comme c'est le cas aujourd'hui. L'extinction d'espèces végétales alors dominantes a causé un remaniement important de ce groupe d'organismes[11]. L'observation suggère que les animaux herbivores se sont éteints quand les plantes dont ils dépendaient pour se nourrir sont devenues rares ; en conséquence, les prédateurs supérieurs comme le Tyrannosaure ont également péri.
Les coccolithophorides (des algues unicellulaires microscopiques) et les mollusques, incluant les ammonites, les rudistes, les escargots d'eau douce et les moules, ainsi que les organismes dont la chaîne alimentaire inclut ces animaux à coquilles se sont éteints ou ont connu de lourdes pertes. Par exemple, on pense que les ammonites étaient la nourriture principale de mosasaures, un groupe de reptiles marins géants qui se sont éteints précisément à cette période[12].
Les omnivores, les insectivores et les charognards ont survécu à l'évènement d'extinction, peut-être en raison de la plus grande disponibilité de leurs sources de nourriture. À la fin du crétacé il ne semble y avoir eu aucun mammifère purement herbivore ou purement carnivore. Les mammifères et les oiseaux qui ont survécu à l’extinction se sont nourris d'insectes, de vers, et d'escargots, qui eux-mêmes se nourrissaient de matière morte végétale ou animale. Les scientifiques pensent que ces organismes ont survécu à l'effondrement des chaînes alimentaires basées sur les plantes parce qu'ils se sont nourris de détritus ou d'autres matériaux organiques non vivants[8],[13],[14].
Dans les biocénoses des cours d'eau, peu de groupes d'animaux se sont éteints parce que ces communautés dépendent moins directement des plantes vivantes pour leur nourriture et plus des détritus qui ruissellent de la terre, ce qui les protégea de l'extinction[15]. Des mécanismes semblables, mais plus complexes ont été observés dans les océans. Les extinctions ont été plus nombreuses parmi des animaux vivant dans la zone pélagique, que parmi des animaux des fonds sous-marins. Les animaux de la zone pélagique dépendent presque entièrement de la production primaire du phytoplancton vivant, alors que des animaux vivants dans les fonds marins s'alimentent de détritus ou peuvent passer à une alimentation constituée uniquement de détritus[8].
Les plus grands survivants aérobies de l'évènement, les crocodiliens et les champsosaures, étaient semi-aquatiques et ont eu accès aux détritus. Les crocodiliens modernes peuvent vivre comme charognards et survivre pendant des mois sans nourriture. En outre, dans leur jeunesse, ils se développent lentement et se nourrissent pendant leurs premières années en grande partie d'invertébrés et d'organismes morts ou de fragments d'organismes. Ces caractéristiques ont permis la survie de ces espèces à la fin du Crétacé[13].
Après l'évènement du K-T, la biodiversité a eu besoin d'un temps substantiel pour récupérer, en dépit de l'existence de nombreuses niches écologiques[8].
Microbiota
La limite K-T présente un des taux de disparitions et d'apparitions d'espèces les plus spectaculaires parmi celles enregistrées sur des espèces de fossiles connus. Ce phénomène a d'ailleurs particulièrement touché les nanoplanctons à l'origine des dépôts calcaires du Crétacé. Et de fait, de très nombreuses espèces, particulièrement parmi celles qui ont disparu, ont été remplacées par l'apparition de nouvelles[16],[17]. L'analyse statistique des disparitions des espèces marines suggère que la diminution de la diversité a davantage été provoquée par une forte hausse des extinctions plutôt que par une diminution de l'apparition de nouvelles espèces[18], par un mécanisme naturel et permanent appelé spéciation.
Les données concernant les phytoplanctons appelés dinophytes ne sont pas aussi bien expliquées durant cette période de transition du Crétacé au Paléogène, principalement parce que seuls les kystes fournissent de bonnes traces fossiles dans ce groupe, or les espèces de dinophytes ne passent pas toutes par le stade de kyste, ce qui est probablement à l'origine d'une sous-estimation de leur diversité[8]. Les études récentes tendent à indiquer qu'il n'y aurait pas eu de variations significatives des dinophytes au niveau des couches de dépôts fossiles qui constituent la limite entre Crétacé et Tertiaire[19].
Des traces géologiques de radiolaires existent depuis au moins l’époque ordovicienne, et leurs squelettes siliceux fossiles peuvent être facilement repérés et suivis au cours de la limite K-T. Il n'y a aucune preuve d’extinction de masse de ces organismes, et en raison du refroidissement des températures au début du paléocène, on note une productivité élevée pour ces espèces au niveau des latitudes élevées de l'hémisphère Sud[8]. En ce qui concerne les diatomées, environ 46 % des espèces ont survécu à la transition crétacé-paléocène, ce qui suggère un taux de renouvellement significatif des espèces, mais pas une extinction catastrophique au passage de la limite K-T[8],[20].
La présence des foraminifères planctoniques au passage de la limite K-T a été étudiée dès les années 1930[21],[22]. Ces recherches, stimulées par la possibilité d'un d'impact cosmique, produisirent de nombreuses publications détaillant leur extinction au cours de cette période de transition[8]. Cependant, des discussions sont en cours entre ceux qui croient que les données fossiles indiquent une extinction substantielle[23], et ceux qui pensent que les données fossiles montrent de multiples extinctions et apparitions d'espèces au passage de cette limite[24],[25]. Parmi ces espèces, les espèces benthiques c'est-à-dire celle de haute mer, semblent toutes s'éteindre. On pense que la biomasse des océans a diminué après les extinctions qui ont eu lieu sur les côtes et que ces foraminifères dépendaient des débris organiques pour leur alimentation. Lorsque plus tard le nombre d'espèces de microorganismes marins a réaugmenté, on observe une augmentation concomitante du nombre d'espèces de foraminifères benthiques, vraisemblablement en raison de l'augmentation des ressources alimentaires[8]. Autrement dit, le rétablissement des populations de phytoplancton au début du paléocène a fourni la source de nourriture nécessaire pour alimenter de nouveau de grandes populations de foraminifères benthiques, qui se nourrissent toujours principalement de détritus. Au début du paléocène, le rétablissement final de ces populations benthiques s'est réalisé en plusieurs étapes qui ont duré plusieurs centaines de milliers d'années[26],[27].
Invertébrés marins
 Un fossile d'ammonite.
Un fossile d'ammonite.
Il y a une grande variabilité en ce qui concerne les taux d'extinction des invertébrés marins au passage de la limite K-T. Le nombre de fossiles et de sites fossilifères connus est faible, de ce fait les taux d'extinction calculés à partir des données récoltées peuvent ne pas correspondre à la réalité, les surestimant[8].
Les ostracodes, une classe de petits crustacés qui étaient très communs lors du Maastrichtien supérieur, ont laissé des traces fossiles dans un grand nombre d'endroits. Un examen de ces fossiles prouve que la diversité des ostracodes est plus faible au cours du paléocène qu'à n'importe quelle autre période du Tertiaire. Cependant, dans l'état actuel de la recherche, on ne peut pas déterminer si ces extinctions se sont produites avant ou pendant l'intervalle de la limite[28],[29].
Chez les coraux du Crétacé tardif, environ 60 % des genres appartenant à l'ordre des Scleractinia (coraux durs) n'ont pas réussi à passer la limite K-T et à atteindre le paléocène. L'analyse approfondie des extinctions de coraux de cette époque montre qu'environ 98 % des espèces coloniales qui habitaient les eaux tropicales chaudes et peu profondes se sont éteintes. Les coraux solitaires, qui ne forment généralement pas de récifs et habitent des régions plus froides et plus profondes de l'océan (au-dessous de la zone photique) ont moins été affectés par la limite K-T. Les espèces des colonies coralliennes dépendent d'une symbiose avec des algues photosynthétiques, dont les populations se sont effondrées en raison des évènements entourant la limite K-T[30],[31]. Cependant, l'explication de l'extinction K-T et du rétablissement au paléocène par l'utilisation des données des fossiles de coraux doit être relativisée en raison des changements qui se sont produits dans les écosystèmes de coraux au passage de la limite K-T[8].
Les nombres de genres de céphalopodes, d’échinodermes et de bivalves ont diminué significativement après la limite K-T[8]. La plupart des espèces de brachiopodes, un petit phylum d'invertébrés marins, ont survécu à l'évènement K-T et se sont diversifiés au début du paléocène.
 Rudiste, bivalve du crétacé tardif des montagnes omanaises, Émirats arabes unis. La barre de mesure est de 10 millimètres.
Rudiste, bivalve du crétacé tardif des montagnes omanaises, Émirats arabes unis. La barre de mesure est de 10 millimètres.
Mises à part la sous-classe des Nautiloidea, représentée aujourd'hui par les espèce des nautiles et un groupe issu d'une évolution de ceux-ci, à savoir les Coleoidea qui regroupe entre autres les octopodes, calmars, et seiches, toutes les autres espèces de mollusques de la classe des céphalopodes se sont éteintes à la limite K-T. Parmi celles-ci, il y avait les espèces du super-ordre Belemnoidea et les ammonites, une sous-classe de céphalopodes à coquille univalve, très diversifiés, dont les spécimens était nombreux, et à la répartition large. Des études scientifiques réalisée sur le sujet ont précisé que la stratégie reproductrice des nautiloïdes survivants, qui s'appuyait sur des œufs moins nombreux et plus gros, a joué un rôle dans leur conservation par rapport aux ammonites au cours de l'extinction. Les ammonites, elles, utilisaient d'une stratégie planctonique, c'est-à-dire que les œufs et larves étaient aussi nombreuses que petites, ce qui aurait été très défavorable. Des chercheurs ont montré que suite de la disparition des ammonites, les nautiloïdes ont connu une radiation évolutive avec des formes et des complexités de coquille qui n'avaient été auparavant observés que chez les ammonites[32],[33].
Environ 35 % des genres d'échinodermes se sont éteints à la limite K-T, ce qui est peu car ce sont les taxons qui prospéraient à la fin du Crétacé dans les eaux peu profondes, à faible latitude, qui ont eu le taux d'extinction le plus élevé. Au niveau des latitudes moyennes, les échinodermes d'eaux profondes ont été beaucoup moins affectés par l'extinction. Ce serait une perte d'habitat qui serait responsable de ces extinctions, spécifiquement la submersion des récifs d'eau peu profonde existant à ce moment-là, lors d'un épisode transgressif survenu à une période proche de celle de l'évènement d'extinction[34].
D'autres groupes invertébrés marins, notamment des bivalves comme les rudistes et les inocérames, se sont également éteints à la limite K-T[35],[36].
Les vertébrés marins
Un nombre substantiel de fossiles de poissons ont été découverts. Cela fournit de bonnes bases pour comprendre les modèles d'extinction de ces classes de vertébrés marins. Parmi les Chondrichthyes, approximativement 80 % des familles de requins, de raies et autres poissons cartilagineux ont survécu à l'évènement d'extinction[8]. Par ailleurs moins de 10 % des familles de poissons osseux, c'est-à-dire les téléostéens, se sont éteintes[37]. Mais, près de l'Antarctique, Sur l'île de Seymour (en), un site fossile daté de la période précédant immédiatement l'évènement présente des preuves d'une mort massive chez des poissons osseux. On spécule que les poissons ont subi un stress environnemental avant l'évènement de la limite K-T et que ce dernier a dû précipiter l'extinction de masse[38]. Cependant, il semble que les environnements marins et d'eau douce ont atténué l'effet de l'extinction sur les poissons[39].
Invertébrés terrestres
Bien que l'évènement de la limite K-T ait été de grande ampleur, il y eut une variabilité significative du taux d'extinction entre les différents groupes d'espèces. On suppose que des particules atmosphériques ont bloqué la lumière du Soleil, réduisant la quantité d'énergie solaire pouvant atteindre la Terre. Les effectifs des espèces dépendant de la photosynthèse ont donc diminué, certaines espèces se sont même éteintes. Vers la fin du crétacé, les organismes qui photosynthétisent, dont le phytoplancton et les plantes terrestres, étaient à la base de la chaîne alimentaire comme c'est le cas aujourd'hui. L'extinction d'espèces végétales alors dominantes a causé un remaniement important de ce groupe d'organismes[11]. L'observation suggère que les animaux herbivores se sont éteints quand les plantes dont ils dépendaient pour se nourrir sont devenues rares ; en conséquence, les prédateurs supérieurs comme le Tyrannosaure ont également péri.
Les coccolithophorides (des algues unicellulaires microscopiques) et les mollusques, incluant les ammonites, les rudistes, les escargots d'eau douce et les moules, ainsi que les organismes dont la chaîne alimentaire inclut ces animaux à coquilles se sont éteints ou ont connu de lourdes pertes. Par exemple, on pense que les ammonites étaient la nourriture principale de mosasaures, un groupe de reptiles marins géants qui se sont éteints précisément à cette période[12].
Les omnivores, les insectivores et les charognards ont survécu à l'évènement d'extinction, peut-être en raison de la plus grande disponibilité de leurs sources de nourriture. À la fin du crétacé il ne semble y avoir eu aucun mammifère purement herbivore ou purement carnivore. Les mammifères et les oiseaux qui ont survécu à l’extinction se sont nourris d'insectes, de vers, et d'escargots, qui eux-mêmes se nourrissaient de matière morte végétale ou animale. Les scientifiques pensent que ces organismes ont survécu à l'effondrement des chaînes alimentaires basées sur les plantes parce qu'ils se sont nourris de détritus ou d'autres matériaux organiques non vivants[8],[13],[14].
Dans les biocénoses des cours d'eau, peu de groupes d'animaux se sont éteints parce que ces communautés dépendent moins directement des plantes vivantes pour leur nourriture et plus des détritus qui ruissellent de la terre, ce qui les protégea de l'extinction[15]. Des mécanismes semblables, mais plus complexes ont été observés dans les océans. Les extinctions ont été plus nombreuses parmi des animaux vivant dans la zone pélagique, que parmi des animaux des fonds sous-marins. Les animaux de la zone pélagique dépendent presque entièrement de la production primaire du phytoplancton vivant, alors que des animaux vivants dans les fonds marins s'alimentent de détritus ou peuvent passer à une alimentation constituée uniquement de détritus[8].
Les plus grands survivants aérobies de l'évènement, les crocodiliens et les champsosaures, étaient semi-aquatiques et ont eu accès aux détritus. Les crocodiliens modernes peuvent vivre comme charognards et survivre pendant des mois sans nourriture. En outre, dans leur jeunesse, ils se développent lentement et se nourrissent pendant leurs premières années en grande partie d'invertébrés et d'organismes morts ou de fragments d'organismes. Ces caractéristiques ont permis la survie de ces espèces à la fin du Crétacé[13].
Après l'évènement du K-T, la biodiversité a eu besoin d'un temps substantiel pour récupérer, en dépit de l'existence de nombreuses niches écologiques[8][40],[41].
Plantes terrestres
Il existe des preuves dominantes d'une rupture globale des groupes de plantes à la limite K-T[42]. Cependant, il y a eu d'importantes disparités selon les régions observées dans la succession des plantes. En Amérique du Nord, les données suggèrent une dévastation massive des plantes dans les sections de limite K-T, bien qu'il y ait aussi eu des changements mégafloraux substantiels avant la limite[43].
Dans les latitudes élevées de l'hémisphère sud, comme la Nouvelle-Zélande et l'Antarctique, la décroissance de masse de la flore n'a causé aucun renouvellement significatif dans les espèces, mais des changements dramatiques à court terme dans l'abondance relative des groupes de plantes[40],[44]. En Amérique du Nord, approximativement 57 % des plantes se sont éteintes. La redressement des plantes au paléocène a commencé par des re-colonisations dominées par les fougères qui présentent alors un net pic d'abondance d'espèces illustré par les données géologiques ; on a d'ailleurs observé ce même type de re-colonisation de fougères après l'éruption du mont Saint Helens en 1980[45].
En raison de la destruction en masse des plantes à la limite K-T, il y a eu prolifération des organismes détritivores comme les mycètes qui n'ont pas besoin de photosynthèse et utilisent les nutriments de la végétation en décomposition. La domination des espèces fongiques a duré seulement quelques années tandis que l'atmosphère se dégageait et qu'il y avait abondance de matière organique. Une fois l'atmosphère dégagée, les organismes photosynthétiques comme les fougères et d'autres plantes sont revenues[46]. La polyploïdie semble avoir augmenté la capacité des plantes à fleur à survivre à l'extinction, probablement parce que les copies additionnelles du génome que ces plantes possédaient leur ont permis de s'adapter plus facilement aux conditions environnementales en pleine mutation qui ont suivi l'impact[47].
Amphibiens
Il n'y a aucune trace d'extinctions de masse d'amphibiens à la limite K-T, et il y a une preuve irréfutable que la plupart des amphibiens ont survécu à l'évènement relativement indemnes[8]. Plusieurs études approfondies des genres de salamandres dans les lits fossiles du Montana montrent que sur sept genres, six étaient inchangés après l'évènement[48].
Les espèces de grenouilles semblent avoir survécu jusqu'au paléocène avec peu d'extinction d'espèces. Cependant, les fossiles pour des familles et des genres de grenouille sont irréguliers[8]. Une étude approfondie de trois genres des grenouilles du Montana montrent qu'elles n'étaient pas changées par l'évènement de K-T et qu'elles ont survécu apparemment sans changement[48]. Les données montrent peu ou pas d'évidence d'extinction de familles amphibies qui encadrent l'évènement de K-T. La survie amphibie a résulté de la capacité du clade à se chercher un l'abri dans l'eau ou à construire des terriers en sédiments, sol, bois, ou sous des roches[39].
Reptiles non-archosaures
Les deux taxa de reptiles non-archosaures vivants, les testudines (tortues) et lépidosauriens (serpents, lézards, et lézard verts), ainsi que les choristodères (des archosauromorphes semi-aquatiques qui se sont éteints au début du miocène) ont survécu au passage de la limite K-T[8]. Plus de 80 % des espèces de tortues du crétacé ont traversé la limite K-T. De plus, les six familles de tortues qui existaient à la fin du crétacé ont survécu au tertiaire et sont représentées par des espèces actuelles[49].
Les lépidosauriens vivants incluent les rhynchocéphales et les squamates. Les Rhynchocephalia, qui regroupe aujourd'hui les seuls Tuataras, étaient un groupe répandu et relativement prospère de lépidosauriens au début du mésozoïque, mais qui ont commencé à diminuer à partir du mi-Crétacé. Ils sont représentés aujourd'hui par un genre unique localisé exclusivement en Nouvelle Zélande[50].
L'ordre des squamates, qui est représenté aujourd'hui par les lézards, les serpents et les amphisbènes, a rayonné dans diverses niches écologiques pendant le jurassique et a réussi à passer au travers du crétacé. Ils ont survécu au passage de la limite K-T et sont actuellement le groupe le plus prospère et le plus diversifié de reptiles vivants avec plus de 6 000 espèces existantes. Aucune famille connue des squamates terrestres ne s'est éteinte à la limite, et les fossiles indiquent qu'ils n'ont souffert d'aucun déclin significatif dans leurs effectifs. Leur petite taille, leur métabolisme adaptable, et leur capacité à changer d'habitat pour trouver des conditions plus favorables ont été des facteurs clefs dans leur survie pendant la fin du crétacé et le début du paléocène[8],[49].
Les reptiles marins non-archosaurien comprenant les mosasaures et les plésiosaures, les reptiles aquatiques géants qui étaient les prédateurs marins supérieurs, se sont éteints vers la fin du crétacé.
Archosaures
Le clade des archosauriens inclut deux ordres vivants, les crocodiliens (dont les Alligatoridae, les Crocodylidae et les Gavialidae sont les seules familles survivantes) et les dinosauriens (dont les oiseaux sont les uniques membres survivants, alors que les dinosaures non-aviaires et les ptérosaures sont éteints).
Crocodiliens
Dix familles des crocodiliens ou de leurs proches parents sont déjà représentées dans les fossiles du Maastrichtien. Alors que cinq se sont éteintes avant la limite K-T[51], cinq autres familles ont des représentants fossiles jusqu'au Paléocène.
Toutes les familles de crocodiliens survivantes habitaient des environnements d'eau douce et terrestres, excepté les Dyrosauridae à la fois marins et dulçaquicole. La seule tendance apparente étant qu'aucun des grands crocodiles, tel que le crocodile nord-américain géant Deinosuchus, ne survécurent[8]. La survie des crocodiliens à ces événements a pu simplement résulter de la persistance de leur niche aquatique et de leur capacité à creuser, qui a réduit leur susceptibilité aux effets négatifs sur l'environnement de la limite K-T[39].
En 2008, Stéphane Jouve et ses collègues ont suggéré que les juvéniles de Dyrosauridae auraient vécu dans l'eau douce comme les juvéniles des crocodiles marins modernes, ce qui les aurait aidés à survivre là où d'autres reptiles marins se sont éteints ; les environnements d'eau douce n'ayant pas été pas aussi fortement affectés par des évènements de K-T que les environnements marins[52].
Ptérosauriens
La seule famille de ptérosauriens dont la présence au Maastrichtien est certaine, les Azhdarchidae, s'est éteinte à la limite K-T. Ces grands ptérosauriens étaient les derniers représentants d'un groupe en déclin qui comprenait dix familles durant le Crétacé moyen. Les ptérosauriens de plus petite taille s'étaient éteints avant le Maastrichtien au cours d'une période qui avait vu le déclin des espèces animales de petite taille au profit des espèces de grande taille. Simultanément, les oiseaux modernes avaient connu une forte diversification et avaient remplacé des oiseaux archaïques et des groupes de ptérosauriens, probablement en raison de la concurrence directe, ou simplement en remplissant des niches vides[39],[53],[54].
Dinosaures aviaires (Oiseaux)
Article détaillé : histoire évolutive des oiseaux.La plupart des paléontologues considèrent les oiseaux comme les seuls survivants des dinosaures. Cependant, tous les oiseaux non-Néornithes se sont éteints, y compris des groupes florissants comme les enantiornithines et les hesperornithiforms[55]. Plusieurs analyses de fossiles d'oiseaux montrent une divergence d'espèces avant la limite K-T, et que des parents du canard, du poulet et des autruches ont coexisté avec les dinosaures non-aviaires[56]. Les oiseaux Néornithes ont survécu à la limite K-T peut-être en raison de leurs capacités de plonger, nager, ou chercher un abri dans l'eau et les marécages. Beaucoup d'espèces d'oiseaux peuvent construire les terriers, ou des nids dans les trous d'arbre ou les Modèle:Termitières, ce qui les a mis à l'abri des effets sur l'environnement à la limite K-T. La survie à long terme après la limite a été garantie par la possibilité de remplir les nombreuses niches écologiques laissées vides par l'extinction des dinosaures non-aviaires[39].
Dinosaures non aviaires
 Tyrannosaurus était l'un des derniers dinosaures à prospérer sur terre avant l'extinction.
Tyrannosaurus était l'un des derniers dinosaures à prospérer sur terre avant l'extinction.
L'extinction des dinosaures au passage de la limite K-T a donné lieu à plus de publications que n'importe quel autre groupe d'organismes. À l'exception de quelques revendications controversées, on convient que tous les dinosaures non-aviaires se sont éteints à la limite K-T. Les fossiles de dinosaures ont été interprétés à la fois pour montrer un déclin dans la diversité et aucun déclin dans la diversité pendant les derniers millions d'années du crétacé, et il se peut que la qualité des fossiles de dinosaures ne soit simplement pas assez bonne pour permettre à des chercheurs de distinguer les choix[57]. Puisqu'il n'y a aucune preuve que les dinosaures non-aviaires de la fin du Maastrichtien aient pu creuser, nager ou plonger, ils ne pouvaient pas s'abriter pendant les plus mauvais moments du stress environnemental qui se sont produits à la limite K-T. Il est possible que les petits dinosaures (autre que des oiseaux) aient survécu, mais ils auraient été privés de nourriture car des dinosaures herbivores auraient trouvé la matière végétale rare, et les carnivores se seraient rapidement trouvés à court de proies[39]. Le consensus croissant au sujet du caractère endotherme des dinosaures (voir Physiologie des dinosaures) aide à comprendre leur extinction complète par rapport à la survie de leurs parents proches, les crocodiliens. Les crocodiles étant ectothermes (animaux à « sang froid »), ils ont des besoins très limités en nourriture (ils peuvent survivre à plusieurs mois sans manger) tandis que des animaux de la taille semblable mais endothermes (à « sang chaud ») ont besoin de beaucoup plus de nourriture afin de soutenir leur métabolisme plus rapide. Ainsi, dans les circonstances de la rupture de chaine alimentaire précédemment mentionnées, les dinosaures non-aviaires sont morts[58] tandis que certains crocodiles survivaient. Dans ce contexte, la survie d'autres animaux endothermiques, tels que quelques oiseaux et mammifères, a pu être due, entre d'autres raisons, à leurs plus petits besoins de nourriture, liés à leur petite taille à l'époque de l'extinction[59].
Plusieurs chercheurs ont mentionné que l'extinction des dinosaures avait été progressive, de sorte qu'il y aurait eu des dinosaures au Paléocène (en). Ces arguments sont fondés sur la découverte de restes de dinosaures dans la Formation de Hell Creek jusqu'à 1,3 mètres (4,27 pi) au-dessus et 40 000 années après la limite K-T[4]. Des échantillons de pollen prélevés près d'un fémur fossilisé d'hadrosaure découvert dans du grès à Ojo Alamo près du fleuve de San Juan indiquent que l'animal a vécu pendant le tertiaire, approximativement 64,5 MA (environ 1 million d'années après l'évènement de K-T). Si leur existence après la limite K-T peut être confirmée, ces hadrosaures seraient considérés comme un clade « mort-vivant ». La recherche actuelle indique que ces fossiles ont été érodés de leurs endroits originaux et puis ré-ensevelis par des sédiments très postérieurs (retouchés)[6].
Mammifères
Les groupes de mammifères existants aujourd'hui étaient déjà présents au Crétacé, qu'il s'agisse des monotrèmes qui pondent des œufs, des marsupiaux ou des placentaires, mais aussi d'autres groupes disparus comme les multituberculés, Dryolestoidea (en)[60], et les Gondwanatheria[61]. Tous ont survécu à l'évènement de K-T, bien qu'ils aient enregistré des pertes. Beaucoup de marsupiaux ont disparu, en particulier ceux d'Amérique du Nord et plus particulièrement encore les espèces asiatiques regroupées dans le taxon des deltatheroïdes (en)[62]. Dans les gisements de fossiles de la formation de Hell Creek, au-dessus de la limite K/T, on ne trouve plus de trace d'au moins la moitié des dix espèces de multituberculés ni d'aucune espèce marsupiale parmi les onze présentes avant la limite[57].
Les espèces de mammifères ont commencé à se diversifier approximativement 30 millions d'années avant la limite du Crétacé et du Tertiaire. Une radiation évolutive de mammifères s'est produite dans les quelques millions d'années qui ont suivi[63]. La recherche actuelle indique que les mammifères n'ont pas eu d'explosion de diversification au passage de la limite K-T, en dépit des niches écologiques libérées par l'extinction des dinosaures[64]. Plusieurs ordres de mammifères ont été interprétés comme se diversifiant juste après la limite K-T, comme les Chiroptera (chauves-souris) et les Cetartiodactyla (un groupe divers qui inclut aujourd'hui les baleines et dauphins et les Artiodactyla)[64], mais des recherches plus récentes concluent que seuls les ordres de marsupiaux se sont diversifiés directement après la limite K-T[63].
Les espèces mammifères qui existaient à la limite K-T étaient généralement petites, de taille comparable aux rats ; cette petite taille les aurait aidées à trouver des abris dans des environnements protégés. En outre, on postule que quelques monotrèmes, marsupiaux, et placentaires primitifs étaient semi-aquatiques ou fouisseurs, car il existe encore de nombreuses lignées de mammifères ayant conservé de tels comportements aujourd'hui. Enfin, n'importe quel mammifère semi-aquatique ou creusant des terriers aurait eu la protection additionnelle contre le stress environnemental de la limite K-T[39].
Données paléontologiques
Fossiles nord-américains
Dans les dépôts géologiques d'Amérique du Nord, l'évènement d'extinction est particulièrement bien représenté par la différence marquée entre le palynomorphe riche et relativement abondant du Maastrichtien supérieur par rapport à l'abondance de fougères succédant à la limite[42].
Dans l'état actuel des découvertes, les gisements de fossiles de dinosaures les plus instructifs sur la limite K-T se trouvent à l'ouest de l'Amérique du Nord, en particulier la Formation de Hell Creek dans le Montana, États-Unis qui date du Maastrichtien supérieur. En comparant cette formation avec la Formation de Judith River, Montana et Formation de Dinosaur Park en Alberta (Canada) qui sont plus anciennes d'environ 75 Ma, on obtient des informations sur les changements dans les populations de dinosaures au cours des 10 derniers millions d'années du Crétacé. Ces gisements de fossiles sont géographiquement limités, couvrant seulement une partie d'un continent[57].
Les formations du Campanien moyen présentent une diversité de dinosaures plus grande que n'importe quel autre couche de roches. Les roches du Maastrichtien supérieur contiennent les plus grands membres de plusieurs clades importants : Tyrannosaurus, Ankylosaurus, Pachycephalosaurus, Triceratops et Torosaurus[65], ce qui suggère que la nourriture était abondante immédiatement avant l'extinction.
Ces gisements sont non seulement riches en fossiles de dinosaures, mais comprennent également des fossiles de plantes qui illustrent la réduction du nombre d'espèces de plantes au passage de la limite K-T. Dans les sédiments au-dessous de la limite K-T les grains de pollen angiosperme dominent, alors que la couche correspondant à la limite contient peu de pollen et est dominée par des spores de fougères[66]. Les niveaux normaux de pollen reprennent graduellement au-dessus de la couche limite. Cela rappelle les secteurs touchés par des éruptions volcaniques, où le rétablissement est mené par les fougères qui plus tard sont remplacées par de grandes quantités d'angiospermes[67].
Fossiles marins
L'extinction de masse du plancton marin semble avoir été brusque et correspondre exactement à la limite K-T[68]. Les genres d'Ammonites se sont éteints exactement à la limite K-T ou juste après ; il faut cependant noter qu'une décroissance plus modérée et plus lente des genres d'ammonites avait commencé avant la limite en raison d'une régression des espèces marines au Crétacé supérieur. L'extinction progressive de la plupart des bivalves inocérames avait commencé bien avant la limite K-T, et une réduction légère et progressive de la diversité d'ammonite s'est produite à la fin du Crétacé supérieur[69]. Des analyses plus approfondies mettent en évidence que plusieurs processus étaient en cours dans les océans à la fin du Crétacé, certains se chevauchaient en partie dans le temps, puis ils se sont terminés brusquement avec l'extinction de masse[69].
Durée
La durée de l'extinction fait l'objet de controverses, parce que certaines théories de la cause de l'extinction exigent une extinction rapide sur une période relativement courte (de quelques années à quelques milliers d'années) tandis que d'autres nécessitent de plus longues périodes. Le problème est difficile à résoudre en raison de l'effet Signor-Lipps (en) ; c'est-à-dire que les données fossiles ne sont que très partielles ce qui fait que la plupart des espèces qui se sont éteintes ne se sont probablement réellement éteintes que longtemps après le fossile le plus récent qui a été trouvé[70]. De plus, les scientifiques n'ont trouvé que très peu de gisements de fossiles couvrant de manière continue un intervalle de temps s'étalant de plusieurs millions d'années avant l'extinction de K-T à quelques millions d'années après[8].
Théories
Plusieurs théories expliquent la limite K-T et les causes de l'extinction massive. À la base de ces théories on trouve des impacts de météorites ou un volcanisme accru ; certaines théories intègrent les deux éléments. On a aussi proposé un scénario combinant trois causes : le volcanisme, la régression marine, et un impact cosmique. Dans ce dernier scénario, les communautés terrestres et marines auraient été perturbées par les changements dans leurs écosystèmes et par des pertes d'habitats. Les dinosaures, ainsi que les plus grands vertébrés, auraient été les premiers affectés par les changements environnementaux, en conséquence leur diversité aurait diminué. En même temps, des particules en suspension provenant du volcanisme auraient refroidi et asséché certains secteurs du globe. Puis, un impact cosmique se serait produit, ce qui aurait causé un effondrement des chaines alimentaires fondées sur la photosynthèse, affectant à la fois les chaines alimentaires terrestres déjà perturbées et les chaines alimentaires marines. La différence principale entre cette théorie et les théories reposant sur une cause unique est que ses partisans pensent qu'aucune des causes uniques ne soit suffisante pour expliquer l'ampleur des extinctions ni pour produire le modèles taxonomiques de l'extinction[57].
Impact cosmique
Article détaillé : Cratère de Chicxulub.À la fin des années 1970, l'exploration de certaines couches géologiques a révélé une couche d'argile de quelques centimètres d'épaisseur entre les strates du Crétacé et du Tertiaire. On parle d'elle sous le nom de limite Crétacé-Tertiaire, de limite CT ou de limite K-T. Cette limite géologique, bien visible en certains points du globe, présente un taux anormal d'iridium (30 fois et 130 fois plus élevé que la normale dans les deux sections étudiées à l'origine). L'iridium est extrêmement rare dans la croûte terrestre parce que c'est un élément sidérophile, ce qui signifie qu'il a migré avec le fer pendant la différenciation planétaire et se trouve donc principalement dans le noyau. Cet élément est donc rare sur Terre mais abondant dans certaines météorites. En 1980, un groupe de scientifiques composé du prix Nobel de physique Luis Alvarez, de son fils le géologue Walter Alvarez, et des chimistes Frank Asaro et Helen Michel a alors émis l'hypothèse de la chute d'une météorite à cette période[71],[72]. L'hypothèse d'un impact cosmique avait été publié auparavant, mais l'hypothèse ne s'appuyait pas sur des découvertes concrètes[73].
La conséquence d'un tel impact aurait été un nuage de poussière qui aurait bloqué la lumière du Soleil sur une majeure partie de la Terre pour une année ou moins, et une augmentation des aérosols soufrés dans la stratosphère, menant à une réduction de 10-20 % du rayonnement solaire atteignant la surface de la Terre empêchant ainsi la photosynthèse. Cela aurait pris au moins 10 ans pour que ces aérosols se soient déposés, expliquant donc l'extinction des plantes, du phytoplancton, et des organismes dépendant de ces derniers (comprenant les prédateurs aussi bien que les herbivores). Les petites créatures ayant un régime alimentaire à base de détritus ont eu de meilleures chances de survie[59],[68]. Les conséquences de la ré-entrée des éjectas dans l'atmosphère terrestre aurait causé une brève (quelques heures) mais intense augmentation du rayonnement infrarouge, tuant les organismes y étant exposés[39]. Des tempêtes de feu globales ont pu résulter de l'augmentation de chaleur et de la chute sur Terre de fragments incendiaires provenant de l'explosion. Les niveaux élevés d'oxygène pendant le Crétacé supérieur auraient maintenu une combustion intense. Le niveau de l'oxygène atmosphérique est descendu au début de la période tertiaire. Si des feux de grande ampleur se sont produits, ils ont augmenté la teneur en CO2 de l'atmosphère et ont causé un effet de serre temporaire une fois que le nuage de poussière s'était résorbé, et ceci aurait exterminé les organismes les plus vulnérables qui avaient survécu à la période juste après l'impact[74].
L'impact a pu également avoir produit des pluies acides, selon quel type de roche sur lequel l'astéroïde a frappé. Cependant, la recherche récente suggère que cet effet aurait été relativement mineur, ne durant qu'approximativement 12 ans[68]. L'acidité était neutralisée par l'environnement, et la survie des animaux vulnérables aux effets des pluies acides (comme les grenouilles) indiquent que cet effet n'a pas contribué de façon importante à l'extinction. Les théories d'un impact cosmique peuvent seulement expliquer des extinctions très rapides, puisque les nuages de poussière et les aérosols sulfurés potentiels seraient éliminés de l'atmosphère dans un temps assez court (moins de 10 ans)[75].
Des recherches ultérieures ont identifié le cratère de Chicxulub enterré sous Chicxulub sur la côte du Yucatán, au Mexique comme cratère d'impact qui était concordant avec la datation de l'hypothèse d'Alvarez. Identifié en 1990 à la suite du travail de Glen Penfield effectué en 1978, ce cratère est ovale, avec un diamètre moyen d'environ 180 kilomètres (112 mi), soit une taille proche de celle calculée par l'équipe d'Alvarez[76]. La forme et la localisation du cratère indiquent d'autres causes de dévastation en plus du nuage de poussière. L'astéroïde a atterri dans l'océan ce qui aurait causé des tsunamis, dont les traces ont été trouvées dans plusieurs endroits dans les Caraïbes et à l'est des États-Unis – du sable marin en des endroits qui n'étaient alors pas côtiers, et des débris de végétation et des roches terrestres dans des sédiments marins datant de la période de l'impact. L'astéroïde a atterri dans un lit de gypse (sulfate de calcium), ce qui aurait produit un dégagement d'anhydride sulfureux sous forme d'aérosols. Cela aurait réduit encore plus l'intensité lumineuse du Soleil à la surface de la Terre puis aurait provoqué des pluies acides, tuant la végétation, le plancton et les organismes qui possèdent des coquilles de carbonate de calcium (les coccolithophoridés et les mollusques). En février 2008, une équipe de chercheurs a utilisé des images séismiques du cratère pour déterminer que le projectile a atteint l'eau plus profondément que ce que l'on avait supposé précédemment. Ceci aurait eu comme conséquence que les aérosols dans l'atmosphère auraient été plus riches en sulfates, augmentant la mortalité de l'impact par des changements de climat et des pluies acides[77].
La plupart des paléontologistes s'accordent maintenant pour dire qu'un astéroïde a frappé la Terre il y a 65 Ma, mais il n'y a pas de consensus sur le fait que l'impact soit ou non la cause unique des extinctions[25],[78]. On a montré qu'il y a un intervalle d'environ de 300 000 entre l'impact et l'extinction de masse[79]. En 1997, le paléontologue Sankar Chatterjee a attiré l'attention sur le cratère de Shiva (en) qui est beaucoup plus grand, 600 kilomètres (373 mi), et a émis l'hypothèse d'un scénario d'impacts multiples.
En 2007, des chercheurs ont émis l'hypothèse que le projectile qui a tué les dinosaures il y a 65 Ma appartenait à la famille d'astéroïdes de Baptistina[80]. Le lien entre les deux évènements avait été mis en doute, en partie parce qu'on possède très peu d'observations de l'astéroïde ou de la famille[81]. En effet, on a récemment découvert que 298 Baptistina ne partagent pas la même signature chimique que la source de l'impact du K-T[82]. Bien que ceci rende le lien entre le famille de Baptistina et le projectile de K-T plus difficile à justifier, il n'en exclut pas la possibilité[82].
Trapps du Deccan
Article principal : Trapps du Deccan.Des couches de lave gigantesques ont été retrouvées dans la région des Trapps du Deccan : il peut y avoir jusqu'à 2 400 mètres d'épaisseur de basalte, et la surface actuellement couverte dépasse les 500 000 km2 (à partir d'une surface originelle sans doute supérieure à 1 500 000 km2). Avant l'an 2000, l'argument qu'il y avait un lien avec l'extinction n'était évoqué que dans l'hypothèse d'une extinction progressive, car on pensait l'intense activité volcanique avait commencé autour de 68 Ma et avait duré plus de 2 millions d'années. Plus récemment, on a déterminé que les énormes éruptions volcaniques se produisirent sur une période de 800 000 ans comprenant la limite K-T, et pourraient donc être responsables de l'extinction et du rétablissement biotique ralenti qui a suivi[83].
Les Trapps du Deccan pourraient avoir causé l'extinction par plusieurs mécanismes, y compris le dégagement de poussières, de cendres et d'aérosols soufrés dans l'air qui pourraient avoir bloqué la lumière du Soleil et réduit ainsi la photosynthèse pour les plantes. En outre, le volcanisme des Trapps du Deccan pourrait avoir eu comme conséquence des émissions de gaz carbonique qui auraient augmenté l'effet de serre déjà produit par les poussières et les aérosols présents dans l'atmosphère[84].
Dans les années où l'hypothèse des Trapps de Deccan était liée à une extinction progressive, Luis Alvarez (qui est mort en 1988) a répondu que les paléontologues se trompaient car les gisements fossiles ne constituent qu'un échantillon biaisé. Bien que cette affirmation n'ait au départ pas bien été reçue, les études intensives sur le terrain des gisements fossiles effectuées par la suite ont donné le poids à ses arguments. Ultérieurement, la plupart des paléontologues ont commencé à accepter l'idée que les extinctions de masse à la fin du Crétacé aient été en grande partie ou au moins partiellement dues à un impact cosmique sur la Terre. Cependant, même Walter Alvarez a reconnu que d'autres changements importants sur Terre avaient eu lieu avant l'impact, tel qu'une baisse du niveau de la mer et les éruptions volcaniques massives qui ont produit les Trapps du Deccan en Inde, et ceux-ci avaient pu avoir contribué aux extinctions[85].
Impacts cosmiques multiples
Plusieurs autres cratères semblent s'être également formés au moment de la limite K-T. Ceci suggère la possibilité d'impacts multiples presque simultanés, peut-être provenant des fragments d'un unique objet cosmique, semblable à la collision de Comète Shoemaker-Levy 9 avec Jupiter. En plus du cratère de Chicxulub de 180 kilomètres (112 mi), il y a le cratère de Boltysh en Ukraine de 24 kilomètres (15 mi) daté à : (65.17 ± 0.64 Ma), le cratère de Silverpit de 20 kilomètres (12 mi)), un cratère d'impact suspecté dans la Mer du Nord daté à : (60-65 Ma), et le cratère de Shiva (en) et ses 600 kilomètres (373 mi) controversés. Les autres cratères qui pourraient s'être formés dans l'océan Téthys et avoir été effacés par des évènements tectoniques comme la dérive de l'Afrique et de l'Inde vers le nord[86],[87],[88].
Régression marine
Des indications claires montrent que le niveau des mers s'est abaissé à la fin du Crétacé plus qu'à n'importe quelle autre moment de l'ère mésozoïque. Dans certains étages stratigraphiques du Maastrichtien de diverses régions du monde, les plus récents sont terrestres ; on trouve ensuite des rivages et les étages les plus anciens correspondent à la mer. Ces couches ne montrent pas l'inclinaison et la déformation liées à la construction de montagne, donc, l'explication la plus probable est une régression, c'est-à-dire, une baisse du niveau de la mer. On n'a pas de preuve directe de la cause de cette régression, mais l'explication qui est actuellement acceptée comme la plus probable est que les rides médio-océanique sont devenues moins actives et sont donc descendues sous leur propre poids[8],[89].
Une régression sévère aurait considérablement réduit le plateau continental, qui est le secteur le plus riche en espèces marines, et pourrait donc avoir suffi pour causer une extinction de masse marine. Cependant les recherches concluent que ce changement aurait été insuffisant pour causer le niveau d'extinction observé chez les ammonites. La régression aurait également causé des changements climatiques, en partie en perturbant des vents et des courants océaniques et en partie en réduisant l'albédo de la Terre entrainant donc des températures globales croissantes[69].
La régression marine a également eu comme conséquence la perte des mers épicontinentales, telles que la voie maritime intérieure de l'Ouest de l'Amérique du Nord. La perte de ces mers a considérablement changé des habitats, détruisant la plaine côtière qui avait accueilli dix millions d'années plus tôt les communautés diverses qu'on trouve dans les roches de la Formation de Dinosaur Park. Une autre conséquence était une expansion des environnements d'eau douce, puisque l'écoulement continental avait de plus longues distances à parcourir avant d'atteindre les océans. Tandis que ce changement était favorable aux vertébrés d'eau douce, ceux qui préfèrent les environnements maritimes, tels que les requins, ont souffert[57].
Causes multiples
Dans une revue scientifique, J. David Archibald et David E. Fastovsky ont proposé un scénario combinant les trois causes : volcanisme, régression marine et impact cosmique. Dans ce scénario, les communautés terrestres et marines auraient été perturbées par les changements de leurs écosystèmes et par des pertes d'habitat. Les dinosaures, comme les plus grands vertébrés, auraient été les premiers affectés par les changements environnementaux, et leur diversité aurait diminué. En même temps, les particules causées par le volcanisme auraient refroidi et asséché certains secteurs du globe. Puis, un impact cosmique se serait produit, causant l'effondrement des chaines alimentaires fondées sur la photosynthèse, à la fois dans les chaines alimentaires terrestres déjà soumises à perturbations et dans les chaines alimentaires marines. La différence principale entre cette théorie et les théories mettant en avant une cause unique est que ses partisans pensent que les causes simples qui sont avancées soit n'avaient pas la force nécessaire pour causer les extinctions, soit n'étaient pas susceptibles de produire le profil taxonomique des extinctions[57]. La difficulté à trancher de façon définitive vient de l'impossibilité actuelle de définir un biotope sur quelques milliers ou même millions d'années de façon très précise. Seule cette précision permettrait de dire si les groupes d'espèces ont disparu en quelques jours (ce qui confirmerait définitivement la thèse de la météorite comme cause dominante), ou en quelques centaines de milliers d'années (ce qui ferait plutôt pencher pour les Trapps du Deccan, ou pour un mixte Deccan — régression marine et météorite).
Autres théories, plus anciennes
 Fossile de Tarbosaurus
Fossile de Tarbosaurus
- Dinosaures éliminés par la sélection naturelle ;
- Destruction des nids de dinosaures par des mammifères mangeurs d'œufs ;
- Épidémie fulgurante ;
- Intoxication des dinosaures par les alcaloïdes contenus dans de nouvelles lignées de plantes ;
- Inversion du champ magnétique de la Terre.
Ces théories (anciennes) sont aujourd'hui très minoritaires dans le monde scientifique, voire complètement abandonnées, car :
- Un groupe qui perdure pendant 155 millions d'années peut être considéré comme solidement adapté ; de plus, leur disparition aurait été beaucoup plus progressive.
- Il est peu vraisemblable que toute une classe d'espèces ait disparu relativement rapidement et à l'échelle terrestre suite à une prédation sur ses nids. D'autant plus que cette disparition de masse ne touche pas que les dinosaures.
- Pour l'épidémie, difficile qu'elle se soit propagée à l'échelle intercontinentale, touchant autant d'espèces différentes, y compris des animaux marins.
- Les dinosaures n'étaient pas tous végétariens. De plus, une telle disparition n'aurait pas été aussi rapide.
- Concernant l'inversion du champ magnétique terrestre, cela s'est produit maintes fois avant et après dans l'histoire géologique de la Terre, sans catastrophe de grande ampleur.
Autres extinctions de masse
Article détaillé : Extinction massive.L'extinction de masse de la fin du Crétacé n'est pas la seule enregistrée. Les scientifiques estiment en avoir repéré au moins cinq autres comme celle du Dévonien où 50 % des espèces disparurent et celle qui marque la fin du Permien où plus de 90% des espèces animales disparurent.
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Cretaceous–Tertiary extinction event » (voir la liste des auteurs)
- (en) Fortey R, Life: A Natural History of the First Four Billion Years of Life on Earth, Vintage, 1999, 238-260 p. (ISBN 0375702617)
- (en) F Gradstein, J Ogg et A Smith, A Geologic Time Scale 2004 (ISBN 0521781426) [lire en ligne]
- (en) Fastovsky, Sheehan P.M., « The extinction of the dinosaurs in North America », dans GSA today, vol. 15, no 3, 2005, p. 4-10 [texte intégral, lien DOI (pages consultées le 2007-05-18)]
- (en) Sloan RE, Rigby K, Van Valen LM, Gabriel Diane, « Gradual dinosaur extinction and simultaneous ungulate radiation in the Hell Creek formation », dans Science, vol. 232, no 4750, 1986, p. 629–633 [texte intégral, lien PMID, lien DOI (pages consultées le 2007-05-18)]
- (en) Fassett JE, Lucas SG, Zielinski RA, Budahn JR, « Compelling new evidence for Paleocene dinosaurs in the Ojo Alamo Sandstone San Juan Basin, New Mexico and Colorado, USA », dans International Conference on Catastrophic Events and Mass Extinctions: Impacts and Beyond, 9-12 July 2000, Vienna, Austria, vol. 1053, 2001, p. 45–46 [texte intégral [PDF] (page consultée le 2007-05-18)]
- (en) Sullivan RM, « No Paleocene dinosaurs in the San Juan Basin, New Mexico », dans Geological Society of America Abstracts with Programs, vol. 35, no 5, 2003, p. 15 [texte intégral (page consultée le 2007-07-02)]
- Laurent Sacco, « La première datation directe d'os de dinosaure » sur Futura_science.com, 31 janvier 2011
- (en) MacLeod N, Rawson PF, Forey PL, Banner FT, Boudagher-Fadel MK, Bown PR, Burnett JA, Chambers, P, Culver S, Evans SE, Jeffery C, Kaminski MA, Lord AR, Milner AC, Milner AR, Morris N, Owen E, Rosen BR, Smith AB, Taylor PD, Urquhart E, Young JR, « The Cretaceous–Tertiary biotic transition », dans Journal of the Geological Society, vol. 154, no 2, 1997, p. 265–292 [texte intégral, lien DOI]
- (en) Vincent Courtillot et Joe McClinton, Evolutionary Catastrophes: The Science of Mass Extinction, Cambridge University Press, 2002, 173 p. (ISBN 9780521891189) [lire en ligne], « An asteroid impact - A general conflagration », p. 43
- (en) Peter Schulte and al., « The Chicxulub Asteroid Impact and Mass Extinction at the Cretaceous-Paleogene Boundary », dans Science, vol. 327, no 5970, 5 mars 2010, p. 1214-1218 [lien DOI]
- (en) Wilf P, Johnson KR, « Land plant extinction at the end of the Cretaceous: a quantitative analysis of the North Dakota megafloral record », dans Paleobiology, vol. 30, no 3, 2004, p. 347–368 [lien DOI]
- (en) Kauffman E, « Mosasaur Predation on Upper Cretaceous Nautiloids and Ammonites from the United States Pacific Coast », dans PALAIOS, Society for Sedimentary Geology, vol. 19, no 1, 2004, p. 96–100 [texte intégral, lien DOI (pages consultées le 2007-06-17)]
- (en) Sheehan Peter M, Hansen Thor A, « Detritus feeding as a buffer to extinction at the end of the Cretaceous », dans Geology, vol. 14, no 10, 1986, p. 868–870 [texte intégral, lien DOI (pages consultées le 2007-07-04)]
- (en) Aberhan M, Weidemeyer S, Kieesling W, Scasso RA, Medina FA, « Faunal evidence for reduced productivity and uncoordinated recovery in Southern Hemisphere Cretaceous-Paleogene boundary sections », dans Geology, vol. 35, no 3, 2007, p. 227–230 [lien DOI]
- (en) Sheehan Peter M, Fastovsky DE, « Major extinctions of land-dwelling vertebrates at the Cretaceous–Tertiary boundary, eastern Montana », dans Geology, vol. 20, no 6, 1992, p. 556–560 [texte intégral, lien DOI (pages consultées le 2007-06-22)]
- (en) Pospichal JJ, « Calcareous nannofossils and clastic sediments at the Cretaceous–Tertiary boundary, northeastern Mexico », dans Geology, vol. 24, no 3, 1996, p. 255–258 [texte intégral, lien DOI]
- (en) Bown P, « Selective calcareous nannoplankton survivorship at the Cretaceous–Tertiary boundary », dans Geology, vol. 33, no 8, 2005, p. 653–656 [texte intégral, lien DOI]
- (en) Bambach RK, Knoll AH, Wang SC, « Origination, extinction, and mass depletions of marine diversity », dans Paleobiology, vol. 30, no 4, 2004, p. 522–542 [texte intégral, lien DOI]
- (en) Gedl P, « Dinoflagellate cyst record of the deep-sea Cretaceous-Tertiary boundary at Uzgru, Carpathian Mountains, Czech Republic », dans Geological Society, London, Special Publications, vol. 230, 2004, p. 257–273 [lien DOI]
- (en) MacLeod N, « Impacts and marine invertebrate extinctions », dans Geological Society, London, Special Publications, vol. 140, 1998, p. 217–246 [texte intégral, lien DOI]
- (en) Courtillot V, Evolutionary Catastrophes: The Science of Mass Extinction, Cambridge University Press, 1999, 2 p. (ISBN 0521583926) [lire en ligne]
- (de) Glaessner MF, « Studien Ober Foraminiferen aus der Kreide und dem Tertiar des Kaukasus. I-Die Foraminiferen der altesten Tertifrschichten des Nordwestkaukasus », dans Problems in Paleontology, vol. 2–3, 1937, p. 349–410
- (en) Arenillas I, Arz JA, Molina E & Dupuis C, « An Independent Test of Planktic Foraminiferal Turnover across the Cretaceous/Paleogene (K/P) Boundary at El Kef, Tunisia: Catastrophic Mass Extinction and Possible Survivorship », dans Micropaleontology, vol. 46, no 1, 2000, p. 31–49
- (en) MacLeod N, Nature of the Cretaceous-Tertiary (K–T) planktonic foraminiferal record: stratigraphic confidence intervals, Signor-Lipps effect, and patterns of survivorship. In: Cretaceous–Tertiary Mass Extinctions: Biotic and Environmental Changes (MacLeod N, Keller G, editors), WW Norton, 1996, 85–138 p. (ISBN 0393966572)
- (en) Keller G, Adatte T, Stinnesbeck W, Rebolledo-Vieyra, Fucugauchi JU, Kramar U, Stüben D, « Chicxulub impact predates the K–T boundary mass extinction », dans PNAS, vol. 101, no 11, 2004, p. 3753–3758 [lien PMID, lien DOI]
- (en) Galeotti S, Bellagamba M, Kaminski MA, & Montanari A, « Deep-sea benthic foraminiferal recolonisation following a volcaniclastic event in the lower Campanian of the Scaglia Rossa Formation (Umbria-Marche Basin, central Italy) », dans Marine Micropaleontology, vol. 44, 2002, p. 57–76 [texte intégral [PDF] (page consultée le 2007-08-19)]
- (en) Kuhnt W, Collins ES, « 8. Cretaceous to Paleogene benthic foramanifers from the Iberia abyssal plain », dans Proceedings of the Ocean Drilling Program, Scientific Results, vol. 149, 1996, p. 203–216 [texte intégral [PDF] (page consultée le 2007-08-19)]
- (en) Coles GP, Ayress MA, and Whatley RC, A comparison of North Atlantic and 20 Pacific deep-sea Ostracoda in Ostracoda and global events (RC Whatley and C Maybury, editors), Chapman & Hall, 1990 (ISBN 0442311674), p. 287–305
- (en) Brouwers EM, De Deckker P, « Late Maastrichtian and Danian Ostracode Faunas from Northern Alaska: Reconstructions of Environment and Paleogeography », dans PALAIOS, vol. 8, no 2, 1993, p. 140–154 [lien DOI]
- (en) Vescsei A, Moussavian E, « Paleocene reefs on the Maiella Platform Margin, Italy: An example of the effects of the cretaceous/tertiary boundary events on reefs and carbonate platforms », dans Facies, vol. 36, no 1, 1997, p. 123–139 [lien DOI]
- (en) Rosen BR, Turnsek D, « Extinction patterns and biogeography of scleractinian corals across the Cretaceous/Tertiary boundary. Fossil Cnidaria 5.P. », dans Association of Australasian Paleontology Memoir Number 8, Jell A, Pickett JW (eds), 1989, p. 355–370
- (en) Ward PD, Kennedy WJ, MacLeod KG, Mount JF, « Ammonite and inoceramid bivalve extinction patterns in Cretaceous/Tertiary boundary sections of the Biscay region (southwestern France, northern Spain) », dans Geology, vol. 19, no 12, 1991, p. 1181–1184 [texte intégral, lien DOI]
- (en) Harries PJ, Johnson KR, Cobban WA, Nichols DJ, « Marine Cretaceous-Tertiary boundary section in southwestern South Dakota: Comment and Reply », dans Geology, vol. 30, no 10, 2002, p. 954–955 [lien DOI]
- (en) Neraudeau D, Thierry J, Moreau P, « Variation in echinoid biodiversity during the Cenomanian–early Turonian transgressive episode in Charentes (France) », dans Bulletin de la Société géologique de France, vol. 168, 1997, p. 51–61
- (en) Raup DM and Jablonski D, « Geography of end-Cretaceous marine bivalve extinctions », dans Science, vol. 260, no 5110, 1993, p. 971–973 [lien PMID, lien DOI]
- (en) MacLeod KG, « Extinction of Inoceramid Bivalves in Maastrichtian Strata of the Bay of Biscay Region of France and Spain », dans Journal of Paleontology, vol. 68, no 5, 1994, p. 1048–1066
- (en) Patterson C, Osteichthyes: Teleostei. In: The Fossil Record 2 (Benton, MJ, editor), Springer, 1993, 621–656 p. (ISBN 0412393808)
- (en) Zinsmeister WJ, « Discovery of fish mortality horizon at the K–T boundary on Seymour Island: Re-evaluation of events at the end of the Cretaceous », dans Journal of Paleontology, vol. 72, no 3, mai 1998, p. 556–571 [texte intégral (page consultée le 2007-08-27)]
- (en) Robertson DS, McKenna MC, Toon OB, Hope S, Lillegraven JA, « Survival in the first hours of the Cenozoic », dans GSA Bulletin, vol. 116, no 5–6, 2004, p. 760–768 [texte intégral [PDF], lien DOI (pages consultées le 2007-08-31)]
- (en) Labandeira Conrad C, Johnson Kirk R, Wilf Peter, « Impact of the terminal Cretaceous event on plant–insect associations », dans Proceedings of the National Academy of Sciences of the United States of America, vol. 99, no 4, 2002, p. 2061–2066 [texte intégral [PDF], lien PMID, lien DOI]
- (en) Wilf P, Labandeira CC, Johnson KR, Ellis B, « Decoupled Plant and Insect Diversity After the End-Cretaceous Extinction », dans Science, vol. 313, no 5790, 2006, p. 1112–1115 [lien PMID, lien DOI]
- (en) Vajda Vivi, Raine J Ian, Hollis Christopher J, « Indication of Global Deforestation at the Cretaceous–Tertiary Boundary by New Zealand Fern Spike », dans Science, vol. 294, no 5547, 2001, p. 1700–1702 [texte intégral, lien PMID, lien DOI]
- Johnson KR, Hickey LJ, Megafloral change across the Cretaceous Tertiary boundary in the northern Great Plains and Rocky Mountains. In: Global Catastrophes in Earth History: An Interdisciplinary Conference on Impacts, Volcanism, and Mass Mortality, Sharpton VI and Ward PD (editors), Geological Society of America, 1991 (ISBN 0813722474)
- (en) Askin RA, Jacobson SR, Palynological change across the Cretaceous–Tertiary boundary on Seymour Island, Antarctica: environmental and depositional factors. In: Cretaceous–Tertiary Mass Extinctions: Biotic and Environmental Changes, Keller G, MacLeod N (editors), WW Norton, 1996 (ISBN 0393966572)
- (en) Schultz PH, D'Hondt S, « Cretaceous–Tertiary (Chicxulub) impact angle and its consequences », dans Geology, vol. 24, no 11, 1996, p. 963–967 [texte intégral, lien DOI (pages consultées le 5 juillet 2007)]
- (en) Vajda V, McLoughlin S, « Fungal Proliferation at the Cretaceous–Tertiary Boundary », dans Science, vol. 303, no 5663, 2004, p. 1489–1490 [texte intégral [PDF], lien PMID, lien DOI (pages consultées le 2007-07-07)]
- Jeffrey A. Fawcett, Steven Maere et Yves Van de Peer, « Plants with double genomes might have had a better chance to survive the Cretaceous–Tertiary extinction event », dans Proceedings of the National Academy of Sciences, vol. 106, no 14, 2009, p. 5737-5742 [lien DOI (page consultée le 17 janvier 2010)]
- (en) Archibald JD, Bryant LJ, « Differential Cretaceous–Tertiary extinction of nonmarine vertebrates; evidence from northeastern Montana. In: Global Catastrophes in Earth History: an Interdisciplinary Conference on Impacts, Volcanism, and Mass Mortality (Sharpton VL and Ward PD, editors) », dans Geological Society of America, Special Paper, vol. 247, 1990, p. 549–562
- (en) Novacek MJ, « 100 Million Years of Land Vertebrate Evolution: The Cretaceous-Early Tertiary Transition », dans Annals of the Missouri Botanical Garden, vol. 86, 1999, p. 230–258 [lien DOI]
- (en) Lutz D, Tuatara: A Living Fossil, DIMI Press, 2005 (ISBN 0-931625-43-2)
- (en) Brochu CA, « Calibration age and quartet divergence date estimation », dans Evolution, vol. 58, no 6, 2004, p. 1375–1382 [lien PMID, lien DOI]
- (en) Stéphane Jouve, Nathalie Bardet, Nour-Eddine Jalil, Xabier Pereda Suberbiola, Baâdi Bouya et Mbarek Amaghzaz, « The oldest African crocodylian: phylogeny, paleobiogeography, and differential survivorship of marine reptiles through the Cretaceous-Tertiary Boundary », dans Journal of Vertebrate Paleontology, vol. 28, no 2, 2008, p. 409–421 [lien DOI]
- (en) Slack KE, Jones CM, Ando T, Harrison GL, Fordyce RE, Arnason U, Penny D, « Early Penguin Fossils, Plus Mitochondrial Genomes, Calibrate Avian Evolution », dans Molecular Biology and Evolution, vol. 23, no 6, 2006, p. 1144–1155 [texte intégral, lien PMID, lien DOI]
- (en) Penny D, Phillips MJ, « The rise of birds and mammals: are microevolutionary processes sufficient for macroevolution », dans Trends Ecol Evol, vol. 19, no 10, 2004, p. 516–522 [lien PMID, lien DOI]
- (en) Hou L, Martin M, Zhou Z, Feduccia A, « Early Adaptive Radiation of Birds: Evidence from Fossils from Northeastern China », dans Science, vol. 274, no 5290, 1996, p. 1164–1167 [lien PMID, lien DOI]
- (en) Clarke JA, Tambussi CP, Noriega JI, Erickson GM, Ketcham RA, « Definitive fossil evidence for the extant avian radiation in the Cretaceous », dans Nature, vol. 433, no 7023, 2005, p. 305–308 [lien PMID, lien DOI]
- (en) Archibald J David, Fastovsky David E, The Dinosauria, Berkeley, University of California Press, 2004 (ISBN 0-520-24209-2), p. 672–684
- (en) Wilf P, Johnson KR, « Land plant extinction at the end of the Cretaceous: a quantitative analysis of the North Dakota megafloral record », dans Paleobiology, vol. 30, no 3, 2004, p. 347–368 [lien DOI]
- (en) Ocampo A, Vajda V, Buffetaut E, Unravelling the Cretaceous–Paleogene (K–T) turnover, evidence from flora, fauna and geology in biological processes associated with impact events (Cockell C, Gilmour I, Koeberl C, editors), SpringerLink, 2006, 197–219 p. (ISBN 3-540-25735-6) [lire en ligne]
- (en) Gelfo JN & Pascual R, « Peligrotherium tropicalis (Mammalia, Dryolestida) from the early Paleocene of Patagonia, a survival from a Mesozoic Gondwanan radiation », dans Geodiversitas, vol. 23, 2001, p. 369–379
- (en) Goin FJ, Reguero MA, Pascual R, von Koenigswald W, Woodburne MO, Case JA, Marenssi SA, Vieytes C, Vizcaíno SF, « First gondwanatherian mammal from Antarctica », dans Geological Society, London, Special Publications, vol. 258, 2006, p. 135–144 [lien DOI]
- (en) McKenna MC, Bell SK, Classification of Mammals: Above the Species Level, Columbia University Press, 1997 (ISBN 978-0-231-11012-9)
- (en) Bininda-Emonds ORP, Cardillo M, Jones KE, MacPhee RDE, Beck RMD, Grenyer R, Price SA, Vos RA, Gittleman JLY, Purvis A, « The delayed rise of present-day mammals », dans Nature, vol. 446, no 7135, 2007, p. 507–512 [texte intégral [PDF], lien PMID, lien DOI]
- (en) Springer MS, Murphy WJ, Eizirik E, O'Brien SJ, « Placental mammal diversification and the Cretaceous–Tertiary boundary », dans PNAS, vol. 100, no 3, 2003, p. 1056–1061 [texte intégral [PDF], lien PMID, lien DOI]
- (en) Dodson Peter, The Horned Dinosaurs: A Natural History, Princeton, Princeton University Press, 1996, 279–281 p. (ISBN 0-691-05900-4)
- Online guide to the continental Cretaceous–Tertiary boundary in the Raton basin, Colorado and New Mexico, U.S. Geological Survey, 2004. Consulté le 8 juillet
- (en) Smathers GA, Mueller-Dombois D, Invasion and Recovery of Vegetation after a Volcanic Eruption in Hawaii, Scientific Monograph Number 5, United States National Park Service, 1974 [lire en ligne (page consultée le 2007-07-09)]
- (en) Pope KO, D'Hondt SL, Marshall CR, « Meteorite impact and the mass extinction of species at the Cretaceous/Tertiary boundary », dans PNAS, vol. 95, no 19, 1998, p. 11028–11029 [texte intégral, lien PMID, lien DOI]
- (en) Marshall CR, Ward PD, « Sudden and Gradual Molluscan Extinctions in the Latest Cretaceous of Western European Tethys », dans Science, vol. 274, no 5291, 1996, p. 1360–1363 [lien PMID, lien DOI]
- (en) Signor III PW, Lipps JH, « Sampling bias, gradual extinction patterns, and catastrophes in the fossil record. In: Geological implications of impacts of large asteroids and comets on the Earth, Silver LT, Schultz PH (editors) », dans Geological Society of America Special Publication, vol. 190, 1982, p. 291–296
- (en) Alvarez LW, Alvarez W, Asaro F, Michel HV, « Extraterrestrial cause for the Cretaceous–Tertiary extinction », dans Science, vol. 208, no 4448, 1980, p. 1095–1108 [lien PMID, lien DOI]
- Voir aussi Famille d'astéroïde Baptistina.
- (en) De Laubenfels MW, « Dinosaur extinction: One more hypothesis », dans Journal of Paleontology, vol. 30, no 1, 1956, p. 207–218 [texte intégral]
- (en) Pope KO, Baines KH, Ocampo AC, Ivanov BA, « Energy, volatile production, and climatic effects of the Chicxulub Cretaceous/Tertiary impact », dans Journal of Geophysical Research, vol. 102, no E9, 1997, p. 21645–21664 [texte intégral, lien PMID, lien DOI]
- (en) Kring DA, « Environmental consequences of impact cratering events as a function of ambient conditions on Earth », dans Astrobiology, vol. 3, no 1, 2003, p. 133–152 [lien PMID, lien DOI]
- (en) Pope KO, Ocampo AC, Kinsland GL, Smith R, « Surface expression of the Chicxulub crater », dans Geology, vol. 24, no 6, 1996, p. 527–530 [lien PMID, lien DOI]
- (en) Gulick, « Importance of pre-impact crustal structure for the asymmetry of the Chicxulub impact crater », dans Nature Geoscience, vol. 1, 2008, p. 131–135 [lien DOI]
- (en) Morgan J, Lana C, Kersley A, Coles B, Belcher C, Montanari S, Diaz-Martinez E, Barbosa A, Neumann V, « Analyses of shocked quartz at the global K-P boundary indicate an origin from a single, high-angle, oblique impact at Chicxulub », dans Earth and Planetary Science Letters, vol. 251, no 3–4, 2006, p. 264–279 [lien DOI]
- (en) Keller G, Abramovich S, Berner Z, Adatte T, « Biotic effects of the Chicxulub impact, K–T catastrophe and sea level change in Texas », dans Palaeogeography, Palaeoclimatology, Palaeoecology, vol. 271, no 1-2, janvier 2009, p. 52–68 [lien DOI]
- (en) W. Bottke, D. Vokrouhlický et D. Nesvorný, « An asteroid breakup 160 Myr ago as the probable source of the K/T impactor », dans Nature, vol. 449, 2007, p. 48-53 [texte intégral [PDF]]
- (en) D. Majaess, D. Higgins, L. Molnar, M. Haegert, D. Lane, D. Turner et I. Nielsen, « New Constraints on the Asteroid 298 Baptistina, the Alleged Family Member of the K/T Impactor », dans JRASC, 2008 [texte intégral]
- (en) Reddy V., et al. (2008). Composition of 298 Baptistina: Implications for K–T Impactor Link, Asteroids, Comets, Meteors conference.
- (en) Keller G, Adatte T, Gardin S, Bartolini A, Bajpai S, « Main Deccan volcanism phase ends near the K–T boundary: Evidence from the Krishna-Godavari Basin, SE India », dans Earth and Planetary Science Letters, vol. 268, 2008, p. 293–311 [lien DOI]
- (en) Duncan RA, Pyle DG, « Rapid eruption of the Deccan flood basalts at the Cretaceous/Tertiary boundary », dans Nature, vol. 333, 1988, p. 841–843 [lien DOI]
- (en) Alvarez W, T. rex and the Crater of Doom, Princeton University Press, 1997, 130–146 p. (ISBN 0691016306)
- Mullen L, « Debating the Dinosaur Extinction » sur http://www.astrobio.net, Astrobiology Magazine. Consulté le 2007-07-11
- Mullen L, « Multiple impacts » sur http://www.astrobio.net, Astrobiology Magazine. Consulté le 2007-07-11
- Mullen L, « Shiva: Another K–T impact? » sur http://www.astrobio.net, Astrobiology Magazine. Consulté le 2007-07-11
- (en) Liangquan L, Keller G, « Abrupt deep-sea warming at the end of the Cretaceous », dans Geology, vol. 26, 1998, p. 995–998 [texte intégral, lien DOI]
Annexes
Articles connexes
Liens externes
- Article fouillé sur la disparition des dinosaures dans Futura-Sciences
- La limite Crétacé/Tertiaire (KT) et l'extinction des dinosaures
- Portail des mammifères
- Portail de la paléontologie
- Portail de l’origine et de l’évolution du vivant
- Portail des dinosaures
Wikimedia Foundation. 2010.