- Acide de Meldrum
-
2,2-diméthyl-1,3-dioxane-4,6-dione 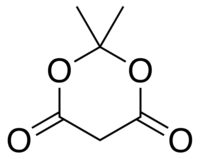
Général Nom IUPAC 2,2-diméthyl-1,3-dioxane-4,6-dione Synonymes acide de Meldrum No CAS No EINECS PubChem SMILES InChI Propriétés chimiques Formule brute C6H8O4 [Isomères] Masse molaire[1] 144,1253 ± 0,0066 g·mol-1
C 50 %, H 5,59 %, O 44,4 %,pKa 4,97 Propriétés physiques T° ébullition 94-95 °C(décomp.)[2] Précautions NFPA 704[3] Écotoxicologie DL50 180 mg·kg-1 (souris, i.v.) [4] Unités du SI & CNTP, sauf indication contraire. L'acide de Meldrum ou 2,2-diméthyl-1,3-dioxane-4,6-dione est un composé organique de formule brute C6H8O4. Ce composé a été préparé pour la première fois en 1908 par Andrew Norman Meldrum par une réaction de condensation de l'acide malonique et de l'acétone dans un mélange d'anhydride acétique et d'acide sulfurique[5]. Meldrum a mal identifié la structure de ce composé comme étant une béta-lactone avec un groupe carboxyle libre. La structure correcte a été décrite par David Davidson et al., en 1948[6].
Comme alternative à sa préparation originelle, l'acide de Meldrum peut être synthétisé avec de l'acide malonique, de l'acétate d'isopropényle et de l'acide sulfurique comme catalyseur. La 2,2-diméthyl-1,3-dioxane-4,6-dione est assez acide avec un pKa de 4,97. Cette acidité est si haute qu'elle a été considérée pendant longtemps comme une anomalie car elle est huit ordre de grandeur plus haute que celle du malonate de diméthyle, un composé très apparenté, dont le pKa dans l'eau est autour de 13. En 2004, Tomohiko Ohwada et al. ont résolu le mystère de cette acidité en effectuant de nombreux calculs[7]. Ohwada remarque que la structure issue d'une minimisation de l'énergie de conformation place les orbitales σCH des liaisons C-H (H en alpha des groupes carbonyle) dans la géométrie appropriée pour qu'elles s'alignent sur l'orbitale antiliante π * CO de sorte que l'état fondamental corresponde à une déstabilisation exceptionnellement forte des liaisons C-H.
Grâce à cette haute acidité, la 2,2-diméthyl-1,3-dioxane-4,6-dione, comme l'acide malonique, peut servir de réactif pour des condensations de Knoevenagel (en).
La 2,2-diméthyl-1,3-dioxane-4,6-dione est la base d'une synthèse générale des béta-cétoesters. La réaction de l'acide de Meldrum avec un chlorure d'acyle (chlorure d'acide carboxylique, RCOCl) dans du dichlorométhane/pyridine produit la 5-acyl-2,2-diméthyl-1,3-dioxane-4,6-dione correspondante. Quand cette dernière est mise à reflux avec un alcool aliphatique, R'OH, le cétoester RCOCH2COOR' en résulte, souvent avec un rendement global meilleur que 80% et même avec des réactifs encombrés comme le tert-butanol[8]. les cétoesters de ce type sont utiles pour la synthèse de pyrrole de Knorr (en) :
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Meldrum's acid » (voir la liste des auteurs)
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- (en) M. J. O'Neil (dir.), The Merck index : An encyclopedia of chemicals, drugs, and biologicals, vol. 2, Merck Research Laboratorie, 2006, 14e éd. (ISBN 978-0-911910-00-1) [présentation en ligne], « Meldrum's Acid », p. 1005
- UCB Université du Colorado
- (en) « Meldrum's acid » sur ChemIDplus, consulté le 15 février 2010
- (en) A. N. Meldrum, « A β-lactonic acid from acetone and malonic acid », dans J. Chem. Soc., Trans., vol. 93, 1908, p. 598-601 (ISSN 0368-1645) [texte intégral, lien DOI]
- (en) D. Davidson et S. A. Bernhard, « The Structure of Meldrum's Supposed β-Lactonic Acid », dans J. Am. Chem. Soc., vol. 70, 1948, p. 3426–3428 (ISSN 0002-7863 et 1520-5126) [lien DOI]
- (en) S. Nakamura, H. Hirao et T. Ohwada, « Rationale for the Acidity of Meldrum's Acid. Consistent Relation of C−H Acidities to the Properties of Localized Reactive Orbital », dans J. Org. Chem, vol. 69, no 13, 2004, p. 4309–4316 (ISSN 0022-3263 et 1520-6904) [lien DOI]
- (en) Y. Oikawa, K. Sugano et O. Yonemitsu, « Meldrum's acid in organic synthesis. 2. A general and versatile synthesis of β-keto esters », dans J. Org. Chem, vol. 43, no 10, 1978, p. 2087–2088 (ISSN 0022-3263 et 1520-6904) [lien DOI]
Wikimedia Foundation. 2010.


