- Plutonium
-
Plutonium Neptunium ← Plutonium → Américium Sm
94Pu ↑ Pu ↓ Uqq Table complète • Table étendue Informations générales Nom, symbole, numéro Plutonium, Pu, 94 Série chimique Actinides Groupe, période, bloc L/A, 7, f Masse volumique 19 816 kg·m-3 Couleur blanc argenté No CAS No EINECS Propriétés atomiques Masse atomique 244,06 u Rayon atomique (calc) 159 pm Rayon de covalence 1,87 ± 0,01 Å [1] Configuration électronique [Rn] 5f6 7s2
Électrons par niveau d’énergie 2, 8, 18, 32, 24, 8, 2 État(s) d’oxydation 6, 5, 4, 3 Oxyde amphotère Structure cristalline monoclinique Propriétés physiques État ordinaire solide Point de fusion 640 °C [2]
640° ± 2[3][3]Point d’ébullition 3 228 °C [2] Énergie de fusion 2,84 kJ·mol-1 Énergie de vaporisation 344 kJ·mol-1 Volume molaire 12,29×10-6 m3·mol-1 Pression de vapeur 1 Pa
(à 1 483 °C)Vitesse du son 2 260 m·s-1 à 20 °C Divers Électronégativité (Pauling) 1,28 Chaleur massique 35,5 J·kg-1·K-1 Conductivité électrique 685×106 S·m-1 Conductivité thermique 6,74 W·m-1·K-1 Énergies d’ionisation[4] 1re : 6,0260 eV 2e : 11,2 eV Isotopes les plus stables iso AN Période MD Ed PD MeV 238Pu {syn.} 87,75 a α
FS
cluster5,5
—
?234U
PF
210Pb239Pu {syn.} 24 100 a α
FS5,245
—235U
PF240Pu {syn.} 6 560 a α
FS
clusters5,17
—
?236U
PF
(Pb ; Pt)241Pu {syn.} 14,4 a β-
α0,021
4,85241Am 242Pu {syn.} 373 000 a α
FS4,9
—238U
PF244Pu {syn.} 80,8×106 a α
FS4,666
—240U
PFPrécautions 
Élément radioactifDirective 67/548/EEC 
T+Phrases R : 26/28, 33, 53, Phrases S : (1/2), 20/21, 45, 61, SGH Unités du SI & CNTP, sauf indication contraire. Le plutonium est un métal lourd de symbole chimique Pu et de numéro atomique 94, très dense — approximativement 1,74 fois plus dense que le plomb — radioactif et toxique, découvert aux États-Unis par Glenn T. Seaborg, Edwin M. McMillan, J. W. Kennedy et A. C. Wahl en 1940.
Il est produit dans le cœur des réacteurs nucléaires : sous l'effet du flux de neutrons, une partie de l'uranium qui compose le combustible nucléaire se transforme par capture neutronique.
De même que l'uranium 235, le plutonium 239 est une matière fissible par des neutrons thermiques, qui est utilisée dans la fabrication d'armes nucléaires et la production d'énergie dans certaines centrales nucléaires. Son isotope 238, très fortement radioactif, sert également à l'élaboration de générateurs thermoélectriques à radioisotope.
C'est un cœur de plutonium qui a servi pour réaliser la première explosion atomique, l'essai Trinity, ainsi que Fat Man, la deuxième (et à ce jour dernière) utilisation opérationnelle d'une bombe atomique sur Nagasaki (la bombe Little Boy larguée sur Hiroshima avait un cœur en uranium enrichi).
Sommaire
Origine
Le plutonium est un élément chimique qui est des plus rares dans la nature et presque exclusivement produit par l'homme de 1940 à nos jours. C'est le deuxième des transuraniens à avoir été découvert. L'isotope 238Pu a été produit en 1940 en bombardant une cible d'uranium par du deutérium au cyclotron de Berkeley[5]. Durant le Projet Manhattan, le plutonium 239 avait le nom de code 49, le '4' étant le dernier chiffre de 94 (le numéro atomique) et le '9', le dernier chiffre de 239 (l'isotope utilisé pour la bombe, le 239Pu)[6].
Il n'y a pratiquement plus de plutonium en quantités significatives remontant à une nucléosynthèse primordiale. On le trouve cependant encore dans des terres rares sous forme de très faibles trace de 244Pu[7], ce qui en fait l'élément naturel le plus lourd identifié à ce jour[8].
Par ailleurs, on trouve des traces de 239Pu dans les minerais d'uranium naturel (de même que du neptunium), où il résulte de l'irradiation de l'uranium par le très faible taux de neutrons créés par la désintégration spontanée de l'uranium.
Il a été produit plus massivement (et existe encore en quantités infimes) sous forme de 239Pu dans des structures géologiques particulières, où de l'uranium a été naturellement concentré par des processus géologiques il y a environ 2 milliards d'années, pour atteindre une criticité suffisante pour engendrer une réaction nucléaire naturelle. Son taux de formation dans le minerai d'uranium a ainsi été accéléré par des réactions nucléaires rendues possibles par un accident de criticité naturel. C'est le cas sur le site d'Oklo.
Description
Propriétés physiques et chimiques
Le plutonium est un métal de la série des actinides. Son aspect est gris argenté, mais il se ternit rapidement à l'air libre, devenant généralement gris, parfois verdâtre ou jaunâtre[9],[10] sa couleur apparente étant fonction de l'épaisseur de la couche d'oxydes.
Il est relativement mou, très dense (densité : 19,84), solide à température ambiante mais à point de fusion relativement bas (640 °C) et à température d'ébullition exceptionnellement élevée (3 327 °C). Contrairement à la plupart des matériaux, sa densité s'accroît (de 2,5 %) à la fusion, si bien qu'un lingot de plutonium flotte à la surface du métal en fusion, de même que la glace sur l'eau. La densité du métal liquide décroît ensuite linéairement avec la température[11]. Autour de sa température de fusion, le plutonium liquide présente une très forte viscosité et une tension superficielle élevée par comparaison avec d'autres métaux[12].
Contrairement à la plupart des métaux, c'est un mauvais conducteur de la chaleur et de l'électricité. Sa conductivité électrique décroît quand la température baisse, ce qui est très atypique pour un métal[11]. Cette tendance se prolonge jusqu'à 100 K, puis la conductivité croît pour des échantillons récemment préparés[11]. Aux alentours de 20 K, la résistivité croît avec le temps sous l'effet des radiations alpha, qui disloquent le réseau cristallin ; cet effet varie suivant la composition isotopique de l'échantillon[11].
Le mouvement des atomes sous l'effet de l'auto-irradiation du plutonium disloque progressivement sa structure cristalline par accumulation de défauts cristallins[12]. Cependant, l'auto-irradiation peut également chauffer suffisamment l'échantillon pour conduire à un recuit, ce qui contrebalance l'effet précédent pour des températures supérieures à 100 K [13].
Métallurgie
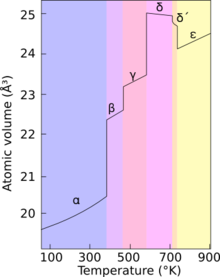 Le plutonium présente six états allotropiques à pression ambiante : alpha (α), beta (β), gamma (γ), delta (δ), delta prime (δ'), & epsilon (ε)[14]
Le plutonium présente six états allotropiques à pression ambiante : alpha (α), beta (β), gamma (γ), delta (δ), delta prime (δ'), & epsilon (ε)[14]
Le plutonium présente six états allotropiques dans les conditions normales de pression. Une septième forme (zeta, ζ) se rencontre à haute température, mais dans un intervalle de pression limité[14].
Ces allotropes ont des énergies internes très proches, mais des structures cristallines et des densités très différentes : les densités de ces formes allotropes varient de 16,00 g/cm3 à 19,86 g/cm3 [15]. Ceci rend le plutonium très sensible à des changements de température, de pression, ou de pollution chimique, et la transition de phase d'un état à l'autre peut conduire à des changements de volume très importants[12].
L'existence de ces nombreux allotropes rend très difficile l'usinage du métal, parce que ses propriétés physiques changent très facilement. Par exemple, à température ambiante, il se trouve dans sa forme alpha : une structure monoclinique de faible symétrie, qui de ce fait est dure et cassante comme de la fonte grise, compressible, et d'une conductivité médiocre[14]. Mais à une température légèrement supérieure, il passe en forme β, qui est au contraire malléable et plastique[11].
Les raisons d'un comportement aussi complexe ne sont pas entièrement comprises.Le plutonium pur se trouve dans sa forme δ entre 310 °C et 452 °C. Cependant, cette forme est stable à température ambiante quand le plutonium est allié avec une faible proportion de gallium, d'aluminium, ou de cérium, ce qui permet son usinage et son soudage[11]. La phase delta, de type cubique à face centrée, présente de plus une forte anisotropie de son élasticité, qui peut varier d'un facteur six à sept suivant les directions[16]. Les propriétés physiques de cette forme delta sont plus celles d'un métal classique, elle est à peu près aussi résistante et malléable que de l'aluminium[14]. Sur le plan metallurgique, travailler en phase delta stabilisée permet d'éviter la contraction très importante du changement de phase au refroidissement, qui déformerait des pièces de fonderie en plutonium pur. De même, la stabilisation fait disparaitre la transition de phase inverse, qui pourrait apparaitre sur des pièces de plutonium pur à la suite d'un chauffage accidentel, entrainant des gonflements et des distortions de la pièce[16].
Dans les armes à fission, l'onde de choc qui comprime le noyau (au-delà de quelques dizaines de kilobars) provoque également une transition de la phase delta vers la forme alpha, nettement plus dense, ce qui permet d'atteindre plus facilement la criticité[16].
Propriétés chimiques
Le plutonium réagit avec l'oxygène, la vapeur d'eau et les acides, le carbone, les halogènes, l'azote et le silicium.
Exposé à de l'air humide, il forme des oxydes et des hydrures qui le font augmenter de volume de près de 70%, ce qui disloque et pulvérise sa surface, et peut le conduire à des combustions spontanées.
Il ne réagit pas avec les bases.
Il présente quatre états d'oxydation principaux.
Dioxyde de plutonium
Article principal : dioxyde de plutonium.Le dioxyde de plutonium PuO2 est, pour les radiochimistes, la forme la plus pratique pour manipuler le plutonium. Découvert en 1940 par les chimistes américains partis sur le chemin de la bombe atomique, on le retrouve pour le recyclage des combustibles nucléaires, la confection des ogives ou le stockage des déchets radioactifs. Il s'agit d'une poudre de cristaux jaunes-verts.
Il a longtemps été considéré comme inoxydable[17].
En France, le dioxyde de plutonium est stocké en surface, dans des boites étanches, pour être ensuite réutilisé dans des centrales ordinaires, en entrant dans la composition du combustible MOX (Mixed OXyde).
Propriétés radiologiques
Le plutonium est un métal très radioactif (selon la composition isotopique, les isotopes 238 et 241 étant de très loin les plus radioactifs).
Il se désintègre principalement par radioactivité α, avec une intensité suffisante pour produire une chaleur sensible : avec une demi-vie de 24 000 ans pour le 239Pu dit « de qualité militaire », un coeur typique d'arme nucléaire de 5 kg contient 12,5×1024 atomes et se désintègre au rythme de 11,5×1012 désintégrations par secondes (becquerels) en émettant des particules alpha ; ce qui correspond globalement à une puissance de 9,68 watts[18],[19].
Il y a 15 isotopes connus. Les isotopes les plus produits en réacteurs sont les isotopes 238, 239, 240, 241, 242. Tous sont radioactifs. Les isotopes de numéro atomique impair (239 et 241) sont fissiles en spectre thermique (réacteurs actuellement en production).
Production
Plutonium 239 et isotopes supérieurs
Article principal : plutonium 239.L'irradiation de l'uranium 238 dans les réacteurs nucléaires génère du plutonium 239 par capture de neutrons. Dans un premier temps, un atome d'uranium 238 capture un neutron et se transforme transitoirement en uranium 239. Cette réaction de capture est plus facile avec des neutrons rapides qu'avec des neutrons thermiques, mais est présente dans les deux cas.
L'uranium 239 formé est fortement instable. Il se transforme rapidement (avec une demi-vie de 23,5 minutes) en neptunium par radioactivité β- :
Le neptunium 239 est également instable, et subit à son tour une décroissance β- (avec une demi-vie de 2,36 jours) qui le transforme en plutonium 239 relativement stable (demi-vie de 24 000 ans).
Le plutonium 239 est fissile, et contribue à la réaction en chaine du réacteur ; mais il peut également capturer un neutron sans subir de fission. Quand le combustible subit des périodes d'irradiation de plus en plus longues, les isotopes supérieurs s'accumulent en raison de l'absorption de neutrons par le plutonium 239 et ses produits. Il se forme ainsi des isotopes 240Pu, 241Pu, 242Pu, jusqu'au 243Pu instable qui se désintègre en américium 243.
- L'isotope intéressant par son caractère fissile est le 239Pu, relativement stable à échelle humaine (24 000 ans).
- L'isotope suivant, le 240Pu, est simplement fertile, et présente une radioactivité "seulement" quatre fois plus élevée (6 500 ans).
- Le 241Pu est également fissile, mais extrèmement radioactif (demi-vie de 14 ans).
En outre il se désintègre en produisant de l'américium 241 neutrophage, ce qui réduit l'efficacité des dispositifs nucléaires militaires. - Le 242Pu a une durée de vie beaucoup plus longue que les précédents (373 000 ans). Il n'est pas fissile en neutrons thermiques. Sa section efficace est beaucoup plus faible que celle des autres isotopes ; le recyclage successif du plutonium en réacteur tend donc à accumuler le plutonium sous cette forme très peu fertile.
Le rythme de production d'un isotope dépend de la disponibilité de son précurseur, qui doit avoir eu le temps de s'accumuler.
Dans un combustible neuf, le Pu 239 se forme donc linéairement en fonction du temps, la proportion de Pu 240 augmente suivant une loi au carré du temps (en t2), celle de Pu 241 suivant une loi au cube du temps (en t3), et ainsi de suite.Ainsi, quand on utilise un réacteur spécifique pour la fabrication du « plutonium militaire », le combustible utilisé pour la production du plutonium aussi bien que les cibles et la couverture s'il y en a, sont extraits après un bref séjour (quelques semaines) dans le réacteur afin d'avoir l'assurance que le plutonium 239 est aussi pur que possible.
En revanche, pour des usages civils, une brève irradiation n'extrait pas toute l'énergie que le combustible peut produire. On n'enlève donc le combustible des réacteurs électrogènes qu'après un séjour beaucoup plus long (3 ou 4 ans).En première approximation, un réacteur produit typiquement 0,8 atome de 239Pu pour chaque fission de 235U, soit un gramme de plutonium par jour et par MW de puissance thermique (les réacteurs à eau légère produisant moins que les graphite-gaz). Ainsi, en France, les réacteurs nucléaires produisent chaque année environ 11 tonnes de plutonium[20].
Plutonium 244
Le plutonium 244, l'isotope le plus stable d'une demi-vie de 80 millions d'années, ne se forme pas dans les réacteurs nucléaires. En effet, les captures neutroniques successives partant de l'uranium 239 conduisent au 243Pu, de très faible demi-vie (de l'ordre de cinq heures). Même dans des réacteurs "à haut flux", le 243Pu se transforme rapidement en 243Am, sans avoir le temps de capturer un neutron supplémentaire pour former le 244Pu.
En revanche, des flux neutroniques plus importants permettent cette formation. Il est synthétisé lors des explosions nucléaires ou par nucléosynthèse stellaire lors de l'explosion d'une supernova. Ainsi, en 1952, l'explosion de la bombe thermonucléaire américaine la plus puissante a ainsi produit deux radioéléments alors encore inconnus : le plutonium 244 (244Pu) et le plutonium 246 (246Pu). Les traces de 244Pu dans l'environnement sont généralement attribuées aux essais nucléaires atmosphériques ainsi qu'à des reliquats de 244Pu primordial.
Plutonium 238
Article principal : plutonium 238. Chargement d'un générateur thermoélectrique à radioisotope au plutonium 238 sur le module lunaire Apollo.
Chargement d'un générateur thermoélectrique à radioisotope au plutonium 238 sur le module lunaire Apollo.
Dans les centrales nucléaires, du plutonium 238 est formé parallèlement au plutonium 239, par la chaîne de transformation commençant par l'uranium 235 fissible.
- L'uranium 235 qui capture un neutron thermique peut se stabiliser par émission d'un rayonnement γ dans 16 % des cas. Il forme alors un atome d'U 236, relativement stable (demi-vie de 23 million d'années).
- Une deuxième capture neutronique le transforme en U 237 (pour mémoire, des atomes d'U 238 peuvent également subir une réaction (n, 2n) qui les transforment en U 237 par perte d'un neutron). L'uranium 237 est instable avec une demi-vie de 6,75 jours, et se transforme par émission β- en neptunium 237, relativement stable (demi-vie de 2,2 millions d'années).
- Une troisième capture neutronique transforme le noyau en neptunium 238, instable de demi-vie 2,1 jours, qui se transforme en plutonium 238 par émission β-.
Le plutonium 238, d'une demi-vie de 86,41 ans, est un émetteur très puissant de rayonnement α. En raison de son activité massique alpha et gamma élevée, il est utilisé comme source de neutrons (par "réaction alpha" avec des éléments légers), comme source de chaleur et comme source d'énergie électrique (par la conversion de la chaleur en électricité). Les utilisations du Pu 238 pour produire de l'électricité sont cantonnées aux utilisations spatiales, et par le passé à certains stimulateurs cardiaques.
On prépare le plutonium 238 à partir de l'irradiation neutronique du neptunium 237, un actinide mineur récupéré pendant le retraitement ou à partir de l'irradiation de l'américium, en réacteur. Dans les deux cas, pour extraire le plutonium 238 des cibles, on les soumet à un traitement chimique, comportant une dissolution nitrique.
Il n'y a qu'environ 700 g/t de neptunium 237 dans le combustible des réacteurs à eau ordinaire irradié pendant 3 ans, et il faut l'extraire sélectivement.
Aspects industriels et militaires
Combustible nucléaire
Le plutonium est un sous-produit de fonctionnement de centrales nucléaires civiles, avec divers actinides.
Lorsqu'il est produit dans les réacteurs civils, il est considéré comme déchet par certains pays et comme matière valorisable par d'autres (dont la France).
En effet, le combustible usé déchargé des réacteurs peut être retraité afin d'en isoler le plutonium, qui est alors mélangé avec de l’uranium appauvri (issu de l'étape initiale d'enrichissement) pour former du combustible MOX.
En faibles quantités, le plutonium 238 est utilisé dans les générateurs thermoélectriques à radioisotope.
Article détaillé : Cycle du combustible nucléaire.Retraitement
Une fois le combustible, les cibles et la couverture enlevés du réacteur dans lequel ils ont été irradiés, ils subissent un traitement chimique, qui s'appelle le retraitement des combustibles irradiés, dans une usine ou un atelier pour séparer le plutonium.
Les deux plus grandes installations mondiales recyclant le plutonium sont basées à la Hague en France, et à Sellafield au Royaume-uni où selon l'IRSN une fuite importante de plutonium (et d'uranium) a eu lieu en 2005 suite à une rupture de soudure dans une des cuves de retraitement[21].
Contrôle des matières nucléaires
Le plutonium est aussi produit à des fins militaires dans des installations dédiées ou dans des réacteurs électrogènes selon les pays. Il est alors utilisé pour fabriquer des armes nucléaires. Il faut environ 5 kg de plutonium 239 pour obtenir une bombe nucléaire. En tant qu'élément utile à la fabrication d'arme de destruction massive, il est suivi par divers textes et conventions internationales.
En France, le plutonium est une matière nucléaire dont la détention est réglementée (Article R1333-1 du code de la défense).
Article détaillé : Contrôle des matières nucléaires.Aspects médicaux
Radioprotection
Le plutonium répond aux définitions admises de « polluant ». Il fait partie des éléments présentant une « radiotoxicité très élevée »[22].
Ce métal est normalement absent dans la nature à la surface du globe, mais il a été produit et diffusé en quantité significative et encore mesurable dans l'atmosphère et la biosphère, essentiellement dans les années 1945 à 1970 par les essais et tirs nucléaires (et marginalement avec aussi des retombées plus locales ou régionales lors de la catastrophe de Tchernobyl).
Tous les isotopes et composés du plutonium sont toxiques et radioactifs.
Ce qui le rend dangereux est d'une part sa forte activité spécifique, et d'autre part l'énergie de ses émissions alpha (de l'ordre de 5 MeV, à comparer au 0,02 MeV du tritium). Le plutonium est d'autant plus dangereux que sa période radioactive est courte: le Pu 239 est comparativement quatre fois moins radioactif que le Pu 240. Le radio-isotope le plus dangereux est le Pu 241, qui est extrêmement radioactif (mille fois plus que les précédents), est un émetteur β- (donc plus pénétrant que les particules alpha), et présente dans sa chaine radioactive des émetteurs de rayons gamma durs particulièrement dangereux, comme l'américium 241. Paradoxalement, c'est donc le plutonium dit « de qualité militaire », formé essentiellement de Pu 239, qui est le moins dangereux en termes de radiotoxicité : il est relativement stable, et peut être manipulé avec des gants épais[23].
Isotope Activité spécifique (Curie/g) Activité spécifique
(x 109 Bq/g)Radiotoxicité en ingestion (µSv/Bq)[24] Radiotoxicité en ingestion (Sv/µg) Radiotoxicité "M" en inhalation (µSv/Bq)[24] Pu 238 17,3 640 4 2,56 78 Pu 239 0,063 2,3 4,2 0,01 80 Pu 240 0,23 8.5 4,2 0,035 80 Pu 241 104 3848 0,056 0,215 0,91 L'isotope le plus dangereux est le Pu 238, utilisé dans des générateurs thermoélectriques à radioisotope : un millionième de gramme (microgramme) ingéré et fixé dans l'organisme suffit à délivrer une dose équivalente calculée de quelques sievert. Cependant, cette dose est délivrée sur toute une vie, et correspond à un débit de dose relativement faible (de l'ordre de quelques dizaines de µSv/h) dont les effets sont très mal connus. Les isotopes utilisés dans l'industrie électronucléaire sont dix à cent fois moins radiotoxiques.
On estime qu'une quantité de l'ordre d'une dizaine de milligrammes provoque le décès d'une personne ayant inhalé en une seule fois des oxydes de plutonium. En effet les test sur babouins et chiens montrent une mortalité de 50 % : au bout de 30 jours avec 9 mg, au bout d'un an avec 0,9 mg et trois ans avec 0,4 mg[25].
L'apparition de tumeurs pulmonaires a été mise en évidence chez le chien et le rat après inhalation de composés peu solubles tels que les oxydes de plutonium : la relation dose-effet mise en évidence comporte un seuil d'apparition des tumeurs pour une dose au poumon autour de 1 Gy[22],[7]. Ce seuil d'apparition des tumeurs correspondrait chez l'homme à un dépôt pulmonaire d'environ 200 000 Bq (soit 87 µg) d'oxyde de Pu 239[7].
Toxicocinétique
Le plutonium est un émetteur de rayonnement alpha, type de rayonnement facilement arrêté par les parois fines, y compris par la peau. Cependant, s'il est inhalé ou ingéré, il irradie directement les cellules des organes qui sont en contact avec lui (ou qu'il a pénétré). Il peut alors affecter leur noyau et l'ADN et provoquer des cancers. Son activité interne est d'autant plus dangereuse qu'une part importante du plutonium absorbé par l'organisme s’y fixe durablement ; sa demi-vie biologique est estimée être de 200 ans[26]. À cause de ses caractéristiques et nombreux isotopes, il faudrait distinguer la toxicité de court, moyen et long terme, et les cas d'exposition externe et interne.
En cas d'ingestion par un individu sain, seul environ 0,05 % est absorbé par le tube digestif.
Le plutonium franchit mal la barrière cutanée (si la peau est en bon état).
Par contre, une part importante du plutonium inhalé passe des poumons au sang qui le diffuse vers d'autres organes, plus ou moins vite et bien selon la taille des particules, et selon la nature et la solubilité du composé. Chez l'animal de laboratoire exposé à des taux élevés de plutonium, les tissus cibles ont été les poumons, les ganglions lymphatiques, le foie et les os (avec réduction de la durée de vie, cancers et pathologie pulmonaires).On estime que chez l'Homme, 10 % du plutonium qui a franchi la barrière intestinale ou pulmonaire quitte le corps (via l'urine, et les excréments). Le reste après passage dans le sang se fixe pour moitié dans le foie et pour moitié dans le squelette, où il demeure très longtemps et pour partie à vie (Le DOE américain estime que la demi-vie dans l'organe est respectivement de 20 et 50 ans pour le foie et l'os, selon des modèles simplifiés ne tenant pas compte de redistributions intermédiaires (en cas de fracture et/ou de ménopause (cf. décalcification) et lors du recyclage normal de l'os, etc). Le DOE précise que le taux accumulé dans le foie et le squelette dépend aussi de l'âge de l'individu (l'absorption dans le foie augmente avec l'âge), et qu'en fait, le plutonium se fixe d'abord sur la surface corticale et trabéculaire des os avant d'être lentement redistribué dans tout le volume minéral osseux.
Notes et références
- (en) Beatriz Cordero, Verónica Gómez, Ana E. Platero-Prats, Marc Revés, Jorge Echeverría, Eduard Cremades, Flavia Barragán et Santiago Alvarez, « Covalent radii revisited », dans Dalton Transactions, 2008, p. 2832 - 2838 [lien DOI]
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, CRC Press Inc, 2009, 90e éd., Relié, 2804 p. (ISBN 978-1-420-09084-0)
- fiche IFA GESTIS
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, CRC, 2009, 89e éd., p. 10-203
- Plutonium production, Federation of American Scientists.
- (en) E.F. Hammel, « The taming of "49" — Big Science in little time. Recollections of Edward F. Hammel ». Consulté le 24 mai 2008. Cette convention a été étendue pour tous les actinides, dans les équations décrivant la dynamique de leur population dans des réacteurs. Ainsi, l'isotope 235 de l'uranium (92) reçoit dans les équations l'indice 25 et ainsi de suite.
- Fiche radionucléide Plutonium, IRSN, 2008.
- Detection of Plutonium-244 in Nature, Hoffman, Lawrence, Mewherter, Rourke, Nature 234, 132 - 134 (19 November 1971).
- NIH contributors, « Plutonium, Radioactive », Wireless Information System for Emergency Responders (WISER), U.S. National Library of Medicine, National Institutes of Health. Consulté le 2008-11-23 (public domain text)
- ARQ staff, « Nitric acid processing », dans Actinide Research Quarterly, Los Alamos (NM), Los Alamos National Laboratory, no 3rd quarter, 2008 [texte intégral (page consultée le 2010-02-09)]
- (en) William N. Miner, The Encyclopedia of the Chemical Elements, New York (NY), Reinhold Book Corporation, 1968, « Plutonium », p. 540–546
- Siegfried S. Hecker, « Plutonium and its alloys: from atoms to microstructure », dans Los Alamos Science, vol. 26, 2000, p. 290–335 [texte intégral [PDF] (page consultée le 2009-02-15)]
- Siegfried S. Hecker, « Aging of Plutonium and Its Alloys », dans Los Alamos Science, Los Alamos, New Mexico, Los Alamos National Laboratory, no 26, 2000, p. 242 [texte intégral [PDF] (page consultée le 2009-02-15)]
- Richard D. Baker, « Plutonium: A Wartime Nightmare but a Metallurgist's Dream », dans Los Alamos Science, Los Alamos National Laboratory, 1983, p. 148, 150–151 [texte intégral (page consultée le 2009-02-15)]
- CRC 2006, p. 4–27
- Plutonium Crystal Phase Transitions, GlobalSecurity.org.
- Longtemps le trioxyde de plutonium (PuO3) a été recherché mais personne n'était parvenu à en produire. Cependant, en 2000, le laboratoire de Los Alamos (Nouveau-Mexique) a montré que PuO2 peut en fait réagir simplement avec l'eau, à une température allant de 25 à 350 °C, pour former un composé stable plus oxydé : la proportion entre l'oxygène et le plutonium peut aller jusqu'à 2,27. De plus, cette réaction dégage du dihydrogène, un gaz inflammable. Ceci est problématique, car l'eau serait le principal vecteur potentiel de dissémination radioactive lors du stockage des déchets en profondeur. Une fraction du nouvel oxyde formé pourrait se dissoudre dans l'eau et se disséminer lentement aux alentours.
- [CITEREFHeiserman1992] (en) David L. Heiserman, Exploring Chemical Elements and their Compounds, New York (NY), TAB Books, 1992, 1re éd. (ISBN 978-0-8306-3018-9) (LCCN 91017687), « Element 94: Plutonium », p. 337–340
- (en) Richard Rhodes, The Making of the Atomic Bomb, New York, Simon & Schuster, 1986, 1re éd., poche (ISBN 978-0-671-65719-2) (LCCN 86015445), p. 659–660 Leona Marshall: "Quand vous en prenez un lingot en main, on sent qu'il est chaud comme un lapin vivant"
- Rapport Bataille 1997/1998 au Sénat.
- Sellafield, où, à l’usine de retraitement de Thorp, le 19 avril 2005, a été découverte une fuite de 200 kg de plutonium perdus avec 83 000 litres de matière radioactive dans une pièce en béton armé (conçue pour recueillir d'éventuelles pertes). Cette fuite a fait suite à une rupture de canalisation qui n'avait pas été détectée, les techniciens n'ayant pas — durant plusieurs mois — pris en compte les indicateurs d'alerte à ce sujet, qui montrait une perte de poids de la cuve signifiant une fuite. Craignant un accident de criticité, l'autorité de sûreté a provisoirement fermé l'une des deux installations jumelles.
- Fiche radiotoxicologique Plutonium, CEA, décembre 2005.
- FAS fact sheet
- Arrêté du 1er septembre 2003 définissant les modalités de calcul des doses efficaces et des doses équivalentes résultant de l'exposition des personnes aux rayonnements ionisants. JORF n°262 du 13 novembre 2003 page 58003.
- IRSN Fiche Radionucléide page 7
- Radiological control technical training DOE-HDBK-1122-99, U.S. Department of Energy.
Voir aussi
Articles connexes
- Contrôle des matières nucléaires
- Énergie nucléaire
- Radioactivité
- Isotopes :
- Tableau périodique des éléments
- Procédé Purex
Bibliographie
Sandrine Matton ; Mesures in vitro et in vivo des paramètres de dissolution des oxydes mixtes d'uranium et de plutonium en milieu biologique (In vitro and in vivo measurements of dissolution parameters of mixed uranium and plutonium oxides in biological medium) ; Thèse de Sandrine Matton (sous la direction de Michel Genet), soutenue à l'université de Paris 11 Orsay (Inist CNRS)
Liens externes
- (fr) Pu - tableau périodique des éléments (Faculté de chimie de Split)
- (fr) Fiche d'informations sur le Pu (Areva)
- (en) Les expérimentations humaines sur le plutonium aux États-Unis (Los Alamos Science, 23, 1995)
- (en) Plutonium, par le "World Nuclear Association"
- (en) Toxicological Profile for Plutonium, ATSDR, U.S. Department of Health and Human Services
- Les isotopes du plutonium et leurs descendants dans le nucléaire civil, rapport à l'Académie des sciences par Robert Dautray - Paris - Mai 2005 - Éditions Tec & Doc Lavoisier.
*Plutonium, Mythes et Réalités - Janvier 2010 - EDP Sciences.
s1 s2 g f1 f2 f3 f4 f5 f6 f7 f8 f9 f10 f11 f12 f13 f14 d1 d2 d3 d4 d5 d6 d7 d8 d9 d10 p1 p2 p3 p4 p5 p6 1 H He 2 Li Be B C N O F Ne 3 Na Mg Al Si P S Cl Ar 4 K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr 5 Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Xe 6 Cs Ba La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Rn 7 Fr Ra Ac Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr Rf Db Sg Bh Hs Mt Ds Rg Cn Uut Uuq Uup Uuh Uus Uuo 8 Uue Ubn * Ute Uqn Uqu Uqb Uqt Uqq Uqp Uqh Uqs Uqo Uqe Upn Upu Upb Upt Upq Upp Uph Ups Upo Upe Uhn Uhu Uhb Uht Uhq Uhp Uhh Uhs Uho ↓ g1 g2 g3 g4 g5 g6 g7 g8 g9 g10 g11 g12 g13 g14 g15 g16 g17 g18 * Ubu Ubb Ubt Ubq Ubp Ubh Ubs Ubo Ube Utn Utu Utb Utt Utq Utp Uth Uts Uto Métalloïdes Non-métaux Halogènes Gaz rares Métaux alcalins Métaux alcalino-terreux Métaux de transition Métaux pauvres Lanthanides Actinides Superactinides Éléments non classés Catégories :- Produit chimique très toxique
- Produit chimique dangereux pour l'environnement
- Élément chimique
- Actinide
- Transuranien
- Déchet radioactif
- Matériau nucléaire
Wikimedia Foundation. 2010.





