- Perchlorate de francium
-
Perchlorate
Les anions perchlorate ont pour formule ClO4- et sont disponibles commercialement sous la forme de divers sels. Ils se retrouvent de façon naturelle dans des régions arides ainsi que dans certains dépôts de minéraux comportant une grande quantité de nitrate. Ces minéraux, présents de façon accessible et en grande quantité au Chili, sont utilisés pour faire des engrais commercialisés à grande échelle.[1] Les perchlorates sont également utilisés sous forme de perchlorate d’ammonium (NH4ClO4) en tant qu’oxydant dans les munitions d’armes à feu, les missiles, les roquettes et les feux d’artifice.
Ces utilisations diverses des perchlorates expliquent en partie comment ils se sont répandus dans la nature jusqu’à en devenir un problème environnemental important dans certaines régions du monde. Ils ont été détectés en 1997 dans plusieurs réserves d’eau dans l’ouest des États-Unis[2] provoquant par la suite une véritable crise de l’eau potable[3]. De nos jours, plusieurs autres régions du monde ont été déterminées comme étant contaminées à divers degrés.
La présence des ions perchlorate dans l’environnement est problématique vu qu’ils peuvent occasionner des effets négatifs sur la santé humaine, même s’ils y sont seulement trouvés en de faibles concentrations. Leur effet inhibiteur sur la production de certaines hormones faite par la thyroïde est connu depuis de nombreuses années et cet aspect est d’ailleurs utilisé en médecine pour traiter l’hyperthyroïdie. Toutefois, ces hormones aident également à réguler le métabolisme et la croissance à divers points de vue, d’où la nécessité de ne pas en perturber la production inutilement.
Sommaire
Informations générales et synthèse
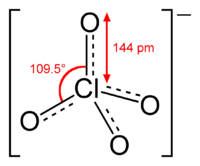
L’anion perchlorate ClO4- a une masse moléculaire de 99.45 u.m.a. et le chlore qu’il contient a un degré d’oxydation de 7. Le CAS du ClO4- est 14797-73-0.
Industriellement, cet anion est exclusivement synthétisé selon l’oxydation électrochimique d’ions chlorate. Toutefois, il existe d’autres méthodes de synthèse moins économiques telles que faire la décomposition thermique d’ion chlorate ou en oxydant chimiquement des ions chlorate.
Les perchlorates sont très solubles dans l’eau et s’adsorbent très peu sur des surfaces minérales ou même sur du carbone activé.[4]
Effets sur la santé
« Les perchlorates sont des inhibiteurs compétitifs au procesus suivant lequel les iodures contenus dans le sang sont transportés activement jusqu’au follicule de la thyroïde.»[5] Or, ces iodures sont nécessaires pour que la glande thyroïde produise des hormones aidant à réguler le métabolisme ainsi que la croissance. Cet effet inhibiteur est utilisé en médecine pour traiter l’hyperthyroïdie c'est à dire la maladie due à un excès de production d’hormones thyroïdiennes.
Toutefois, une trop grande quantité de perchlorate ingérée peut également provoquer l’hypothyroïdie, une maladie suite à un manque de production d’hormones thyroïdiennes. Ceci peut également avoir de nombreuses conséquences néfastes. « Les fluctuations de courte durée des hormones thyroïdiennes ne sont pas un problème chez l'adulte en bonne santé »[6], mais les perturbations à long terme peuvent occasionner divers symptômes allant de la dépression jusqu’aux pertes de mémoire et aux douleurs musculaires. « Ces effets sont particulièrement préoccupants pour les personnes qui souffrent déjà d'hypothyroïdie ainsi que pour les femmes enceintes et les enfants. »[6]
Une étude faite sur des adultes humains en bonne santé[5] a permis de déterminer que l’effet inhibiteur de la thyroïde sur l’absorption de l’iode contenue dans le sang est observé pour des concentrations supérieures à 0,007 milligramme de perchlorate absorbé par jour et par kilogramme de poids de la personne. Pour tenir compte des individus sensibles de la population ainsi que des diverses incertitudes de l’étude, il faut généralement diviser cette concentration par un facteur 10 pour établir la NOEL (la plus grande dose pour laquelle aucun effet n’est observé) ce qui équivaut à 0,0007 mg/kg•jour. C’est un facteur 10 qui est utilisé lorsque l'expérimentation porte sur sur l'espèce concernée, comme c’est le cas ici (typiquement les humains) et un facteur 100 si l’expérimentation a été faite sur une autre espèce (souvent les rats).
En utilisant le poids moyen d’un individu (70 kg) et la consommation d’eau moyenne (2 L/jour), l’agence de protection de l'environnement des États-Unis nommée EPA (« Environmental Protection Agency ») a déterminé que le DWEL (« Drinking Water Equivalent Level » ou le niveau équivalent en eau bue) du perchlorate correspondant à 0,0007 mg/kg•jour était de 24,5 ppb.[7]
Perspectives environnementales
L’anion perchlorate est très soluble dans l’eau et il peut donc se propager rapidement dans l’environnement en contaminant autant les eaux de surfaces que les eaux souterraines. De plus, les perchlorates ont été rapportés comme pouvant s’accumuler dans les plantes[8], ce qui peut consister en une autre source de contamination que de boire directement de l’eau.
Les plantes en bordure des eaux de surfaces sont celles qui ont les plus grandes probabilités d’être exposées aux perchlorates. Toutefois, les perchlorates ont également été déterminés comme pouvant s’accumuler dans les plantes terrestres. En effet, plusieurs plantes et légumes ont été rapportés comme pouvant être contaminés à différents degrés par les perchlorates aux États-Unis. Une étude récente effectuée sur des concombres, des laitues et des plants de soya tend à montrer que ces légumes peuvent accumuler respectivement jusqu’à 41, 780 et 18 ppm de perchlorate à partir d’un sol sablonneux et en présence d’engrais[9].
Cette forte capacité qu’ont les laitues d’accumuler les perchlorates dans leurs feuilles a soulevé bien des questionnements quant au niveau d’exposition des humains qui en consomment. En effet, environ 90% de la laitue consommée aux États-Unis durant l’hiver provient de la zone avoisinant le bas de la rivière du Colorado, une rivière contaminée aux perchlorates dans des concentrations de 1,5 à 8 ppb et dont l’eau est utilisée pour l’irrigation des laitues[10].
Cette quantité de perchlorate disponible pour être absorbée par les laitues s’ajoute parfois à celle contenue dans les engrais utilisés pour les faire croître. Les dépôts de minéraux en provenance du Chili qui sont riches en nitrates sont connus depuis longtemps comme une source naturelle de perchlorate. Or, ces mêmes dépôts sont utilisés pour faire certains engrais vendus en de relativement faibles quantités mais à travers le monde, d’où la contamination aux nitrates provenant de quelques types engrais. Toutefois, la plupart des engrais proviennent d’ailleurs que du Chili et ne contiennent généralement pas une quantité significative de perchlorates[10].
Les résultats de l’étude sur les différents types de laitues[9] montraient que pour une consommation standard de 55 g de laitue par jour, ceci correspondait à moins de 4% de la dose quotidienne de perchlorate maximale recommandée par l’EPA de 0,0007 mg/kg[10]. Toutefois, si on considère la nourriture consommée aux États-Unis dans son ensemble, une étude récente a montré que plus de la moitié de la dose maximale en perchlorate recommandée par l’EPA est atteinte chaque jour pour les Américains[11]. À ce nombre s’ajoute les perchlorates présents dans l’eau consommée d’où l’ampleur de la problématique. En effet, plusieurs sites d’approvisionnement en eau potable aux États-Unis ont été rapportés comme ayant des concentrations en perchlorate plus grandes que 18 ppb[4],[12] ce qui, combiné à l’apport de perchlorate de la nourriture, peut excéder la NOEL déterminée par l’EPA.
Il n’y a toutefois pas encore de dose maximale permise en perchlorate dans l’eau potable pour l’ensemble des États-Unis, chaque état étant libre de faire la régulation qu’il veut en tenant ou non en compte les recommandations de l’EPA. Au niveau du Canada, aucune norme nationale pour les perchlorates n’a été établie non plus. Une seule contamination d’eau aux perchlorates y a été rapportée jusqu’à présent et c’est à une concentration aussi faible que 1 ppb. Toutefois, « Santé Canada recommande une valeur-guide pour l’eau potable de 6 ppb, basée sur un examen des évaluations de risque courantes d'autres organismes »[6].
Analyse des perchlorates
Le fait que même des traces de perchlorates dans la nature puissent être nuisibles fait en sorte qu’il faut être en mesure de détecter les perchlorates à de très faibles concentrations. Des techniques avec de faibles limites de détection sont donc nécessaires et ceci contribue à alimenter le défi analytique qu’ils représentent. Une variété de méthodes d’analyse des perchlorates ont été développées récemment, allant de la chromatographie en phase liquide à haute performance jusqu’à la spectroscopie Raman et à la chromatographie à ions[13]. La plupart présentent des avantages et des inconvénients et des recherches à ce sujet sont encore nécessaires, d’où l’actualité de la problématique.
Aux États-Unis, une méthode récemment développée par l’EPA[14] utilise la chromatographie à échange d'ions (IC) pour quantifier la teneur en perchlorate dans l’eau prête à être bue. La technique utilisée est celle de la chromatographie à ions avec détection de conductivité supprimée par « electrospray ionization mass spectrometry » (ESI-MS)[14]. Ici, une colonne à échange d’anions est utilisée et les anions ClO4- sont séparés des autres ions en utilisant une phase mobile qui est une solution aqueuse de KOH.
Pour rentrer davantage dans les détails de cette technique utilisée par l’EPA[14], la plus petite concentration déterminée selon leurs standards de qualité est de 0,10 μg/L en utilisant l’ion à m/z = 101. La limite de détection de la méthode a été déterminée comme étant de 0,02 μg/L dans l’eau et un standard interne de Cl18O4- est utilisé. L'analyse se fait à m/z = 101 soit pour l’ion 37Cl16O4-, car ils ont déterminé qu’il y a moins d’interférences sur le spectre de masse qu’à m/z = 99, soit pour l’ion 35Cl16O4-. L’EPA a utilisé une solution aqueuse de 65 ou 75 mM en KOH pour la phase mobile ce qui assurait d’avoir la force d’élution désirée.
Cette technique présente l’avantage d’avoir une limite de détection particulièrement petite par rapport à d'autres. L’utilisation d’un détecteur de spectromètre de masse permet cette grande sensibilité mais nécessite également de grands coûts. Les méthodes alternatives aux méthodes basées sur la chromatographie à ions et/ou sur la spectrométrie de masse qui ont été établies jusqu’à maintenant ne sont pas aussi sensibles. Par spectroscopie Raman, des limites de détection de l’ordre des 10 à 100 μg/L ont été atteintes[15]. Une technique utilisant l'« attenuated total reflectance FTIR » a rapporté des limites de détection de l’ordre des 3μg/L[12].
Traitement d’eaux contaminées au niveau domestique
Il y a des appareils qui permettent de réduire la teneur en perchlorate dans l’eau et qui sont accessibles pour les particuliers. « Les systèmes de traitement municipaux et plusieurs systèmes domestiques certifiés de purification par osmose inversée [voir osmose inverse] permettent de réduire la teneur en perchlorate à 6 ppb ou moins. »[6] Ce type d’appareil est parfois utilisé pour faire face à une contamination locale.
Découverte possible de traces de perchlorate sur Mars
La NASA a annoncé qu'en juillet 2008, deux échantillons de sol martien ont été analysés par le laboratoire de chimie humide de la sonde Phœnix (MECA) comprenant aussi des examens par microscopie optique et des mesures électrochimiques et de conductivité électrique. Les premières analyses inclinent à penser que le sol pourrait contenir de façon assez surprenante des traces de perchlorate. Toutefois, on ignore encore si ces traces proviennent d'une contamination éventuelle du module d'atterrissage Phœnix par des gaz ou des aérosols libérés par les moteurs à ergols solides (boosters au perchlorate d'ammonium/aluminium métal) de la fusée au moment de son lancement ou si elles sont réellement présentes dans les échantillons de sol analysés.[16]
Il paraît aussi peu vraisemblable que ces traces de perchlorate proviennent de l'atterrisseur Phœnix lui même qui n'a utilisé que des ergols liquides à base d'hydrazine pure. En outre, le perchlorate a été retrouvé sous la surface du sol et à des concentrations plus élevées que celles attendues en cas de contamination au moment des opérations de lancement terrestre.[17] De nouvelles mesures devraient permettre de trancher la question, mais aucunes traces de perchlorate n'avaient été détectées au moment de la calibration et des tests à blanc du laboratoire de chimie humide MECA peu après l'attérrissage de la sonde Phœnix. La question demeure donc ouverte.
Voir aussi
Liens internes
Liens externes
- (fr)Fiche INRS de l'acide chlorique
- (fr)Fiche internationale de sécurité de l'acide chlorique
- (fr)Santé Canada : Le perchlorate et la santé humaine
- (en)Perchlorates dans l'alimentation aux USA (Une nouvelle étude de la FDA donne des moyennes mais n'inclut pas les populations très exposées, Environmental Science & Technology, 13/02/08,)
- (en)Méthode d’analyse des perchlorates dans l’eau de l’EPA
Notes et références
- ↑ Susarla, S., Collete, T.W., Garrison, A.W., Wolfe, N.L. et S.C. McCutcheon, Perchlorate identification in fertilizers, Environ. Sci. Technol., 1999, 33, 3469-3472.
- ↑ Richardson, D.S. et A.T. Ternes, Water analysis : Emerging Contaminants and Current Issues, Anal. Chem., 2005, 77, 3807-3838.
- ↑ Wu, J., Unz, R.F., Zhang, H. et B.E. Logan, Persistence of Perchlorate and the Relative Numbers of Perchlorate- and Chlorate-Respiring Microorganisms in Natural Waters, Soils, and Wastewater, Biorem. J., 2001, 5 (2), 119-130.
- ↑ a et b Logan, E.B., Assessing the outlook for perchlorate remediation, Environ. Sci. Technol., 2001, 35, 482 A-487 A.
- ↑ a et b Greer, M.A., Goodman, G., Pleus, R.C. et S.E. Greer, Health Effects Assessment for Environmental Perchlorate Contamination: The Dose Response for Inhibition of Thyroidal Radioiodine Uptake in Humans, Environ. Health Perspect., 2002, 110 (9), 927-937.
- ↑ a , b , c et d Santé Canada, Le perchlorate et la santé humaine [En ligne]. 7 janvier 2008 [20 mars 2008]. Disponible sur Web : http://www.hc-sc.gc.ca/ewh-semt/pubs/water-eau/perchlorate_f.html
- ↑ P.B., Susan, U.S. EPA Memorandum [En ligne]. 26 janvier 2006 [19 mars 2008]. Disponible sur Web : http://www.epa.gov/fedfac/pdf/perchlorate_guidance.pdf
- ↑ Smith, N.P., Yu, L., McMurry, S.T., et T.A. Anderson, Perchlorate in water, soil, vegetation, and rodents collected from the Las Vegas Wash, Nevada, USA, Environ. Pollut., 2004, 132, 121-127.
- ↑ a et b Yu, L., Cañas, J.E., Cobb, G.P., Jackson, W.A. et T.A. Anderson., Uptake of perchlorate in terrestrial plants, Ecotoxicol. Environ. Saf., 2004, 58, 44-49.
- ↑ a , b et c Sanchez, C.A. Krieger, R.I., Khandaker, N., Moore, R.C., Holts, K.C. et L.L. Neidel, Accumulation and Perchlorate Exposure Potential of Lettuce Produced in the Lower Colorado River Region, J. Agric. Food. Chem., 2005, 53, 5479-5486.
- ↑ Renner, R., Perchlorate in food, Environ. Sci. Technol. [En ligne]. 13 février 2008 [20 mars 2008]. Disponible sur Web : http://pubs.acs.org/subscribe/journals/esthag-w/2008/feb/science/rr_perchlorate.html
- ↑ a et b Hebert, G.N., Odom, M.A., Bowman, S.C., Strauss, S.H., Attenuated Total Reflectance FTIR Detection and Quantification of Low Concentrations of Aqueous Polyatomic Anions, Anal. Chem., 2004, 76, 781-787.
- ↑ Liu, Y. et S. Mou, Determination of trace levels of haloacetic acids and perchlorate in drinking water by ion chromatography with direct injection, J. Chromatogr., 2003, 997, 225-235.
- ↑ a , b et c Hedrick, E. et T. Behymer, U.S. EPA Determination of Perchlorate in Drinking Water by Ion Chromatography with Suppressor Conductivity and Electrospray Ionization Mass Spectroscopy [En ligne]. Mars 2005 [21 mars 2008]. Disponible sur Web : http://www.epa.gov/nerlcwww/m_332_0.pdf
- ↑ Gu, B., Tio, J., Wand, W. Ku, Y.-K. et S. Dai, Raman Spectroscopic Detection for Perchlorate at Low Concentrations, Appl. Spectrosc., 2004, 58, 741-744.
- ↑ http://www.nasa.gov/mission_pages/phoenix/news/phoenix-20080804.html
- ↑ Miles O'Brien and Kate Tobin (2008-08-04). "Toxin in soil may mean no life on Mars", CNN. Accédé le 2008-08-05.
- Portail de la chimie
Catégories : Oxyanion | Perchlorate | Mars
Wikimedia Foundation. 2010.