- Patch clamp
-
Patch-clamp
 Pour les articles homonymes, voir Patch.
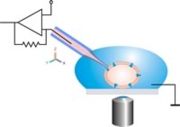
Pour les articles homonymes, voir Patch.Patch-clamp est un terme anglais désignant une technique électrophysiologique d'enregistrement des courants ioniques transitant à travers les membranes cellulaires. Cette technique consiste à mettre en continuité electrique une micro-pipette en verre (diamètre de contact de l'ordre de 1 µm) remplie d'une solution ionique de composition définie avec la membrane d'une cellule vivante isolée. Les cellules étudiées peuvent être des cellules excitables comme les neurones, les fibres musculaires et les cellules beta du pancréas. Les cellules non excitables présentent aussi à leur surface des canaux ioniques qui peuvent être étudiés à l'aide de cette technique. Il est enfin possible d'étudier tout canal ionique en apportant par la technique de transformation un petit ADN codant le canal ionique d'intérêt dans une cellule où il n'est pas exprimé basalement. Cette technique permet d'étudier les mécanismes de fonctionnement des canaux ioniques d'une cellule prise individuellement en permettant le suivi en direct des phénomènes d'ouverture des canaux.
Elle fut très nettement améliorée par Erwin Neher et Bert Sakmann à Götingen en 1976, ce qui leur valut le prix Nobel de physiologie et médecine en 1991. Ils furent les premier à mesurer l'activité d'une seule molécule canalaire, en l'occurrence le canal récepteur à l'acétylcholine.
Il peut être utilisé sous deux modes principaux :
- Voltage-Clamp ou mesure de courant en potentiel imposé ;
- Current-Clamp ou mesure de potentiel en courant imposé.
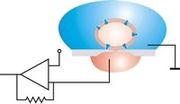
Le principe de la mesure repose sur l'utilisation de la loi d'Ohm U = R.I, où U est la tension, R la résistance et I le courant. Cette loi est plus souvent écrite I = G.E où E=U et G = 1 / R est la conductance. En mode voltage clamp, la tension est maintenue constante et le courant I est mesuré. Les modifications de I dépendent directement de G, la grandeur d'intérêt, puisqu'elle dépend directement des propriétés du canal. En mode current clamp, les variations du potentiel de membrane sont mesurés.
Sommaire
Configurations
Il existe 4 configurations de patch clamp :
- Cellule entière: (whole-cell en anglais) l'activité macroscopique de l'ensemble des courants cellulaires est mesurée. Les canaux ioniques sont les équivalents électriques de résistances en parallèle. La conductance globale G est égal à la somme de chaque conductance unitaire γ multipliée par sa probabilité d'ouverture. Cette technique est utilisée lorsque la conductance unitaire est en dessous du seuil de détection (environ 1 picoSiemens). Elle est aussi utilisée lorsque les propriétés biophysiques du canal sont trop complexes ou que le type de question posé par l'expérimentateur est de l'ordre de la physiologie de la cellule.
- Cell-attached (signifiant « cellule attachée ») : la micro-pipette est pressée contre la membrane. Le fragment de membrane sous la pipette n'est pas brisé comme dans la configuration cellule entière, ni la pipette éloignée de la cellule. Cette configuration est utilisée dans les cas où un facteur inconnu du cytoplasme est nécessaire au maintien de l'activité du canal, ou bien lorsque le canal nécessite une liaison avec les protéines du cytosquelette. Toutes les autres configurations modifient en effet les milieux baignant les deux faces du canal. Dans celle-ci, le cytoplasme est peu modifié.
- "Inside-out" (signifiant « interne à l'extérieur »), où le fragment de membrane accolé à la pipette de mesure a sa face intracellulaire en contact avec l'extérieur de la pipette. C'est la configuration de choix pour l'étude unitaire de tous les canaux ioniques, sauf ceux dont l'ouverture nécessite la fixation d'un ligand (voir ci-dessous)
- "Outside-out" (signifiant « externe à l'extérieur »), où le fragment de membrane accolé à la pipette de mesure a sa face intracellulaire en contact avec l'intérieur de la pipette. Cette méthode est typiquement utilisée pour l'étude de canaux activés par fixation d'un ligand, comme par exemple le canal récepteur à l'acétylcholine nicotinique ou les canaux GABAA. Cette configuration est plus difficile à obtenir que celle « inside-out », ce qui explique que son choix se limite à cette classe de canaux.
Ces deux dernières catégories permettent de mesurer l'activité d'un seul canal ionique.
Planar patch clamp
Le planar patch clamp est une nouvelle méthode développée pour le criblage électrophysiologique à haut débit. Au lieu de positionner une pipette sur une cellule adhérente, les cellules en suspension sont déposées sur une puce (chip) dont la surface comporte une micro-ouverture représentant la pipette à surface plane.


Une cellule unique est alors positionnée au niveau de l'ouverture par l'application d'une succion et un contact étroit est formé (Gigaseal). La géométrie d'une surface plane offre une variété d'avantages comparée aux expérimentations classiques - il permet d'intégrer un système de microfluidique qui permet l'application de produits de manière automatisée pour le criblage des canaux ioniques - le système est également accessible pour les techniques optiques ou le « scanning probe » et permet également une perfusion aussi bien extracellulaire qu'intracellulaire.
Mesure de l'exocytose et de l'endocytose par suivi de capacité membranaire
Les bicouches lipidiques qui forment l'enveloppe externe cellulaire (membrane plasmique) et celles des organites intracellulaires (vésicules synaptiques, granules de sécrétion, lysosomes, noyau cellulaire...) constituent deux faces présentant des charges électriques (« têtes >> polaires des lipides, hydrophiles) séparées par un feuillet isolant (partie hydrophobe des lipides) peuvent être considérées d'un point de vue biophysique comme des condensateurs, capables d'accumuler des charges ; la capacité électrique (exprimée en Farads F) d'une membrane biologique donnée est strictement proportionnelle à sa surface. Il est possible, par les techniques du patch-clamp de mesurer la capacité électrique des objets (totalité de la cellule en configuration « whole-cell » ou cellule entière, ou bien le fragment de membrane présent sous la pipette en « cell-attached » ou « cellule attachée ».
Il est ainsi possible de suivre en temps réel, avec des résolutions de l'ordre de la ms, les variations de la capacité membranaire (Cm) liées aux processus d'exocytose (fusion d'organites intracellulaires avec la membrane plasmique) et d'endocytose (internalisation de portions de la membrane plasmique) par suivi des variations de la capacité membranaire ; lors de l'exocytose, la membrane lipidique des organites intracellulaires qui fusionnent avec la membrane plasmique est mise en continuité électrique avec celle-ci : la capacité membranaire mesurée augmente alors, permettant le suivi du processus.
La technique de mesure de l'exocytose par suivi de la capacité membranaire (Cm) a notamment été menée intensivement dans des cellules neuroendocrines (cellules béta du pancréas ou cellules chromaffines de la médullosurrénale) ou du système immunitaire (mastocyte) qui présentent par rapport aux neurones l'avantage de présenter des géométries simples (sensiblement sphériques et de taille réduite), qui favorisent une fixation spatialement homogène de la tension expérimentalement appliquée (« space-clamp »); à l'inverse, des cellules aux géométries complexes (ex: certains neurones très ramifiés) ou de grandes dimensions (ex: certaines cellules musculaires) rendent la fixation spatiale de la tension difficile (effet de câble) qui expliquent la difficulté d'y mesurer précisément les variations de Cm. Dans certaines cellules présentant de faibles tailles (~ 10/20 µm) et dont les organites intracellulaires sont de grande taille (plusieurs centaines de nm de diamètre ; mastocytes, cellules chromaffines par exemple), le suivi de capacité membranaire peut permettre de mesurer des événements uniques d'exocytose, notamment en configuration « cell-attached ».
Liens externes
- (en) Planar patch clamp
- (en) Description du dispositif
Catégories : Neuroscience | Neurophysiologie | Électrophysiologie
Wikimedia Foundation. 2010.