- Anhydride maléique
-
Anhydride maléique Général Nom IUPAC anhydride cis-butènedioïque Synonymes 2,5-Furanedione No CAS No EINECS SMILES InChI Apparence cristaux incolores ou blancs, d'odeur âcre[1]. Propriétés chimiques Formule brute C4H2O3 [Isomères] Masse molaire[2] 98,0569 ± 0,0042 g·mol-1
C 48,99 %, H 2,06 %, O 48,95 %,Propriétés physiques T° fusion 53 °C[1] T° ébullition 202 °C[1] Solubilité dans l'eau : 400 g·l-1[1] Masse volumique 1,5[1],
1,3 (liquide à 70 °C)T° d'auto-inflammation 475 °C[1] Point d’éclair 102 °C (coupelle fermée)[1] Limites d’explosivité dans l’air 1,4–7,1 % vol[1] Pression de vapeur saturante 20 Pa à 20 °C
25 Pa à 25 °C
45 Pa à 30 °C
200 Pa à 50 °CThermochimie Cp Précautions Directive 67/548/EEC 
CPhrases R : 22, 34, 42/43, Phrases S : (2), 22, 26, 36/37/39, 45, Transport 80 2215 NFPA 704 SIMDUT[4] 
SGH[5] 

DangerÉcotoxicologie Seuil de l’odorat bas : 0,25 ppm
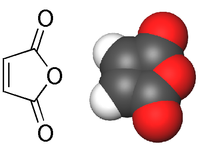
haut : 0,32 ppm[6]Unités du SI & CNTP, sauf indication contraire. L'anhydride maléique (anhydride cis-butènedioïque) est l'anhydride de l'acide maléique (acide carboxylique):
Il se présente généralement sous la forme de cristaux blancs à transparents.
Sommaire
Production et synthèse
Comme son nom l'indique, l'anhydride maléique peut être obtenu par déshydratation de l'acide maléique (hydraté, il donne l'acide maléique). Il a longtemps été synthétisé par oxydation du benzène ou d'autres composés aromatiques. De par l'augmentation ces dernières années du prix du benzène (et de par sa toxicité), il est aujourd'hui majoritairement synthétisé par oxydation du butane grâce à des catalyseurs de type VPO (oxyde mixte de vanadium et de phosphore) :
2 CH3CH2CH2CH3 + 7 O2 → 2 C2H2(CO)2O + 8 H2O Réaction
L'anhydride maléique possède plusieurs propriétés chimiques remarquables dues aux fonctions qu'il présente. Il est entre autres utilisé :
- Pour obtenir l'acide maléique par hydratation. En utilisant à la place de l'eau un alcool, un ester peut être obtenu.
- Comme diénophile dans la réaction de Diels-Alder.
- Comme liguant dans des complexes métalliques (Pt(PPh3)2(AM) ou Fe(CO)4(AM))
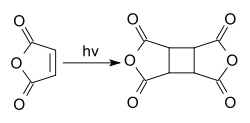
L'anhydride maléique se dimérise lors d'une réaction photochimique[7] en "dianhydride cyclobutanetétracarboxylique", CBTA. Ce composé est utilisé dans la production de polyimides et comme un film d'alignement pour les écrans à cristaux liquides[8],
Références
- ANHYDRIDE MALEIQUE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams, vol. 1, Huston, Texas, Gulf Pub. Co. (ISBN 0-88415-857-8)
- « Anhydride maléique » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 24 avril 2009
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- Maleic anhydride sur hazmap.nlm.nih.gov. Consulté le 14 novembre 2009
- Conditions de la réaction de Horie et al, 2010 : microréacteur, lampe à vapeur de mercure, solvant :acétate d'éthyle, 15 °C.
- Horie, T.; Sumino, M.; Tanaka, T.; Matsushita, Y.; Ichimura, T.; Yoshida, J. I., "Photodimerization of Maleic Anhydride in a Microreactor Without Clogging", 2010, Organic Process Research & Development: 100128104701019. DOI:10.1021/op900306z
Liens externes
Catégories :- Produit chimique corrosif
- Anhydride d'acide
Wikimedia Foundation. 2010.