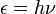- Histoire de la chimie quantique
-
Histoire de la mécanique quantique
 Le modèle quantique d'atome de 1913 de Niels Bohr, incorporant l'explication de la formule de Rydberg de 1888, l'hypothèse quantique de 1900 de Max Planck, i.e. que les radiations d'énergies atomiques ont des valeurs discrètes (ε = hν), le modèle de plum pudding de 1904 de J.J. Thomson, le postulat des quanta de lumière de 1905 d'Albert Einstein et la découverte du noyau atomique positif de 1907 par Ernest Rutherford.
Le modèle quantique d'atome de 1913 de Niels Bohr, incorporant l'explication de la formule de Rydberg de 1888, l'hypothèse quantique de 1900 de Max Planck, i.e. que les radiations d'énergies atomiques ont des valeurs discrètes (ε = hν), le modèle de plum pudding de 1904 de J.J. Thomson, le postulat des quanta de lumière de 1905 d'Albert Einstein et la découverte du noyau atomique positif de 1907 par Ernest Rutherford.
L'histoire de la mécanique quantique commence essentiellement par les évènements suivants : en 1838 avec la découverte des rayons cathodiques par Michael Faraday, durant l'hiver 1859-1860 avec l'énoncé du problème du corps noir par Gustav Kirchhoff, la suggestion en 1877 de Ludwig Boltzmann que les états d'énergie d'un système physique puissent être discrets, et l'hypothèse quantique de Max Planck stipulant que tout système atomique irradiant de l'énergie peut être divisé en « éléments d'énergie » discrets ε tels que chacun de ces éléments est proportionnel à la fréquence ν avec laquelle chacun irradie individuellement son énergie, comme défini dans la formule suivante :
où h est une valeur numérique appelée constante de Planck. En 1905, afin d'expliquer l'effet photoélectrique (1839), c'est-à-dire que l'irradiation lumineuse de certains matériaux puissent en éjecter des électrons, Albert Einstein postula, en se basant sur l'hypothèse quantique de Planck, que la lumière elle-même se composait de particules individuelles quantifiées, appelées par la suite photons (1926). L'expression de « mécanique quantique » fut utilisée pour la première fois en 1924 par Max Born dans son article Zur Quantenmechanik. Dans les années qui suivirent, cette base théorique commença à être appliquée à la structure, à la réactivité et à la liaison chimiques.
Sommaire
Un survol de l'histoire
En bref, en 1900, le physicien allemand Max Planck introduisit l'idée de quantification de l'énergie, afin de proposer une formule pour la dépendance en fréquence observée pour l'énergie émise par le corps noir. En 1905, Albert Einstein expliqua l'effet photoélectrique en postulant que la lumière, ou plus généralement toute radiation électromagnétique, peut être divisé en un nombre fini de « quanta d'énergie » qui sont des points localisés dans l'espace. Dans l'introduction de son article de mars 1905, Sur un point de vue heuristique concernant l'émission et la transformation de la lumière, Albert Einstein indiqua : « Selon le postulat que l'on peut consulter ici, lorsqu'un rayon de lumière est diffusé à partir d'un point, l'énergie n'est pas distribuée continûment sur des espaces toujours croissants, mais consiste en un nombre fini de quanta d'énergie qui sont localisés en des points de l'espace, se déplaçant sans être divisés, et qui peuvent être absorbés ou générés seulement comme un tout. »
Ce postulat a été considéré comme la phrase la plus révolutionnaire écrite par un physicien au cours du XXe siècle siècle[1]. Ces quanta d'énergie seront appelés plus tard « photons », terme introduit par Gilbert Newton Lewis en 1926. L'idée que chaque photon est équivalent à une énergie en termes de quanta est une découverte remarquable car elle supprimait la possibilité pour le rayonnement du corps noir d'atteindre une énergie infinie (phénomène de catastrophe ultraviolette), ce qui était possible s'il était explicité en termes d'ondes seulement. En 1913, Niels Bohr expliqua les raies spectrales de l'atome d'hydrogène, en utilisant de nouveau la quantification, dans son article de juillet 1913 On the Constitution of Atoms and Molecules[2].
Ces théories, bien que pertinentes, étaient strictement phénoménologiques : il n'existait pas de justification rigoureuse pour la quantification (à part peut-être la discussion dans l'article Sur la théorie des quanta de 1912 d'Henri Poincaré). Elles sont connues sous la désignation d'ancienne théorie quantique.
L'expression « physique quantique » fut employée pour la première fois dans le Planck's Universe in Light of Modern Physics de Johnston (1931).En 1924, le physicien français Louis de Broglie proposa sa théorie d'ondes de matière en postulant que les particules pouvaient montrer des caractéristiques ondulatoires, et vice-versa pour la lumière. Cette théorie valait pour toute matière, était directement issue de la théorie de la relativité restreinte, mais n'était pas algébriquement maniable, notamment dans le cadre d'une interaction entre la particule et un champ de force.
Construite sur l'approche de de Broglie, la mécanique quantique moderne naquit en 1925, lorsque les physiciens allemands Werner Heisenberg et Max Born développèrent la mécanique matricielle et le physicien autrichien Erwin Schrödinger inventa la mécanique ondulatoire et proposa l'équation dite de Schödinger non-relativiste comme approximation à la généralisation de la théorie de de Broglie (voir Hanle (1977)). Erwin Schrödinger démontra par la suite que les deux approches étaient équivalentes.
Werner Heisenberg formula son principe d'incertitude en 1927, et l'interprétation de Copenhague commença à prendre forme à peu près à la même époque. À partir de 1926 environ, avec l'équation de Klein-Gordon, puis avec l'équation de Dirac (1927) pour l'électron, commença le processus d'unification de la mécanique quantique et de la relativité restreinte. Cette dernière équation permit la description relativiste de la fonction d'onde électronique que Schrödinger avait échoué à obtenir. Elle prédisait le spin électronique et conduisit Paul Dirac à postuler l'existence du positron. Il initia l'utilisation de la théorie de l'opérateur, y incluant l'influente notation bra-ket, comme décrite dans son fameux livre de 1930. Dans la même période, le mathématicien hongrois John von Neumann formula la base mathématique rigoureuse pour la mécanique quantique comme théorie d'opérateurs linéaires sur des espaces de Hilbert, comme il le décrivit dans son célèbre livre de 1932. Ces travaux, comme d'autres de la période de fondation sont toujours valables et largement utilisés.Le champ plus spécifique de la chimie quantique fut abordé initialement par les physiciens Walter Heitler et Fritz London, qui publièrent une étude de la liaison covalente de la molécule de dihydrogène en 1927. La chimie quantique fut par la suite développée par un nombre importants de chercheurs, comme le chimiste théoricien américain Linus Pauling à Cal Tech, et John Slater dans de nombreuses théories comme la théorie de l'orbitale moléculaire ou la théorie de la valence.
Dès 1927, des essais furent effectués pour appliquer la mécanique quantique à des champs plutôt qu'à de simples particules, donnant naissance à ce qui est connu sous le nom générique de théorie quantique des champs. Des chercheurs comme P.A.M. Dirac, W. Pauli, V. Weisskopf, et P. Jordan comptent parmi les pionniers de cette discipline. Cette voie de recherche atteint son apogée avec la formulation de l'électrodynamique quantique par R.P. Feynman, F. Dyson, J. Schwinger, et S.I. Tomonaga au cours des années 1940. L'électrodynamique quantique est une théorie quantique des électrons, positrons et du champ électromagnétique, et servit de modèle de base pour des théories du champ quantique plus poussées. La théorie de la chromodynamique quantique fut énoncée au début des années 1960. La théorie que nous connaissons aujourd'hui fut formalisée par Politzer, Gross et Wilzcek en 1975. En se basant sur le travail pionnier de Schwinger, Higgs, Goldstone, Glashow, Weinberg et Salam montrèrent de manière indépendante comment la force nucléaire faible et l'électrodynamique quantique pouvaient être fusionnées en la seule force électrofaible.Chronologie
La chronologie suivante montre les étapes clés et les contributeurs dans le développement de la mécanique quantique et la chimie quantique.
Date Personne Contribution 1771 Luigi Galvani Note que les muscles des grenouilles mortes s'agitent lorsqu'elles sont touchées par une décharge, qu'il appela électricité animale. 1800 Alessandro Volta Invente la pile voltaïque, ou « batterie », dans le but de contrer la théorie de Galvani sur l'électricité animale. 1838 Michael Faraday Utilisant la batterie de Volta, il découvrit les rayons cathodiques lorsque, durant une expérience, il fit passer du courant au travers un tube de verre contenant de l'air raréfié et aperçu un arc lumineux étrange partant de l'anode (électrode négative) et se terminant à la cathode (électrode positive). 1852 Edward Frankland Initia la théorie de la valence en proposant que chaque élément chimique posséda une « puissance combinatrice », e.g. certains éléments comme l'azote tend à se combiner à trois autres éléments (e.g. NO3) alors que d'autres peuvent se combiner avec cinq autres éléments (e.g. PO5), et que chaque élément tend à remplir son pouvoir de combinaison (valence) afin de satisfaire ses affinités. 1859 Gustav Kirchhoff Posa le problème du corps noir, c'est-à-dire comme l'intensité du rayonnement électromagnétique émis par un corps noir dépend de la fréquence de la radiation et de la température du corps. 1877 Ludwig Boltzmann Suggéra que les états d'énergie d'un système physique peuvent être discrets. 1879 William Crookes Montra que les rayons cathodiques, contrairement aux rayons lumineux, pouvaient être courbés dans un champ magnétique. 1885 Johann Balmer Découvrit que les quatre bandes visibles du spectre de l'hydrogène pouvaient être assignés à des entiers dans une série. 1888 Johannes Rydberg Modifia la formule de Balmer afin d'inclure d'autres séries de bandes afin de donner la formule de Rydberg. 1891 Alfred Werner Proposa une théorie de l'affinité et de la valence dans laquelle l'affinité est une force attractive issue du centre de l'atome agissant uniformément à partir de toutes les parties de la surface sphérique de l'atome central. 1892 Heinrich Hertz Montra que les rayons cathodiques pouvaient traverser de fines feuilles d'or et produire une luminosité appréciable sur du verre située entre elles. 1896 Henri Becquerel Découvrit la radioactivité, processus durant lequel, en raison de la désintégration nucléaire, certains éléments chimiques ou isotopes émettent spontanément un des trois types d'entités énergétiques : les particules alpha (charge positive), les particules bêta (charge négative), et les particules gamma (charge neutre). 1897 Joseph John Thomson Montra que les rayons cathodiques se courbaient sous l'influence conjuguée d'un champ électrique et d'un champ magnétique et afin de l'expliquer il suggéra que ces rayons cathodiques sont des particules électriques subatomiques chargées négativement ou « corpuscules » (électrons) arrachés de l'atome ; et en 1904, proposa le modèle de plum pudding dans lequel les atomes sont des masses amorphes positivement charges (pudding) dans lesquelles des électrons négativement chargés (raisins) sont dispersés sous la forme d'anneaux tournants non aléatoires. 1900 Max Planck Suggéra, afin d'expliquer le rayonnement du corps noir, que l'énergie électromagnétique ne pouvait être émise que sous forme quantifiée, i.e. que l'énergie pouvait être seulement multiple d'une unité élémentaire E = hν, dans laquelle h est la constante de Planck et ν la fréquence de radiation. 1902 Gilbert N. Lewis Afin d'expliquer la règle de l'octet (1893), développa la théorie de l'atome cubique dans laquelle les électrons, sous formes de points, se positionnaient aux sommets d'un cube et suggéraient que les liaisons covalentes simples, doubles ou triples se produisaient lorsque deux atomes étaient maintenus ensemble par plusieurs paires d'électrons (une pour chaque liaison) localisées entre les deux atomes (1916). 1904 Richard Abegg Remarqua le fait que la différence entre la valence maximale positive, comme par exemple +6 pour H2SO4, et la valence maximale négative, comme par exemple -2 pour H2S, d'un élément tend à être huit (loi d'Abegg). 1905 Albert Einstein Afin d'expliquer l'effet photoélectrique (1839), i.e. que la lumière arrivant sur certains matériaux pouvaient éjecter des électrons de celui-ci, postula à partir de l'hyporthèse quantique de Planck que la lumière elle-même était constituée de particules individuelles quantiques (photons). 1907 Ernest Rutherford Afin de tester le modèle de plum pudding (1904), tira des particules alpha positivement chargées sur une feuille d'or et remarqua que certaines repartaient en arrière, montrant ainsi que les atomes possèdent un noyau atomique de petite taille et chargé positivement en leurs centres. 1913 Niels Bohr Afin d'expliquer la formule de Rydberg (1888), qui modélisait correctement le spectre d'émission lumineuse de l'atome d'hydrogène, supposa que les électrons négativement chargés tournaient autour d'un noyau positivement chargé à certaines distances quantifiées fixes et que chacune de ces « orbites sphériques » possédait une énergie associée telle que les mouvements électroniques entre les orbites nécessitent des émissions ou des absorptions quantifiées d'énergie. 1916 Arnold Sommerfeld Afin de prendre en compte l'effet Zeeman (1896), i.e. que les bandes spectrales d'absorption ou d'émission atomique changent lorsque la lumière est d'abord passée au travers d'un champ magnétique, suggéra qu'il put y avoir des « orbitales elliptiques » dans les atomes en plus des orbitales sphériques. 1919 Irving Langmuir Se basant sur le travail de Lewis (1916), proposa le terme de « covalence » et postula que la formation d'une liaison covalente de coordination lorsque les électrons d'une paire proviennent du même atome. 1922 Stern et Gerlach Proposèrent l'expérience de Stern et Gerlach, durant laquelle les valeurs discrètes de moments angulaires pour des atomes à l'état fondamental sont détectées par passage dans un champ magnétique inhomogène, conduisant à la découverte du spin de l'électron. 1923 Louis de Broglie Postula que les électrons en mouvement sont associés avec des ondes dont les longueurs d'ondes sont données par la constante de Planck h divisée par la quantité de mouvement mv = p de l'électron : λ = h / mv = h / p. 1925 Friedrich Hund Mit en lumière la règle de multiplicité maximale qui indique que lorsque les électrons sont ajoutés successivement à un atome, les niveaux ou orbitales sont occupées par un électron seul tant que c'est possible avant que appariement d'électrons avec spins opposés et fait ainsi la distinction entre les électrons internes dans les molécules restant dans les orbitales atomiques et les électrons de valence se plaçant dans les orbitales moléculaires impliquant les deux noyaux. 1925 Wolfgang Pauli Formula le principe d'exclusion stipulant que deux fermions identiques ne peuvent occuper le même état quantique simultanément. 1926 Erwin Schrödinger Utilisa le postulat d'équivalence onde-matière de de Broglie pour développer une équation d'onde représentant mathématiquement la distribution d'une charge d'un électron sur l'espace, symétrique sphériquement ou proéminente selon certaines directions, i.e. les liaisons de valence dirigées, donnant les valeurs corrects pour les bandes spectrales de l'atome d'hydrogène. 1927 Walter Heitler Utilisa l'équation de Schrödinger pour montrer comment les fonctions d'ondes de deux atomes d'hydrogène se rejoignaient, avec des termes plus, moins et d'échange, pour former une liaison covalente. 1927 Robert Mulliken Travailla à développer, avec Hund, une théorie de l'orbitale moléculaire dans laquelle les électrons étaient assignés à des états s´étendant sur une molécule dans son ensemble et en 1932 introduisit les terminologies d'orbitales moléculaires, comme liaison σ, liaison π, et liaison δ. 1928 Linus Pauling Éclaira la nature de la liaison chimique pour laquelle il utilisa le modèle de liaison covalente quantique de Heitler pour montrer la base quantique de tous les types de structures moléculaires et de liaisons et suggéra que les différents types de liaisons dans les molécules pourraient être égalisées par une permutation rapide des électrons, processus appelé résonance (1931), de tels hybrides de résonance contenant des contributions des différentes configurations électroniques possibles. 1929 John Lennard-Jones Introduisit l'approximation de la combinaison linéaire d'orbitales atomiques pour le calcul des orbitales moléculaires. 1932 Werner Heisenberg Appliqua la théorie des perturbations au problème à deux électrons et montra que la résonance provenant de l'échange électronique pouvait expliquer les forces d'échange. 1938 Charles Coulson Fit le premier calcul précis d'une fonction d'onde d'orbitale moléculaire avec le dihydrogène. 1951 Clemens Roothaan et George Hall Établirent les équations de Roothaan-Hall, donnant une base solide aux méthodes d'orbitales moléculaires. Les expériences « fondatrices »
- Expérience des fentes de Young démontrant la nature ondulatoire de la lumière (1805).
- Découverte de la radioactivité par Henri Becquerel (1896).
- Expériences de Joseph John Thomson sur les rayons cathodiques : découverte de l'électron et de sa charge négative (1897).
- Étude du rayonnement du corps noir entre 1850 et 1900, qui ne peut être expliqué sans concepts de quantification.
- Explication de l'effet photoélectrique par Albert Einstein en 1905 pour laquelle il recevra le prix Nobel de physique, employant les concepts de photons, particules de lumières à énergie quantifiée.
- Expérience de la goutte d'huile de Robert Millikan, montrant la quantification de la charge électrique (1909).
- Expérience d'Ernest Rutherford réfutant le modèle de plum pudding de l'atome qui suggérait que la masse et la charge positive de l'atome était distribuée uniformément (1911).
- Expérience de Stern et Gerlach démontrant la nature quantique du spin (1920).
- Clinton Davisson et Lester Germer démontre la nature ondulatoire de l'électron[3] dans une expérience de diffraction (1927).
- Clyde Cowan et Frederick Reines confirment l'existence du neutrino lors d'une expérience (1955).
- Expérience de double diffraction des électrons de Claus Jönsson (1961).
- Découverte en 1980 de l'effet Hall quantique par Klaus von Klitzing. La version quantifiée de l'effet Hall a permis la définition d'un nouveau standard pratique pour la résistance électrique et pour une détermination extrêmement précise et indépendante de la constante de structure fine.
- Vérification expérimentale de l'intrication quantique par Alain Aspect en 1982.
Références
- ↑ Albrecht Folsing, Albert Einstein: A Biography, trans. Ewald Osers, Viking, 1997
- ↑ En francais : sur la constitution des atomes et molécules.
- ↑ (en) The Davisson-Germer experiment, which demonstrates the wave nature of the electron
Voir aussi
Liens externes
- (en) A History of Quantum Mechanics
- (en) A Brief History of Quantum Mechanics
- (en) Homepage of the Quantum History Project
- (en) Cet article est partiellement ou en totalité issu d’une traduction de l’article de Wikipédia en anglais intitulé « History of quantum mechanics ».
- Portail de la chimie
- Portail de la physique
Catégories : Chimie quantique | Mécanique quantique | Histoire de la chimie | Histoire de la physique
Wikimedia Foundation. 2010.