- 1313-82-2
-
Sulfure de sodium
Sulfure de sodium 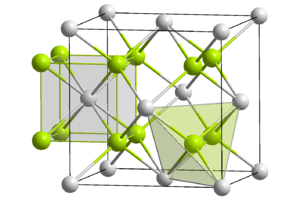
Structure cristalline du sulfure de Sodium
avec en jaune les atomes de sodium
et en blanc les atomes de soufreGénéral Nom IUPAC Sulfure de sodium No CAS (anhydre)
(pentahydrate)
(nonahydrate)
(hydrate)No EINECS Apparence cristaux blancs à jaunes hygroscopiques, d'odeur caractéristique. (anhydre)[1] Propriétés chimiques Formule brute Na2S [Isomères] Masse molaire 78,045 g∙mol-1
Na 58,91 %, S 41,09 %,
nonahydrate: 240.182 g/molPropriétés physiques T° fusion (décomposition) : 920 à 950 °C (anhydre)[1] Solubilité soluble dans l'eau Masse volumique 1.86 g/cm³ (anhydre)[1] T° d’auto-inflammation > 480 °C (anhydre)[1] Précautions Directive 67/548/EEC 
C
NPhrases R : 31, 34, 50, Phrases S : (1/2), 26, 45, 61, Transport - 1385 NFPA 704 SGH[2] 

DangerUnités du SI & CNTP, sauf indication contraire. Le sulfure de sodium est un composé chimique de formule Na2S qu'on trouve couramment sous la forme nonahydraté Na2S.9H2O. Hydraté ou pas, il se présente sous la forme d'un solide blanc soluble dans l'eau et donc les solutions sont fortement basiques. Exposé à l'air humide, il dégage du sulfure d'hydrogène H2S, ce qui lui donne une odeur d'oeuf pourri.
Sommaire
Structure
Le sulfure de sodium adopte une structure cristalline antifluorine. Le sel se dissocie en solution aqueuse mais comme l'ion S2- est une base trop forte,il réagit avec l'eau pour donner l'ion HS-. La réaction de dissolution peut ainsi se résumer par:
Na2S (s) + H2O → 2 Na +(aq) + HS- (aq) + HO- (aq)
Production
On le produit industriellement à partir de sulfate de sodium et de carbone contenu dans la houille suivant la réaction[3] :
Na2SO4 + 4 C → Na2S + 4 CO
En laboratoire, le sel anhydre est préparé par réaction de soufre avec du sodium dans de l'ammoniac liquide anhydre. La réaction peut également être menée dans du THF en présence de traces catalytique de naphtalène. Le bilan est alors:[4]
2 Na + S → Na2S
Sécurité
Le sulfure de sodium est dangereux et ne doit être manipulé que par des experts. Il est fortement corrosif et peut brûler la peau. Il réagit rapidement avec les acides en produisant du sulfure d'hydrogène, gaz toxique.
Notes et références
- (en) Cet article est partiellement ou en totalité issu d’une traduction de l’article de Wikipédia en anglais intitulé « sodium sulfide ».
- ↑ a , b , c et d SULFURE DE SODIUM (ANHYDRE), fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- ↑ Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- ↑ Holleman, A. F.; Wiberg, E. "Inorganic Chemistry" Academic Press: San Diego, 2001. ISBN 0-12-352651-5.
- ↑ J.-H. So and P. Boudjouk, « Hexamethyldisilathiane », dans Inorganic Syntheses, 1992 [lien DOI]
Voir aussi
Articles connexes
- Portail de la chimie
Catégories : Composé du sodium | Produit chimique corrosif | Produit chimique dangereux pour l'environnement | Sulfure
Wikimedia Foundation. 2010.

