- Hemoglobine
-
Hémoglobine
 Forme oxy et désoxy de l'hémoglobine
Forme oxy et désoxy de l'hémoglobine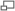
L'hémoglobine est une protéine dont la principale fonction est le transport du dioxygène dans l'organisme humain et chez les autres vertébrés. L'hémoglobine se trouve essentiellement à l'intérieur des globules rouges du sang ce qui leur confère leur couleur rouge. L'hémoglobine est constituée de quatre globines et de quatre molécules d'hème. Le nom d'hémoglobine provient de deux mots : hème et globine. On la symbolise par « Hb ». Une molécule d'hème est constituée d'un ion fer complexé par une porphyrine.
Sommaire
Fonction
 Pourcentage d'hémoglobine ayant fixé du dioxygène, en fonction de la pression partielle en dioxygène.
Pourcentage d'hémoglobine ayant fixé du dioxygène, en fonction de la pression partielle en dioxygène.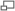
Chez les vertébrés terrestres, l'hémoglobine du sang fixe le dioxygène de l'air des poumons. Grâce à la circulation sanguine, l'hémoglobine oxygénée va être transportée vers l'ensemble des autres organes, pour relâcher par la suite le dioxygène qui sera consommé par les cellules qui en ont besoin. L'hémoglobine permet au sang de contenir plus de dioxygène qu'il ne pourrait par simple dissolution.
Structure
On trouve au cœur de la molécule un cycle hétérogène porphyrique, l'hème, qui contient un ion fer. Cet ion fer est le site de fixation de l'oxygène. Étant donné qu'une sous-unité de l'hémoglobine est formée par un hème enfermé dans une protéine globulaire le nom est très logique. Il y a de nombreuses protéines contenant un hème, mais l'hémoglobine en est la plus connue. L'élément fer peut exister sous 2 formes dans la molécule :
- sous forme ferreuse, ion Fe2+ : seule forme active de l'hémoglobine humaine. On parle d'oxyhémoglobine. (pas d'interactions possibles).
- sous forme ferrique, ion Fe3+ : on parle de méthémoglobine. (interactions possibles)
On peut parler du pouvoir oxyphorique de l'hémoglobine. Ceci correspond à la quantité de dioxygène qu'elle peut fixer. Cette valeur est de 1,34 ml d'O2/g d'Hb.
Hémoglobine humaine
Chez l'homme, l'hémoglobine est un tétramère, constitué de deux globines α et deux globines β liées par des liaisons faibles. Les sous-unités sont structurellement similaires et ont à peu près la même taille. Chaque globine a une masse moléculaire d'environ 17 000 daltons, pour une masse totale d'environ 68 000 daltons. Chaque globine de l'hémoglobine contient un hème, de telle manière que la capacité totale de liaison de l'hémoglobine pour le dioxygène est de quatre molécules.
Étapes de réaction :
- Hb + O2 ↔ HbO2
- HbO2 + O2 ↔ Hb(O2)2
- Hb(O2)2 + O2 ↔ Hb(O2)3
- Hb(O2)3 + O2 ↔ Hb(O2)4
Résumé de la réaction :
- Hb + 4O2 → Hb(O2)4
Une structure de la forme désoxy de l'hémoglobine humaine est donnée par le PDB 1A3N.
En pratique, on n'observe pas ceci :
- Hb + 4O2 ↔ Hb(O2)4
En effet, dans les conditions physiologiques, deux sous-unités sont toujours oxygénées par molécule d'hémoglobine. On peut donc écrire :
- Hb(O2)2 + 2O2 ↔ Hb(O2)4
Valeurs normales chez l'adulte
- Hommes : 13 - 17,87 g/dL de sang ou 8,3 - 10,5 mmol/L de sang.
- Femmes : 12,10 - 16,40 g/dL de sang ou 7,4 - 9,9 mmol/L de sang[1].
Attention, pour la femme enceinte et l'enfant, ce taux diminue considérablement.
Hémoglobine du grand dauphin
La composition de l'hémoglobine du grand dauphin océanique lui permet de rester immergé durant une plus grande période de temps que le grand dauphin vivant plus près des côtes.[2]
Liaison à l'oxygène
Dans la forme tétramérique de l'hémoglobine normale, la liaison avec l'oxygène, ou formation d'oxyhémoglobine, est un procédé coopératif, ou allostérique, où l'affinité de liaison de l'hémoglobine pour l'oxygène est affectée par la saturation en oxygène de la molécule. Cela a pour conséquence que la courbe d'affinité de l'oxygène pour l'hémoglobine a la forme d'une sigmoïde (courbe en forme de S), contrairement à un procédé non coopératif (mickaélien) où elle a une forme hyperbolique.
L'affinité de l'hémoglobine pour l'oxygène décroît en présence de dioxyde de carbone, à pH faible et lorsque la température augmente. Ces propriétés chimiques sont essentielles au vivant puisqu'elles permettent une meilleure libération du dioxygène dans les tissus actifs (ex: le muscle en exercice, par la production de métabolites développe un pH acide, sa température augmente affirmant la dissociation du dioxygène de l'hème). Le dioxyde de carbone réagit avec l'eau pour former du bicarbonate via la réaction:
- CO2 + H2O ↔ HCO3- + H+
Par cette réaction on voit que le sang possédant un haut taux de dioxyde de carbone a aussi un pH plus faible. L'hémoglobine peut se lier aux protons et au dioxyde de carbone ce qui induit un changement de conformation dans la protéine qui facilite la libération de l'oxygène. Le proton peut se lier à différents endroits le long de la protéine, alors que le dioxyde de carbone se lie sur le groupe alpha-amino en formant un carbamate. Ce contrôle porte le nom d'effet Bohr. De la même manière, lorsque le niveau de dioxyde de carbone dans le sang diminue (par exemple près des poumons), le dioxyde de carbone est relâché, augmentant l'affinité de la protéine pour l'oxygène. Ce contrôle de l'affinité de l'oxygène pour sa liaison avec l'hémoglobine et le relâchement du dioxyde de carbone est connu sous le nom d'effet Haldane.
La liaison de l'oxygène est aussi affectée par des molécules telles que le 2,3-diphosphoglycérate, qui diminue l'affinité de l'hémoglobine pour l'oxygène. Chez les personnes acclimatées aux hautes altitudes, la concentration de 2,3-diphosphoglycérate dans le sang est plus importante, ce qui permet à l'hémoglobine de délivrer des quantités d'oxygène plus importantes aux tissus dans des atmosphères pauvres en oxygène.
Poisons de l'hémoglobine
En revanche, avec le monoxyde de carbone CO, l'hémoglobine forme un composé stable, la carboxyhémoglobine ; en outre, l'affinité de l'hémoglobine pour le monoxyde de carbone est supérieure à celle de l'oxygène, ce qui signifie que le CO concurrence efficacement l'oxygène lors de l'oxydation pulmonaire. Le CO constitue donc un antagoniste de O2, pouvant ainsi provoquer une hypoxie tissulaire : son inhalation à forte doses entraîne des malaises, céphalées (maux de tête), puis asthénie (faiblesse intense) et enfin la mort par asphyxie. On traite les empoisonnements au CO sévères par immersion prolongée en caisson hyperbare réduisant ainsi la demie-vie de la carboxyhémoglobine.
Par ailleurs, des agents oxydants tels que les nitrates contenus dans l'eau ou les légumes peuvent oxyder le fer ferreux(Fe2+) de l'hème en fer ferrique (Fe3+), le rendant ainsi incapable de fixer l'oxygène. L'hémoglobine est alors appelée méthémoglobine. Le traitement consiste en l'administration de bleu de méthylène.
Finalement, l'ion cyanure CN- est également un inhibiteur de l'oxydation hémoglobinéique, de même que le sulfure d'hydrogène H2S.
Élimination de l'hémoglobine
Les globules rouges sont phagocytés par les macrophages de la rate et du foie dans les situations pathologiques. Physiologiquement, ils sont plutôt éliminés par les macrophages de la moelle osseuse. Au cours de ce processus, la composante protéique de l'hémoglobine est dégradée sous forme d'acides aminés qui sont recyclés. La composante héminique est dégradée en biliverdine puis en bilirubine insoluble (porphyrine sans fer) de couleur jaune. Le fer est recyclé. La bilirubine insoluble est libérée dans le plasma par les macrophages, où elle se lie à la sérum-albumine. Elle est ainsi acheminée dans la circulation sanguine et captée par les hépatocytes. Elle est alors rendue soluble par une réaction de conjugaison avec une molécule d'acide glucuronique puis est excrétée par le foie dans la bile.
La bile se déverse dans l'intestin et la bilirubine soluble est dégradée par des bactéries en stercobiline de couleur brune, qui donne sa couleur aux selles. La bilirubine est également évacuée dans les urines.
Lorsque la bilirubine ne peut pas être excrétée, sa concentration augmente dans le sang. Elle est alors essentiellement éliminée par les urines, ce qui provoque des urines foncées et des selles décolorées, presque blanches.
Utilisation clinique
En médecine, plusieurs termes se rapportent à l'hémoglobine :
- Le taux d'hémoglobine est exprimé en g/100 mL. Les valeurs normales du taux d'hémoglobine dépendent du sexe et de l'âge du sujet. Un taux d'hémoglobine inférieur à la norme définit une anémie.
- La saturation SaO2 définie en % est calculée par la quantité d'oxyhémoglobine divisé par la quantité totale d'hémoglobine du sang. La saturation SaO2 peut être mesurée sur du sang veineux ou du sang artériel. La saturation en oxygène du sang est un des paramètres d'un examen appelé gaz du sang. La valeur de la saturation est considérée comme dangereuse si elle est inférieure à 90 % pour du sang artériel. La valeur normale est de 100 % pour des conditions atmosphériques normales. À cette valeur, on parle de capacité en O2 du sang.
- La cyanose est un signe clinique. Il s'agit de la coloration bleutée des téguments. Elle apparaît lorsque la concentration en hémoglobine réduite dépasse les 5 g/100 mL de sang capillaire. Elle peut être masquée par une anémie.
Molécules analogues
La molécule d'hème de l'hémoglobine ressemble à la chlorophylle, l'atome de fer étant remplacé par un atome de magnésium, ce qui lui apporte sa couleur verte. Chez les invertébrés, l'hémocyanine joue un rôle analogue à l'hémoglobine.
Maladies génétiques de l'hémoglobine
Notes et références
- ↑ [http:http://www.has-sante.fr/portail/upload/docs/application/pdf/Hemogram.pdf ]
- ↑ (en) Hersh, Sandra L. et Deborah A. Duffield, article intitulé Distinction Between Northwest Atlantic Offshore and Coastal Bottlenose Dolphins Based on Hemoglobin Profile and Morphometry, inclus dans le livre The Bottlenose Dolphin, dirigé par Stephen Leatherwood et Randall R. Reeves, pages 129-139, San Diego, Academic Press|, 1990, ISBN 0-12-440280-1
Voir aussi
- Portail de la biologie cellulaire et moléculaire
- Portail de la biochimie
Catégories : Hémoprotéine | Physiologie en hématologie | Hémogramme | Sang
Wikimedia Foundation. 2010.


