- Quinoléine
-
Quinoléine 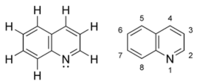
Général Synonymes Benzo(b)pyridine
Leucoline
QuinolineNo CAS No EINECS PubChem No E E104 FEMA SMILES InChI Apparence liquide hygroscopique incolore, d'odeur caractéristique. brunit lors d'exposition à la lumière[1]. Propriétés chimiques Formule brute C9H7N [Isomères] Masse molaire[4] 129,1586 ± 0,0079 g·mol-1
C 83,69 %, H 5,46 %, N 10,84 %,Moment dipolaire 2,29 ± 0,11 D [2] Diamètre moléculaire 0,623 nm [3] Propriétés physiques T° fusion -15 °C[1] T° ébullition 237,7 °C à 760 mmHg
163,2 °C à 100 mmHg
136,7 °C à 40 mmHg
119,8 °C à 20 mmHg
103,8 °C à 10 mmHg
89,6 °C à 5 mmHg
59,7 °C à 1,0 mmHgSolubilité Peu sol dans l'eau froide.
Sol dans l'eau chaude.
Miscible avec l'éther,
l'éthanol,
le disulfure de carbone.
Dissout le soufre,
le phosphore,
le trioxyde d'arsenic.Masse volumique 1,093 g·ml-1 à 25 °C T° d'auto-inflammation 480 °C[1] Point d’éclair 105 °C[1] Limites d’explosivité dans l’air 1,2–7 %vol[1] Pression de vapeur saturante à 20 °C : 100 Pa[1] Point critique 508,85 °C [5] Thermochimie Cp Propriétés optiques Indice de réfraction  1,624 [3]
1,624 [3]Précautions Directive 67/548/EEC 
XnPhrases R : 21/22, 38, 41, Phrases S : 26, 36/37/39, Transport - 2656 NFPA 704 SIMDUT[7] Produit non classifié Écotoxicologie DL50 460 mg·kg-1 (rat, oral) LogP 2,06[1] Seuil de l’odorat bas : 71 ppm[8] Classe thérapeutique antipaludique Sulfate de quinoléine Général No CAS No EINECS Apparence poudre cristalline
blanche à gris-blancPropriétés chimiques Formule brute C9H9NO4S Masse molaire[9] 227,237 ± 0,014 g·mol-1
C 47,57 %, H 3,99 %, N 6,16 %, O 28,16 %, S 14,11 %,Propriétés physiques T° fusion 163 à 165 °C Solubilité 1–5 mg·ml-1 eau à 20 °C.
1 g/50ml éthanol absolu
froid,
1 g/9ml éthanol absolu
bouillantChlorure de quinoléine Général No CAS No EINECS PubChem SMILES InChI Apparence cristaux blancs
déliquescentsPropriétés chimiques Formule brute C9H8ClN Masse molaire[10] 165,62 ± 0,01 g·mol-1
C 65,27 %, H 4,87 %, Cl 21,41 %, N 8,46 %,Propriétés physiques T° ébullition 234,1 °C à 760 mmHg Solubilité Sol dans l'eau, l'éthanol,
le benzène chaud,
le chloroforme.
Peu sol dans l'éther froid.Point d’éclair 101,1 °C Pression de vapeur saturante 0,0822 mmHg à 25 °C Salicylate de quinoléine Général PubChem SMILES InChI Apparence poudre cristalline
rouge-grisPropriétés chimiques Formule brute C16H13NO3 [Isomères] Masse molaire[11] 267,2793 ± 0,0148 g·mol-1
C 71,9 %, H 4,9 %, N 5,24 %, O 17,96 %,Propriétés physiques T° ébullition 234,1 °C à 760 mmHg Solubilité Sol dans 80 parts d'eau.
Sol dans l'éthanol,
le benzène, l'éther,
le glycérol, les huilesPoint d’éclair 101,1 °C Pression de vapeur saturante 0,0822 mmHg à 25 °C Tartrate de quinoléine Général Apparence cristaux blancs Propriétés chimiques Formule brute C43H45N3O24 Masse molaire[12] 987,8231 ± 0,0454 g·mol-1
C 52,28 %, H 4,59 %, N 4,25 %, O 38,87 %,Propriétés physiques T° fusion décomposition à 125 °C Solubilité Sol dans 80 parts d'eau,
150 parts d'éthanol.
Insol dans l'étherUnités du SI & CNTP, sauf indication contraire. La quinoléine, également nommée leucoline, 1-azanaphthalène, 1-benzazine, ou benzo[b]pyridine, est un composé organique aromatique hétérocyclique de formule chimique C9H7N. Elle peut être décrite schématiquement comme étant formée par la "soudure" d'une molécule de benzène et d'une molécule de pyridine. C'est un liquide incolore hygroscopique possédant une odeur forte.
Sommaire
Propriétés physico-chimiques
La quinoléine est peu soluble dans l'eau, mais sa solubilité dans les solvants organiques est bonne. Lorsqu'elle est exposée à la lumière, elle devient jaune, puis brune. C'est une base très faible de pKa 4,94.
Découverte
La quinoléine a été extraite pour la première fois par F. Runge en 1834 du goudron de houille dans lequel elle est naturellement présente. Runge extrait de la houille trois huiles qu'il nomma selon leur coloration à la chaux: le Kyanol ou Blauöl (huile bleue, aniline), le Pyrrol ou Rothöl (huile rouge, pyrrole) et le Leukol ou Weissöl (huile blanche). Peu de temps plus tard, en 1842, Charles Frédéric Gerhardt obtint par distillation alcaline de la quinine une huile incolore qu'il appela d'abord Chinoilin (huile de quinine), puis Chinolein. Celle-ci s'avéra identique au Leukol de Runge et donna par la suite son nom au composé. Comme cette huile pouvait facilement s'obtenir en grandes quantités à partir de la houille, la chimie de synthèse avec pour objet le développement d'analogues de la quinine tels que la chloroquine fut grandement favorisée.
La quinoléine est également présente naturellement dans les Rutaceae poussant en Amérique du Sud, ainsi que, fait rarissime dans le monde animal, chez certains phasmes (Insecta - Phasmatodea) comme Oreophoetes peruana (Saussure, 1868), également connu sous le nom de Phasme du Pérou, qui secrète s'il est dérangé un liquide blanc riche en quinoléine par deux glandes située sur le prothorax.
Production
Elle peut être synthétisée par une méthode connue sous le nom de synthèse de Skraup, à partir de sulfate de fer(II), de glycérol, d'aniline, de nitrobenzène et d'acide sulfurique. Elle peut aussi être préparé par la réaction de Povarov à partir d'aniline, de benzaldéhyde et d'un alcène activé. D'autres méthodes de synthèse existent qui sont des dérivés de la synthèse de Skraup qui utilisent des agents d'oxydation différents.
Utilisation
La quinoléine est utilisé dans des procédés métallurgiques, ainsi que dans la fabrication de polymères, de colorants et de produits agrochimiques. Elle est également utilisée comme solvant, comme désinfectant et comme conservateur alimentaire, par exemple E324 (Ethoxyquine) est un conservateur et pesticide de la famille de la quinoléine.
Le colorant jaune de quinoléine est codé E104 et répertorié comme colorant alimentaire par le Codex Alimentarius. Plusieurs médicaments ou composés à propriétés pharmaceutiques potentielles comportent le motif de base quinoléine.
Sécurité
La quinoléine est toxique. Une exposition courte à ses vapeurs peut entraîner une irritation du nez, des yeux et de la gorge, ainsi que des vertiges et la nausée. Les effets à long terme sont moins bien connus, mais des études ont mis en évidence un lien entre la quinoléine et des affections du foie. Elle pourrait également avoir un effet cancérogène et mutagène.
phrases de risques et conseils de prudence
- R: 20 (Nocif par inhalation)
- R: 21 (Nocif par contact avec la peau)
- R: 22 (Nocif en cas d’ingestion)
- R: 36 (Irritant pour les yeux)
- R: 37 (Irritant pour les voies respiratoires)
- R: 38 (Irritant pour la peau)
- R: 41 (Risque de lésions oculaires graves)
- R: 40 (Effet cancérogène suspecté : preuves insuffisantes)
- S: 26 (En cas de contact avec les yeux, laver immédiatement consulter un ophtalmologiste)
- S: 23 (Ne pas respirer les gaz/fumées/vapeurs/aérosols (terme(s) approprié(s) à indiquer par le fabricant))
- S: 36 (Porter un vêtement de protection approprié)
Notes et références
- QUINOLEINE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- (en) David R. Lide, Handbook of chemistry and physics, CRC, 16 juin 2008, 89e éd., 2736 p. (ISBN 142006679X et 978-1420066791), p. 9-50
- (en) Yitzhak Marcus, The Properties of Solvents, vol. 4, England, John Wiley & Sons Ltd, 1999, 239 p. (ISBN 0-471-98369-1)
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- Properties of Various Gases sur flexwareinc.com. Consulté le 12 avril 2010
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams, vol. 3, Huston, Texas, Gulf Pub. Co. (ISBN 0-88415-859-4)
- « Quinoléine » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- Quinoline sur hazmap.nlm.nih.gov. Consulté le 14 novembre 2009
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
Voir aussi
Articles connexes
- Benzène
- Pyridine
- Isoquinoline (analogue de la quinoléine pour lequel l'atome d'azote est en position 2)
- Naphtalène (analogue de la quinoléine sans l'atome d'azote)
Liens externes
- Rapport toxicologique de l'agence de protection de l'environnement américaine (anglais)
- Fiche internationale de sécurité
Catégories :- Produit chimique nocif
- Quinoléine
- Noyau aromatique simple
Wikimedia Foundation. 2010.




