- Isoprène
-
Isoprène 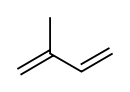
formule développée et modèle 3D de l'isoprèneGénéral Nom IUPAC 2-méthylbut-1,3-diène No CAS No EINECS PubChem SMILES InChI Apparence liquide incolore tres volatil, d'odeur caractéristique[1]. Propriétés chimiques Formule brute C5H8 [Isomères] Masse molaire[3] 68,117 ± 0,0046 g·mol-1
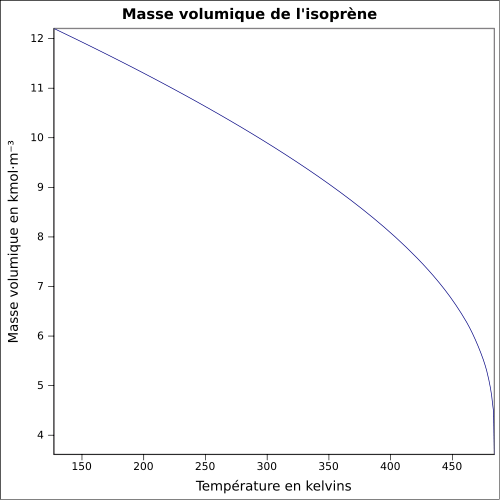
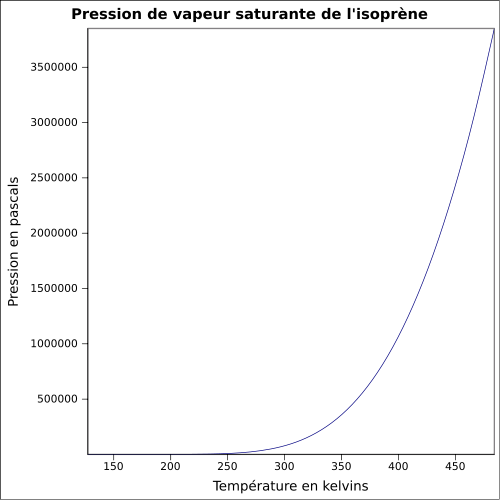
C 88,16 %, H 11,84 %,Moment dipolaire 0,25 ± 0,01 D [2] Propriétés physiques T° fusion -146 °C [1] T° ébullition 34,05 °C [4] Solubilité dans l'eau : nulle[1] Masse volumique 0,6806 g·cm-3 [5] T° d'auto-inflammation 220 °C [1] Point d’éclair -54 °C (coupelle fermée)[1] Limites d’explosivité dans l’air 1,5–8,9 %vol [1] Pression de vapeur saturante à 20 °C : 53,2 kPa [1] Point critique 206,05 °C [4], 38,5 bar [7] Thermochimie Cp Propriétés électroniques 1re énergie d'ionisation 8,84 ± 0,01 eV (gaz)[8] Propriétés optiques Indice de réfraction  1,4194 [5]
1,4194 [5]Précautions Directive 67/548/EEC 
T
F+Phrases R : 12, 45, 52/53, 68, Phrases S : 45, 53, 61, [9] Transport - 1218 NFPA 704 SIMDUT[11] Produit non classifié SGH[12] 

DangerClassification du CIRC Groupe 2B : Peut-être cancérogène pour l'homme[10] Écotoxicologie LogP 2,30[1] Unités du SI & CNTP, sauf indication contraire. L'isoprène est un synonyme commun du composé chimique 2-méthylbuta-1,3-diène. C'est un des quatre isomères du pentadiène qui possède des doubles liaisons conjuguées. À température ordinaire, c’est un liquide incolore volatil et odorant, facilement inflammable susceptible de former des mélanges explosifs avec l'air. Il est soluble dans l'alcool, l'acétone et le benzène.
Ce monomère peut polymériser en caoutchouc. En raison de sa grande réactivité, cette polymérisation peut devenir explosive sous l'action de la température. L'isoprène est toxique s'il est présent en grandes quantités. On le considère comme un polluant s'il est perdu en quantité significative par un process industriel.
L'isoprène a été découvert et isolé à partir de la décomposition thermique du caoutchouc naturel en 1860 [13].
Sommaire
Présence dans l'environnement naturel
L'isoprène semble largement répandu, en faibles concentrations, dans la nature et dans certains de nos aliments.
- Les plantes le produisent dans leurs chloroplastes, à partir du DMAPP (Dimethylallyl pyrophosphate). Le caoutchouc naturel (latex ou gutta-percha qui ont des propriétés différentes[14]...) est par exemple un polymère de l'isoprène.
- Les animaux et le corps humain en produisent aussi (Le corps d'une personne de 70 kg en produirait environ 17 mg/jour).
Rôles biologiques à l'échelle de la cellule
Il intervient dans la structure de nombreux composés biologiques. À titre d'exemple dans les terpènes comme le carotène (tétraterpène) qui sont dérivés de l'isoprène.
- Autres dérivés de l'isoprène
- phytol
- rétinol
- vitamine A
- dolichols
- vitamine E
- squalène
- hème
- lanostérol
Rôle écologique, aux échelles écopaysagères
Selon le UK Natural Environment Research Council (NERC), de l'isoprène est émis par les plantes vasculaires en cas de température extrême. Il interagit alors avec l'ozone troposphérique toxique (en le détruisant, mais il réagit aussi avec l'oxyde d'azote en présence de lumière et redonne de l'ozone). De nombreuses espèces d'arbres (Le chêne en produit par exemple de grandes quantité) le relarguent dans l'atmosphère, sous forme gazeuse par les stomates de leurs feuilles. La végétation planétaire en émettrait environ 600 millions de tonnes, dont 50 % provenant de feuillus et arbustes tropicaux[15].
Une fois dans l'air, l'isoprène est converti en particules époxydes par des radicaux libres tels que le radical hydroxyle (OH). Il contribue alors à produire des aérosols impliqués dans la constitution de microclimats. Ces aérosols contribuent en effet à nucléer les gouttelettes d'eau qui forment des brumes ou des nuages puis les gouttes de pluie[16],[17].
Cela semble être un des mécanismes développés par les forêts pour surmonter la surchauffe des feuilles ou une irradiation excessive par les UV. Ce pourrait aussi être un des moyens pour les arbres de lutter contre les radicaux libres les plus agressifs pour les feuilles, dont l'ozone[18].
Usages
L'isoprène, plus chimiquement actif que le butadiène, est très utilisé dans l'industrie chimique ; obtenu à partir du cracquage de naphta, il sert essentiellement à la production du cis-1,4-polyisoprène, un caoutchouc synthétique utilisé dans la fabrication des pneumatiques de voitures et des gants de chirurgie.
Les molécules de caoutchouc sont constituées de chaines de plusieurs milliers de maillons -CH2 – C(CH3) = CH – CH2 … La masse moléculaire du polymère peut varier de 100 000 à 1 million. Si le caoutchouc naturel est de bonne qualité, il renferme en outre des traces d'autres substances : protéines, acides gras, résines.... Dans d'autres caoutchoucs naturels, on peut trouver son isomère de structure, le trans-1,4-polyisoprene, qui lui confères des propriétés similaires mais néanmoins différentes. Par exemple une résine, la gutta-percha est un polymère naturel « tout trans » de l'isoprène.
Obtention
On le produit industriellement :
- par synthèse à partir d'hydrocarbures.
- par déshydrogénation.
- par dimérisation du propylène suivie d'une isomérisation et d'une déméthylation.
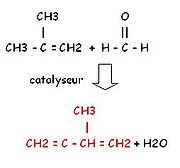
- par action du méthylpropène (isomère du butène) sur le formaldéhyde.
- par craquage d'essences légères.
Il est le plus facilement disponible industriellement comme sous-produit du craquage du naphte ou pétrole, comme sous-produit de la production d'éthylène.
Environ 20 000 tonnes sont produits annuellement par l'industrie[14] dont 95 % sert à produire du cis-1,4-polyisoprène (caoutchouc synthétique).
Voir aussi
Articles connexes
Bibliographie
- (en) Merck Index : An Encyclopedia of chemicals, drugs, and biologicals, Susan Budavari (ed.), 11th Edition, Rahway, NJ : Merck, 1989, ISBN 0-911910-28-X
- (en) N. Poisson, « Impact of nonmethanehydrocarbons on tropospheric chemistry and the oxidizing power of the global troposphere: 3-dimensional modelling results », dans Journal of Atmospheric Chemistry, vol. 36, no 2, 2000, p. 157–230 (ISSN 0167-7764) [lien DOI]
- (en) M. Claeys, « Formation of secondary organic aerosols through photooxidation of isoprene », dans Science, vol. 303, no 5661, 2004, p. 1173–1176 (ISSN 0036-8075) [lien PMID, lien DOI]
- (en) P. A. Pier, « Seasonal isoprene emission rates and model comparisons using whole-tree emissions from white oak », dans Journal of Geophysical Research, vol. 102, no D20, 1997, p. 23,963–23,971 (ISSN 0148-0227) [lien DOI]
- (en) U. Poschl, « Development and intercomparison of condensed isoprene oxidation mechanisms for global atmospheric modeling », dans Journal of Atmospheric Chemistry, vol. 37, no 1, 2000, p. 29–52 (ISSN 0167-7764) [lien DOI]
- (en) R. K. Monson, « Biospheric trace gas fluxes and their control over tropospheric chemistry », dans Annual Review of Ecology and Systematics, vol. 32, 2001, p. 547–576 [lien DOI]
Lien externe
Notes et références
The Merck Index, Quatorzième édition, ISBN 978-0911910001.
- ISOPRENE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- (en) David R. Lide, Handbook of chemistry and physics, CRC, 16 juin 2008, 89e éd., 2736 p. (ISBN 142006679X et 978-1420066791), p. 9-50
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- (en) Iwona Owczarek et Krystyna Blazej, « Recommended Critical Temperatures. Part I. Aliphatic Hydrocarbons », dans J. Phys. Chem. Ref. Data, vol. 32, no 4, 4 août 2003, p. 1411 [lien DOI]
- (en) J. G. Speight, Norbert Adolph Lange, Lange's handbook of chemistry, McGraw-Hill, 2005, 16e éd., 1623 p. (ISBN 0071432205), p. 2.289
- (en) Robert H. Perry et Donald W. Green, Perry's Chemical Engineers' Handbook, USA, McGraw-Hill, 1997, 7e éd., 2400 p. (ISBN 0-07-049841-5), p. 2-50
- Properties of Various Gases sur flexwareinc.com. Consulté le 12 avril 2010
- (en) David R. Lide, Handbook of chemistry and physics, CRC, 2008, 89e éd., 2736 p. (ISBN 9781420066791), p. 10-205
- « isoprène » sur ESIS, consulté le 15 février 2009
- IARC Working Group on the Evaluation of Carcinogenic Risks to Humans, « Evaluations Globales de la Cancérogénicité pour l'Homme, Groupe 2B : Peut-être cancérogènes pour l'homme » sur http://monographs.iarc.fr, CIRC, 16 janvier 2009. Consulté le 22 août 2009
- « Isoprène » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- C. G. Williams, Proceedings of the Royal Society 1860 10.
- Hans Martin Weitz and Eckhard Loser “Isoprene” in Ullmann's Encyclopedia of Industrial Chemistry 2002, Wiley-VCH, Weinheim. DOI:10.1002/14356007.a14_627
- A. Guenther & T. Karl, P. Harley, C. Wiedinmyer, P. I. Palmer and C. Geron ; Estimates of global terrestrial isoprene emissions using MEGAN (Model of Emissions of Gases and Aerosols from nature) ; 2006 ; Journal: Atmos. Chem. Phys. ; volume 6 ; pages 3181–3210
- Organic Carbon Compounds Emitted By Trees Affect Air Quality ScienceDaily,2009 08 07
- A source of haze ; ScienceNews ; 2009 08 06
- TD. Sharkey, AE Wiberley & AR Donohue ; 2007 Isoprene Emission from Plants : Why and How ; Annals of Botany ; volume=101 ; issue=1 ; pages=5-18 ; doi=10.1093/aob/mcm240|pmid=17921528
Wikimedia Foundation. 2010.