- Hépathite B
-
Hépatite B
L'hépatite B est une hépatite virale due à une infection par le virus de l'hépatite B (VHB) et entrainant une inflammation du foie.
Les symptômes de la maladie aiguë sont essentiellement une inflammation du foie, avec ou sans ictère et des troubles digestifs avec nausées et vomissements, à ce stade l’évolution est souvent bénigne même si l’hépatite B est la forme la plus grave des hépatites virales, mais il existe, bien que rarement, des formes fulminantes à évolution mortelle. L'infection passe souvent inaperçue lors de l'infection aigue et chez le patient porteur du virus. Dans près d'un cas sur dix, l'hépatite B aiguë ne guérit pas et devient une infection chronique. Le porteur chronique n'a pas de symptôme apparent mais est susceptible de contaminer son entourage. En cas d'hépatite chronique active, les symptômes peuvent être une fièvre modérée, une grande fatigue, des troubles digestifs (nausées, vomissements, douleurs abdominales), une jaunisse, des urines foncées ou des selles décolorées.
La gravité potentielle de l’hépatite B est constituée par le risque d’évolution vers une hépatite chronique B qui peut se compliquer d’une cirrhose du foie et d’un cancer du foie, une maladie mortelle avec un taux de réponse très faible à la chimiothérapie actuelle[1].
La transmission du virus se fait par l'intermédiaire des liquides et sécrétions biologiques. Les principaux modes de transmission sont les rapports sexuels, les injections chez les toxicomanes, les transfusions sanguines à risques, la transmission de la mère à l'enfant lors de l'accouchement et le contact étroit avec une personne infectée. Une fois dans le sang, le virus atteint le foie et se multiplie dans ses cellules, les hépatocytes. Le système immunitaire détruit les cellules infectées, entrainant une inflammation du foie.
Il s'agit d'un virus à ADN responsable d’une forme particulière d’hépatite virale, une maladie initialement connue sous le nom d’hépatite sérique[2] et à l’origine d’épidémies dans certaines parties de l’Asie et de l’Afrique. L'hépatite B est endémique en Chine et diverses autres parties de l’Asie[3] .
L'hépatite B est l'une des maladies humaines les plus fréquentes. La proportion de la population mondiale actuellement infectée par le virus est estimée, suivant les différentes évaluations entre 3 et 6%, mais jusqu'à un tiers de la population a été exposé. Dans le monde en 2005, environ 2 milliards de personnes ont été infectées dont plus de 350 millions deviennent des porteurs chroniques pouvant transmettre le virus pendant des années. Ces porteurs chroniques ont un risque élevé de décéder des suites d'une cirrhose du foie ou d'un cancer du foie, ces deux maladies faisant environ un million de morts chaque année[4].
Le virus de l'hépatite B est le seul virus provoquant une hépatite virale chronique contre lequel on dispose d'un vaccin[5].
Virus de l'hépatite B
Article détaillé : Virus de l'hépatite B.Structure
Le virus de l'hépatite B (VHB) est un virus à ADN appartenant à la famille des Hepadnaviridae[6]. La particule virale (virion) se compose d'une enveloppe extérieure lipidique et d’un noyau, un nucléocapside de forme icosaédrique composé de protéines. Le nucléocapside entoure l’ADN viral et une ADN polymérase, qui a une activité de Transcriptase inverse.
Le VHB, comme le Virus de l’Hépatite C (VHC), peut survivre à la dessiccation contrairement au VIH. Le VHB est encore infectieux après sept jours de dessiccation, alors que le VHC reste infectieux pendant quelques semaines. Il résiste également à des procédés de stérilisation à température insuffisante .
Le réservoir du virus de l’hépatite B est humain et la contagiosité élevée du virus, 50 à 100 fois supérieure à celle du VIH. Dans le sang d'un malade en phase active de synthèse virale, on peut observer 3 types de structures :
- des sphères de 20 nm de diamètre, constituées d'antigène HBs, non infectieuses.
- des tubules de 20 nm de diamètre et de 200 à 700 nm de long qui sont un empilement des sphères, non infectieuses
- des « particules de Dane » de 42 nm de diamètre, correspondant aux particules virales complètes et infectieuses, constituées d'un noyau (nucléocapside contenant un ADN double brin associé à une ADN polymérase) ainsi que d'une enveloppe protéique[7].
L'enveloppe extérieure contient des protéines qui protègent la structure virale, et lui permettent de pénétrer dans les cellules cibles. Ces particules ne sont pas infectieuses et sont composées de lipides et de protéines, qui font partie de la surface du virion, qu’on appelle l'antigène de surface (AgHBs), et qui est produit en excès pendant la durée de vie du virus[8].
Génome
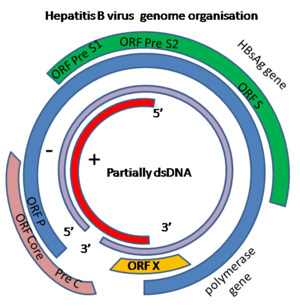
Le génome du virus de l'hépatite B est fait d’ADN circulaire, mais il est inhabituel parce que l'ADN n'est pas totalement bicaténaire. Une extrémité est liée à l’ADN polymérase du virus. Le génome est composé de 3020 à 3320 nucléotides (pour le brin le plus long) et de 1700 à 2800 nucléotides (pour le brin le plus court)[9]. La partie enroulée en sens négatif, (non codante), est complémentaire de l'ARNm viral. L'ADN viral est retrouvé dans le noyau peu de temps après l'infection de la cellule. La partie d'ADN double brin est rendue totalement bicaténaire par l'appariement du brin (+) et l'élimination d'une molécule de protéine du brin (-) et d’une courte séquence d'ARN à partir du brin (+).Les bases non codantes se retirent de l’extrémité du brin (-) et les brins sont appariés. Il existe quatre gènes codants connus dans le génome, ils sont appelés C, X, P et S. La protéine du core est codée par le gène C (AgHBc), et son codon de départ est précédé par un autre codon en amont de formule AUG qui initie la production de la protéine pré-core. L’AgHBe est produit par traitement protéolytique de la protéine du pré-core. L'ADN polymérase est codée par des gènes p. Le Gène S est le gène qui code l'antigène de surface (AgHBs). Le gène AgHBs est une longue suite de nucléotides codants, mais qui contient trois séries de codons "start" (ATG) qui divisent le gène en trois sections, pré-S1, pré-S2, et S. En raison des multiples codons de départ, il se forme des polypeptides de trois tailles différentes, grande, moyenne et petite (pré-S1 + pré-S2 + S, pré-S2 + S, ou S) [10]. La fonction de la protéine codée par le gène X n'est pas totalement élucidée[11].
Réplication
Le cycle de vie du virus de l'hépatite B est complexe. L'hépatite B est l'un des rares virus connus en dehors des rétrovirus qui utilise la transcription inverse dans le cadre de son processus de réplication. Le virus parvient à se fixer sur la cellule en se liant à un récepteur situé sur la surface de la cellule et entre par endocytose. Parce que le virus se réplique sous l’action de l'ARN commandé par une enzyme de la cellule hôte, l'ADN du génome viral doit être transféré dans le noyau de la cellule hôte par des protéines appelées chaperons moléculaires. La partie partiellement bicaténaire de l’ADN viral devient alors totalement à double brin et se transforme en anneau fermé d’’ADN (cccDNA) superenroulé qui sert de matrice pour la transcription de quatre ARNm viraux. Le plus grand ARNm, (qui est plus long que le génome viral), est utilisé pour faire de nouvelles copies du génome et pour fabriquer la capside du noyau de protéines et l’ADN polymérase virale. Ces quatre transcriptions virales subissent un traitement supplémentaire pour former des virions qui sont libérés par la cellule ou retournent dans le noyau et son recyclées pour produire d’autres copies[10],[12]. Le long ARNm retourne ensuite vers le cytoplasme où la protéine P du virion synthétise l'ADN par l'intermédiaire de son activité de transcriptase inverse.
Sérotypes
Le virus est divisé en quatre grands sérotypes (adr, adw, Ayr, ayw) sur la base des Épitopes antigéniques présents sur les protéines de son enveloppe, et en huit génotypes (AH), conformément à l'ensemble des variations de la séquence de nucléotides du génome. Les génotypes ont une répartition géographique et sont utilisés pour retrouver la trace de l'évolution et de la transmission du virus. Les différences entre les génotypes affectent la gravité de la maladie, son cours évolutif, les risques de complications, et la réponse au traitement et peut-être à la vaccination[13],[14].
Historique
La première épidémie enregistrée comme provoquée par le virus de l'hépatite B a été observée par Lurman en 1885[15]. Un foyer de variole a été signalé à Brême en 1883 et 1289 employés des chantiers navals ont été vaccinés avec la lymphe d'autres personnes. Après plusieurs semaines, et jusqu'à huit mois plus tard, 191 des travailleurs vaccinés sont tombés malades et ont présenté un ictère et on a alors diagnostiqué une hépatite sérique. Les autres employés qui avaient été inoculés avec des lots de lymphe différents sont restés en bonne santé. La publication de Lurman, aujourd'hui considérée comme un exemple classique d'étude épidémiologique, a prouvé que la contamination lymphatique était à l'origine de l’épidémie. Plus tard, de nombreux cas similaires ont été signalés suite à l'introduction, en 1909, des aiguilles hypodermiques qui ont été utilisées et réutilisées de nombreuses fois, pour l'administration de Salvarsan pour le traitement de la syphilis. Bien que l’existence d’un virus ait été soupçonnée depuis les travaux de MacCallum en 1947[16], Dane et ses collaborateurs découvrent en 1970 les particules du virus au microscope électronique[17]. Au début des années 1980 le génome du virus a été séquencé[18] et les premiers vaccins ont été expérimentés[19].
Le virus n'a été découvert qu'en 1963, quand Baruch Blumberg, un généticien travaillant alors au National Institutes of Health (NIH) aux États-Unis, a mis en évidence une réaction inhabituelle entre le sérum d’individus polytransfusés et celui d’un aborigène australien. Il pensa avoir découvert une nouvelle lipoprotéine dans la population autochtone qu’il désigna sous le nom d’antigène « Australia ».(connu plus tard sous le nom d’antigène de surface de l'hépatite B, ou AgHBs)[20].
En 1967, après plusieurs études, Blumberg publia un article[21] montrant la relation entre cet antigène et l’hépatite. Le nom d’antigène HBs fut, par la suite, imposé pour désigner cet antigène. Blumberg reçut en 1976 le prix Nobel de médecine pour la découverte de cet antigène et pour la conception de la première génération de vaccins contre l’hépatite.
Durée d'incubation
La période d'incubation varie de 45 à 180 jours, mais la moyenne est de 60 à 90 jours, la durée pouvant augmenter ou diminuer selon la gravité de l'infection.
Modes de contamination et modalités de transmission
La transmission de la maladie résulte d’une exposition au sang infectieux ou à des liquides organiques contenant du sang. Parmi les voies possibles de transmission on note (mais la liste n’est pas limitative) :
- transmission par transfusions sanguines ou administration de produits sanguins (rare depuis l'exclusion des donneurs AgHBs + et Ac anti-HBc +).
- transmission iatrogène par matériel non stérilisé (chirurgie, exploration invasive, acupuncture, mésothérapie, soins dentaires) ; L'évolution des règles de stérilisation et la généralisation de l'utilisation de matériel à usage unique permettent de l'éviter.
- transmission par toxicomanie intraveineuse, tatouage, piercing.
- transmission sexuelle. (Les préservatifs sont ici un bon moyen de protection).
- transmission de la mère à l'enfant (transmission verticale); le dépistage de l'Ag HBs durant la grossesse permet la sérovaccination du nouveau-né (dans les premières 48 heures).
Sans intervention, une mère qui est positive pour l’antigène de surface de l'hépatite B présente 20% de risque de transmettre l'infection à sa progéniture au moment de la naissance. Ce risque est supérieur à 90% si la mère est également positive pour l’antigène e (voir réplication, ci-dessus). Le virus de l'hépatite B peut être transmis entre les membres de la famille dans la vie domestique, par contact possible entre la peau lésée ou les muqueuses avec la salive ou des sécrétions contenant le VHB[22]. Cependant, au moins 30% des cas d’hépatite B rapportés chez l’adulte ne peuvent pas être reliés à un facteur de risque identifiable[23].
Prévalence
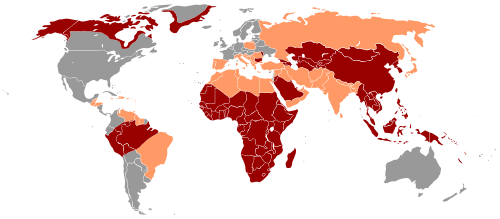
Le principal mode de transmission reflète la prévalence du virus de l'hépatite B chronique dans une zone donnée. Dans les pays à faible prévalence des régions telles que les États-Unis et l’Europe de l'Ouest où moins de 2% de la population est chroniquement infectées, l'abus de drogues par injection et les rapports sexuels non protégés sont les principales voies de transmission, bien que d'autres facteurs puissent avoir leur importance[24]. Dans les zones de prévalence modérée, qui comprennent l'Europe de l'Est, la Russie, et le Japon, où 2 à 7% de la population est chroniquement infectées, la maladie est essentiellement répandue chez les enfants. Dans les zones de haute prévalence des régions comme la Chine et l’Asie du Sud-Est, la transmission pendant l'accouchement est la plus fréquente, bien que dans d'autres zones de forte endémicité comme l’Afrique, la transmission au cours de l'enfance soit un facteur important[25]. La prévalence de l'infection chronique par le virus de l'hépatite B dans les zones de forte endémicité est d'au moins 8%.
Des niveaux variés de séroprévalence du VHB sont expliqués par le contexte socio-économique et de vaccination : il permet de faibles prévalences, par exemple dans l’Ile de La Réunion (où seulement 0,7% de la population est touchée), alors qu'en Afrique noire il dépasse souvent 15 % (ex : à Madagascar, la prévalence est de 16 %, en raison de fréquentes transmission mère-enfant et du faible usage du préservatif, ce qui favorise une fréquente transmission sexuelle).
En France en 2003-2004, le nombre de personnes porteuses chronique de l'antigène HBs (témoignant de la présence de virus circulant dans le sang) était estimé entre environ 180 000 et 380 000 [26].
Depuis l'essor de la vaccination, la prévalence de l'hépatite B est en forte diminution chez les pays avec une politique vaccinale[27].
Pathogénie
Le virus de l'hépatite B interfère d’abord avec les fonctions du foie en se répliquant dans les cellules hépatiques, connues sous le nom d’ hépatocytes. Au cours de l'infection par le virus de l'hépatite B, la réponse immunitaire hépatocellulaire est responsable à la fois des lésions hépatiques et de l’élimination du virus. Bien que la réaction d’immunité naturelle ne joue pas un rôle important dans ces processus, la réponse immunitaire adaptée, en particulier celle des cellules T cytotoxiques spécifiques du virus (CTLs), contribue à la formation de la plupart des lésions hépatiques associées à l'infection par le VHB. En tuant les cellules infectées et en produisant des Cytokines antivirales capables d’éliminer le virus de l'hépatite B des hépatocytes viables[28]. Bien que l'atteinte hépatique soit initiée et réalisée par les CTLs, les cellules inflammatoires non spécifique d’un antigène peuvent aggraver les lésions immunopathologiques induites par les CTL, et l’activation des plaquettes sur le site de l'infection peut faciliter l'accumulation des CTLs dans le foie[29].
Symptômes et complications
L’infection par le virus de Hépatite B peut, soit être aiguë (guérison spontanée) soit chronique (évoluant à long terme). Les personnes dont le système immunitaire peut contrôler l'infection guérissent spontanément dans un délai d’une semaine à plusieurs mois.
Les enfants sont moins susceptibles que les adultes de guérir de l'infection. Plus de 95% des personnes qui sont infectés tardivement dans l’enfance ou à l’âge adulte se rétabliront complètement et développeront une immunité protectrice contre le virus. Toutefois, seulement 5% des nouveau-nés qui contractent l’infection de leur mère à la naissance peuvent éliminer le virus. Parmi ceux qui sont infectés entre l'âge de un à six ans, 70% guérissent de l'infection[30].
Infection aiguë
L’hépatite B aiguë est peu fréquente, elle se caractérise par un syndrome pré-ictérique (coloration jaune de la peau et des muqueuses par défaillance d’une enzyme hépatique). Elle survient après une période d'incubation de 2 à 3 mois. L'hépatite B aiguë se présente sous différentes formes :
- une forme asymptomatique ou anictérique : 70% des cas environ.
- une forme symptomatique : 30% des cas environ. Les sujets sont atteints d'ictère, ils ont les urines foncées, des selles normales ou décolorées... La maladie commence par une altération de l’état général, une légère fièvre, des douleurs mal systématisées, le tout évoquant un état grippal ainsi que des troubles digestifs, une perte d'appétit, des nausées, des vomissements, l’ictère apparaît plus tard permettant d’affirmer le diagnostic. On note parfois un prurit comme dans toutes les formes d’hépatite dont il peut être le premier signe. La maladie dure quelques semaines, puis la plupart des personnes touchées présentent une amélioration progressive
- une forme fulminante: 1 à 2% des cas environ. Les patients présentent des taux de prothrombine <45% et des signes neurologiques d'insuffisance hépatique. Cette forme est létale dans 90% des cas.
Infection chronique
L’effet cytopathogène du virus lui-même est peu important. Les lésions hépatiques sont, en réalité, dues à un ensemble de réactions immunologiques à médiation principalement cellulaire. La destruction des hépatocytes par le système immunitaire conduit à la libération d’enzymes hépatiques, comme l’Alanine Amino Transférase (ALAT) et l’Aspartate Amino Transférase (ASAT). L’augmentation des taux de transaminases sériques est donc facilement détectable et signe une cytolyse hépatique importante. Dans le cas d’une hépatite chronique active, la réaction immunologique est dirigée contre les hépatocytes où a lieu la réplication virale et qui expriment à leur surface les antigènes HBc et HBe. L’absence d’efficacité absolue des thymocytes cytotoxiques peut être liée :
- soit à une action déficiente des lymphocytes T helpers spécifiques de l’antigène HBc.
- soit à une expression trop faible des molécules du CMH de classe I.
- soit à une expression membranaire insuffisante de l’antigène HBc car masqué par les anticorps anti-HBc.
L’infection chronique est définie par la persistance de l’antigène HBs pendant plus de 6 mois après la contamination virale. Elle est le plus souvent asymptomatique. Le plus courant des symptômes étant une asthénie, qui peut être due à de multiples causes. Ainsi, l’infection au VHB est très souvent découverte tardivement et de manière fortuite. Par exemple, lors d’un don du sang, d’une grossesse ou d’un bilan sanguin. Le portage chronique du VHB est confirmé par l’absence d’anticorps anti-HBc. L’hépatite chronique est caractérisée histologiquement par des lésions hépatiques associant nécrose hépatocytaire, infiltrat inflammatoire et fibrose.
Le passage à la chronicité est inversement proportionnel à l’âge auquel survient l’infection. Ce risque est majeur quand l’infection survient avant l’âge de 5 ans (90% des enfants infectés avant l'âge d'un an, et 30% à 50% des enfants infectés entre un an et quatre ans, vont développer une infection chronique)[27].
Classiquement, une infection chronique par le VHB sauvage évolue en 3 phases successives.
Première phase : multiplication intense du VHB
Sur le plan de la sérologie, cette phase est caractérisée par la présence des marqueurs de réplication virale dans le sérum, à savoir ADN du virus et antigène HBe. Cette phase dure de une à plusieurs années.
Deuxième phase : phase dite de séroconversion HBe
C’est la phase au cours de laquelle la réponse immunitaire s’intensifie. Il y a diminution, puis disparition dans le sérum des marqueurs de réplication virale, d’abord l’ADN puis l’antigène HBe. L’activité de la maladie hépatique est à ce moment très forte et peut conduire à des lésions sévères : fibrose extensive, voire cirrhose. Plusieurs tentatives de séroconversion, finalement abortives, sont remarquables au cours de cette phase.
Troisième phase
Elle ne survient pas dans tous les cas. Elle est caractérisée par l’absence des marqueurs de réplication et la présence de l’anticorps anti-HBe. Toutefois, bien que l’ADN ne soit plus détectable dans le sérum par les techniques d’hybridation classiques, il persiste une faible multiplication détectable par PCR. Durant cette phase, l’activité de la maladie hépatique est faible, voire nulle. Mais, il peut se reproduire une réactivation pendant cette phase.
Ces 3 phases ont en commun la présence de l’antigène HBs dans le sérum.
Évolution
Évolution vers la cirrhose
La cirrhose représente environ 20 % des évolutions naturelles des hépatites chroniques. Une forte consommation d’alcool, supérieure à 20 grammes par jour pour les femmes et supérieure à 30 grammes par jour pour les hommes, est un facteur de risque important dans le développement d’une cirrhose.
Evolution vers l’hépatocarcinome
Le virus de l’hépatite B est un puissant carcinogène. Le risque de développer un hépatocarcinome est multiplié par 100 chez les porteurs du virus de l’hépatite B.
Après vaccination contre le VHB, il a été démontré une diminution de la fréquence d’apparition de carcinomes hépatocellulaires.
Plusieurs mécanismes, directs et indirects, ont été suggérés pour l’induction de l’hépatocarcinogénèse par le VHB. Les mécanismes indirects incluent les lésions, comme la nécro-inflammation et la fibrose, induites par une infection du foie par le VHB.
Le génome du VHB ne renferme pas d’oncogène. L’intégration du génome viral peut parfois activer l’expression d’oncogènes cellulaires contrôlant la multiplication cellulaire, par mutagenèse insertionnelle. Dans des tumeurs hépatiques associées au VHB, l’activation de certains facteurs de croissance a pu être montrée. La dérégulation de facteurs suppresseurs de tumeurs a aussi été mise en évidence dans certains cas. Par exemple, une mutation ponctuelle dans le gène de p53 conduirait à une protéine mutée responsable de la prolifération des hépatocytes. Une intégration de la région X du génome viral du VHB dans le génome cellulaire peut également être responsable de mécanismes de transformation cellulaire par transactivation de gènes.
Diagnostic
La gravité de l’infection par le VHB est essentiellement liée à l’évolution possible de l’hépatite chronique vers la cirrhose et l’hépatocarcinome. Le diagnostic repose largement sur la sérologie.
Diagnostic clinique
L’examen clinique, chez un porteur chronique de l’hépatite B, est normal, si ce n’est l’existence d’une asthénie modérée dans certains cas.
Dans le cas d’une hépatite chronique active, certains symptômes peuvent apparaître. Ce sont une petite fièvre, une augmentation du volume du foie et/ou de la rate (hépatomégalie et/ou splénomégalie), des poussées ictériques (symptômes d’allure pseudo-grippale : céphalées, douleurs articulaires et musculaires, mais aussi nausées, diarrhée, urines foncées) et des manifestations extra-hépatiques, dues aux dépôts de complexes immuns (ex : péri artérite noueuse).
En cas de cirrhose, on peut retrouver des signes cliniques d’insuffisance hépatocellulaire et d’hypertension portale.
Co-infection par le virus de l’hépatite D
L’infection par le virus de l’Hépatite D peut se produire seulement en cas d'infection concomitante par le virus de l'hépatite B parce que le virus de l'hépatite D utilise l’antigène de surface du virus de l'hépatite B former une capside[31]. La co-infection par l'hépatite D augmente le risque de cirrhose du foie et de cancer du foie[32]. La périartérite noueuse est plus fréquente chez les personnes infectées par le virus de l'hépatite B.
Diagnostic virologique
Le diagnostic spécifique d’hépatite virale à VHB repose sur la détection de certains marqueurs sériques :
- anticorps : IgG anti-HBs, IgG anti-HBe, IgM et IgG anti-HBc
- antigènes : HBs et HBe
- ADN du VHB
La détection des antigènes se fait via des tests RIA (Radio Immuno Assay). La recherche d’ADN du VHB sérique se fait par des techniques d’hybridations moléculaires (PCR).
Les dosages utilisés pour la détection de l’infection par le virus de l’hépatite B comprennent des tests plasmatiques ou tests sanguins qui détectent soit l’antigène viral (une protéine produite par le virus) ou des Anticorps produits par l’hôte. L’interprétation de ces tests est complexe[33].
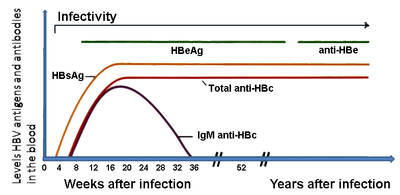
L’antigène de surface de l'hépatite B (AgHBs) est le plus souvent utilisé pour le dépistage de cette infection. Il est le premier antigène viral détectable à apparaître au cours de l'infection. Toutefois, au début de l'infection, cet antigène peut ne pas encore être présent et il peut être indétectable plus tard dans le cours d’évolution de l'infection car il est éliminé par le patient. Le virion infectieux contient un noyau le "core" réceptacle du génome viral. Le core est une particule isocahédrique contenant 180 à 240 exemplaires d’une protéine, connue sous le nom d’Antigène du core du virus de l'hépatite B, ou AgHBc. Au cours d’une "fenêtre" pendant laquelle l’hôte reste infecté mais se défend avec succès contre le virus, les anticorps IgM contre l’antigène du core du virus de l'hépatite B ( IgM anti-HBc ) peuvent être la seule trace sérologique de la maladie. Peu de temps après l'apparition de l'AgHBs, un autre antigène nommé antigène e (AgHBe) apparaît. Traditionnellement, la présence de l'AgHBe dans le sérum est associée à un taux beaucoup plus élevé de réplication virale et à un renforcement de l'infectiosité. Toutefois, certains variants du virus de l'hépatite B ne produisent pas l'antigène «e», aussi cette règle n'est-elle pas toujours vérifiée. Pendant le cours de l’évolution naturelle d'une infection, l'AgHBe peut être éliminé, et des anticorps contre l’antigène «e» (anti-HBe) apparaîtront immédiatement après. Ce changement est généralement associé à une baisse spectaculaire de la réplication virale.
Diagnostic Virologique Ag HBs IgM anti-HBc IgG anti-HBc ADN VHB Ag HBe IgG anti-HBe IgG anti-HBs Hépatite aiguë + + + +/- +/- - - Fin d’hépatite aiguë - + + - - + - Hépatite chronique active + - + + + - - Porteur sain + - + - - + - Vaccination - - - - - - + Si l'hôte est en mesure de contrôler l'infection, l'AgHBs deviendra indétectable et sa disparition sera suivie par l’apparition d’anticorps IgG contre l’antigène de surface de l'hépatite B et contre l'antigène du core, (anti-HBs et IgG anti-HBc ).[6] Une personne négative pour l’ AgHBs, mais positive pour les anticorps anti-HBs a, soit guéri d’une infection antérieure, soit été vaccinée auparavant.
Les personnes qui restent AgHBs positifs pendant au moins six mois sont considérés comme porteurs du virus de l'hépatite B[34]. Les porteurs du virus peuvent développer une hépatite B chronique, qui se traduira par un taux sérique élevé de transaminases et une inflammation du foie, révélée par la biopsie. Les porteurs qui sont AgHBe négatifs, en particulier ceux qui ont contracté l'infection à l’âge adulte, ont très peu de réplication virale et, par conséquent, peuvent présenter peu de risque de complications à long terme ou de transmission de l'infection à d'autres personnes[35].
Plus récemment, les tests PCR ont été développés pour détecter et mesurer la quantité d'acide nucléique viral dans des échantillons biologiques. Ces tests servent à mesurer la charge virale et sont utilisés pour évaluer le statut infectieux d’une personne et de choisir le traitement à suivre[36].
Traitement
L'infection par le virus de l'hépatite B ne nécessite habituellement pas de traitement parce que la plupart des adultes guérissent spontanément de l'infection[37]. Un traitement antiviral précoce n’est requis que pour moins de 1% des patients, dont l'infection a un cours très agressif ( "hépatite fulminante") ou qui sont immunodéprimés.
Le traitement a pour but d’influer sur l’histoire naturelle de l’hépatite B chronique en raccourcissant sa durée. Il permet dans certains cas d’éviter l’évolution vers la cirrhose et donc éviter la survenue du carcinome hépatocellulaire. Le traitement interrompt la réplication du VHB et donc, avance le moment de la séroconversion HBs.
Les personnes chroniquement infectées avec persistance d’un taux sérique élevé d’ALAT, un marqueur des lésions hépatiques, et un niveau élevé d'ADN viral du VHB sont des indications du traitement[38].
Bien qu'aucun des médicaments disponibles ne soit capable d’éliminer l'infection, certaines molécules peuvent arrêter la réplication du virus, et prévenir les atteintes du foie comme la cirrhose et le cancer du foie. Les traitements utilisés sont des médicaments antiviraux tels que la lamivudine, l’adéfovir et l’entecavir et les modulateurs du système immunitaire tels que l’interféron alpha. Toutefois, certaines personnes sont beaucoup plus susceptibles de répondre que d'autres et c'est peut-être en raison du génotype du virus infectant ou de l'hérédité du patient. Le traitement agit en réduisant la charge virale, (la quantité de particules virales mesurée dans le sang), ce qui réduit la réplication virale dans le foie.
Le 29 Mars, 2005, aux États-Unis la Food and Drug Administration (FDA) a approuvé l’utilisation de l’entecavir pour le traitement de l'hépatite B[39]. Le 25 Février, 2005, la Commission européenne approuve le Peginterféron alfa-2a (Pegasys)[40],[41]. Le 27 Octobre, 2006, la telbivudine obtient l'approbation de la FDA. Le médicament est commercialisé sous la marque Tyzeka aux États-Unis et Sebivo en dehors des Etats-Unis. Il est autorisé en Suisse[42].
Les nourrissons nés de mères connues comme porteuses de l'hépatite B peuvent être traitée avec des anticorps contre le virus de l'hépatite B (immunoglobulines hépatite B ou IgHB). Lorsque le traitement est administré avec le vaccin dans les douze heures qui suivent la naissance, le risque de contracter l'hépatite B est réduit de 95%. Ce traitement permet à une mère d’allaiter son enfant sans danger.
Analogues nucléosidiques et nucléotidiques
Les analogues nucléosidiques, ou nucléotidiques, sont administrés sous forme de prodrogues. Les kinases cellulaires vont les phosphoryler dès leur entrée dans la cellule et ainsi former le principe actif. Dès lors, les analogues nucléosidiques entrent en compétition avec les substrats naturels de la polymérase. Si cette dernière incorpore un analogue antiviral, l’élongation de la chaîne d’ADN en cours de synthèse se trouve bloquée. La drogue ne possède pas la structure chimique permettant de former une liaison phosphodiester avec le nucléotide suivant (absence de -OH en 3').
Il existe une meilleure affinité de ces analogues antiviraux pour l’ADN polymérase virale que pour la polymérase cellulaire, qui n’est pas encore expliquée. Cependant, la sélectivité n’est pas absolue et les effets secondaires provoqués par ces drogues s’expliquent en partie par leur action sur les enzymes cellulaires.
Les recherches menées sur le VIH ont été mises à profit pour le traitement anti-VHB. En effet, plusieurs molécules inhibant la transcriptase inverse du VIH sont également actives sur la polymérase du VHB. La première de ces molécules, autorisée en France, pour traiter une infection chronique au VHB, était la lamiduvine.
Lamivudine
La lamivudine est un L-nucléoside analogue de la didésoxycytidine. Elle inhibe la polymérase du VHB par incorporation compétitive avec la didésoxycytidine. Lors d’un traitement à la lamivudine, par administration quotidienne de 100 mg, le taux sérique d’ADN du VHB chute considérablement, jusqu’à devenir indétectable dans certains cas. Cependant, dès l’arrêt du traitement, le taux revient rapidement à ses valeurs pré thérapeutiques. Le problème réside dans le mode d’action de cette molécule. En effet, la lamivudine inhibe la polymérase mais n’a pas d’action sur la formation initiale d’ADN superenroulé et le maintien du pool de cet ADN dans les hépatocytes.
ARA-AMP
Ce composé, l’adénine arabinoside monophosphate, est un analogue de l’adénosine et inhibe également l’activité de l’ADN polymérase du VHB. Mais, ce composé étant peu sélectif de l’ADN polymérase virale, il s’est révélé très toxique.
Famciclovir
Le famciclovir est la prodrogue du penciclovir. Le penciclovir est un nucléoside analogue de la désoxyguanosine. Après absorption orale, le famciclovir est transformé en penciclovir par des enzymes hépatiques et digestives. La famciclovir est surtout utilisé dans la lutte contre les virus de l’herpès (HSV-1 et HSV-2), du zona (VZV) et le virus Epstein-Barr (EBV).
Adéfovir dipivoxil
L’adéfovir, ou PMEA (9-(2-phosphonylméthoxyéthyl) adénine), appartient à une famille récente de drogues antivirales, les phosphonates de nucléotides acycliques. La forme active di-phosphorylée de l’adéfovir inhibe les virus à ADN et certains rétrovirus. Le PMEApp, le métabolite actif du PMEA, est un inhibiteur compétitif du désoxy-ATP, substrat naturel de la polymérase du VHB. Le PMEApp inhibe également les polymérases de VHB mutants résistants à la lamiduvine ou au famciclovir.
Entécavir
L’entécavir est un analogue de la cyclopentylguanosine et inhibe spécifiquement la polymérase du VHB. Cette molécule a une action inhibitrice à la fois sur la synthèse du brin L- (inhibition de l’activité transcriptase inverse) et sur celle du brin S+ (inhibition de l’activité ADN polymérase ADN-dépendante). Son effet sur les polymérases cellulaires est faible.
Telbivudine
Il s’agit d’un L-nucléoside analogue de la thymidine, qui inhibe spécifiquement l’activité de la polymérase du VHB. Les premiers essais cliniques indiquent une plus grande efficacité de cette molécule par rapport à la lamiduvine, concernant la baisse de la charge virale. Tout comme l’entécavir, cette drogue bloque la synthèse des deux brins d’ADN viral.
Ténofovir
Le ténofovir est une molécule proche de l’adéfovir, c’est un analogue de la didésoxy-adénosine. Il inhibe la polymérase du VHB et du VIH, même dans les formes résistantes à la lamiduvine. L’efficacité du ténofovir a été démontrée chez des sujets co-infectés par le VIH et le VHB.
D’autres molécules sont en cours d’évaluation clinique, on peut citer l’emtricitabine (structure proche de la lamiduvine), la clévudine (analogue de pyrimidine), l’elvucitabine et la thymosine.
Interférons
Interféron alpha
L’interféron alpha (IFN α) est une cytokine naturellement produite par le système immunitaire. Au cours des hépatites B chroniques, il existe un défaut de production de l’IFN α par les cellules mononucléées qui pourrait être lié à un effet inhibiteur du virus lui-même.
L’IFN α a un effet antiviral sur l’infection par le VHB via deux mécanismes. Il a un effet antiviral direct et rapide en inhibant les ARN viraux et en activant des enzymes ayant une activité antivirale, la 2’5’oligoadénylate synthétase et une protéine kinase.
La 2’5’oligoadénylate synthétase polymérise 3 à 5 molécules d’ATP par une liaison 2’-5’. Les oligonucléotides ainsi formés vont activer une RNase, qui va fragmenter les ARN messagers.
La protéine kinase, activée par l’IFN α, phosphoryle une sous-unité du facteur d’initiation eIF-2 (eucaryotic Initiation Factor), qui en temps normal, fixe l’ARNt-Met initiateur. Le complexe d’initiation est ainsi bloqué, tout comme le ribosome sur l’extrémité de l’ARNm à traduire. Le facteur eIF-2 n’est pas recyclable, la synthèse protéique est bloquée.
Cet effet de la kinase sur les ARNm viraux est valable sur les ARNm cellulaires. La cellule infectée est donc vouée à mourir.
De plus, l’IFN α augmente l’efficacité de la réponse immunitaire vis-à-vis des cellules hépatiques infectées, en augmentant l’expression des antigènes d’histocompatibilité de classe I. Il stimule également l’activité des lymphocytes T helpers et des cellules NK (Natural Killer). La destruction des cellules hépatiques infectées, lors d’un traitement à l’interféron α, conduit donc à une libération du contenu cellulaire dans la circulation, d’où un pic du taux plasmatique des transaminases, ALAT et ASAT.
L’infection conjointe par le VIH semble diminuer l’effet antiviral de l’interféron.
Interféron pégylé
Il existe actuellement deux types d’IFN pégylés : IFN pégylé α-2a et IFN pégylé α-2b. Il s’agit d’IFN alpha auxquels on a attaché un groupement polyéthylène glycol permettant d’allonger la demi-vie de la molécule. En effet, cette modification chimique augmente le poids moléculaire de la molécule, diminuant ainsi sa clearance rénale. Cette pégylation de l’IFN alpha a également optimisé sa pharmacocinétique et a permis de rendre son administration hebdomadaire. L’activité antivirale de l’IFN pégylé est identique à celle de l’IFN α.
Une réponse prolongée et durable après l’arrêt du traitement par l’interféron n’est observée que chez 30% des patients en moyenne.
Effets secondaires des molécules antivirales
Lors d’un traitement à l’ARA-AMP(l’adénine arabinoside monophosphate), il peut se développer une neuropathie périphérique, autrement dit, des lésions aux nerfs périphériques pouvant provoquer des engourdissements, des picotements voire une perte de mobilité.
D’une manière générale, les traitements à base d’analogues nucléosidiques peuvent provoquer des nausées, maux de tête, vomissements, diarrhées, étourdissements…
Lors d’un traitement à l’IFN, un syndrome pseudo-grippal, d’intensité variable, peut survenir chez certains sujets. La prise de paracétamol permet, habituellement, de bien corriger ce trouble.
Transplantation hépatique
Elle est indiquée en cas de cirrhose sévère, d’hémorragie digestive ou d’encéphalopathie. Elle pose essentiellement le problème de la récidive de l’infection par le VHB. Le risque d’infection du greffon est très élevé, de l’ordre de 80%. Le mécanisme de réinfection est mal connu. Il pourrait se faire à partir de virions persistants dans le sérum ou à partir d’autres sites d’infection comme les cellules mononucléées sanguines.
Développement de mutants résistants
Mutant précore
Il s'agit de mutations affectant l’expression de l’antigène HBe. La détection dans le sérum de cet antigène indique une réplication virale active. La séroconversion anti-HBe est généralement accompagnée d’une forte élévation des transaminases, indiquant une destruction des hépatocytes infectés. Cette séroconversion a longtemps été considérée comme le signe de la fin de la réplication virale et le début de la guérison.
Mais, on a observé que certains patients anti-HBe positifs restaient infectieux. La raison en est l’existence d’une mutation dans la région Pré-C du génome viral. Elle entraîne l’apparition d’un codon stop prématuré (codon TGG codant pour un résidu tryptophane remplacé par un codon TAG) lors de la transcription de la protéine p25c, précurseur de l’antigène HBe, et donc, l’absence de synthèse de cet antigène. Les hépatocytes ne présentent donc pas les épitopes de cet antigène à leur surface et le système immunitaire ne détruit pas ces cellules, pourtant infectées.
Il existe également des mutations sur le promoteur du gène pré-C qui vont permettre de conserver la synthèse des protéines HBc, mais dans de moindres quantités. Les deux mutations les plus courantes à ce niveau sont :
- le remplacement de la base Adénosine par la base Thymidine en position 1762
- le remplacement de la base Guanosine par la base Adénosine en position 1764
Mutants de l’antigène HBs
Ce type de mutants est retrouvé chez des groupes d’individus non vaccinés, en tant que population virale minoritaire, mais aussi chez des groupes de sujets vaccinés, où ce type de mutant représente la population virale majoritaire, voire unique. La plupart des mutations se trouvent dans le déterminant a de l’antigène. Il semblerait que cette altération de la conformation de ce déterminant soit responsable de l’échappement du virus au système immunitaire.
Mutants de la polymérase
Les hépatocytes et l’ADN superenroulé ont un temps de demi-vie très élevé, ce qui implique, lors d’un traitement par la lamivudine par exemple, que 5 à 10 ans de traitements sont nécessaires pour éradiquer le VHB. Hors, un tel délai entraîne l’apparition de mutants résistants aux drogues antivirales. Au bout de quelques années de traitement, voire quelques mois seulement, la charge virale sérique commence à s’élever. Dans le cas de la lamivudine, au bout d’un an, 20% des patients développeront un VHB résistant, et 70% après 4 ans de traitement. Une mutation dans le site actif de la polymérase modifie son activité enzymatique mais préserve tout de même la fonction. Concernant un traitement par l’adéfovir, l’apparition de mutants est moindre, 2% de cas au bout de 2 ans et 29% au bout de 5 ans.
Un enjeu de Santé Publique
L’Organisation Mondiale de la Santé (OMS) estime à 2 milliards le nombre de personnes qui sont ou ont été infectées, dont 370 à 400 millions sont des porteurs chroniques. L’hépatite B entraîne le décès d’un à deux millions d’individus par an. En effet, la contagiosité élevée du virus est liée à sa présence dans la majorité des liquides biologiques : sang, sperme, sécrétions vaginales et même, en moindre proportion, dans la salive.
Le VHB a des facteurs de risques communs avec le VIH, le VHC et le VHD (Virus des Hépatites C et D).
L’hépatite B est à la fois :
- une maladie contagieuse
- une Infection Sexuellement Transmissible
- une maladie professionnelle
- une maladie associée au SIDA, à la toxicomanie et à l’alcoolisme
- une maladie congénitale et familiale
Prévention
Elle repose sur la vaccination mais aussi sur la détection des porteurs de virus et sur certaines mesures destinées à empêcher la diffusion de ce dernier.
Ainsi le dépistage chez tout donneur de sang a entraîné une baisse très sensible de ce mode de contamination[27], de même les programmes d'échanges de seringues chez les toxicomanes.
Dans certains cas, une immunothérapie par injection d'immunoglobulines spécifiques chez le sujet récemment contaminé peut prévenir la survenue de l'hépatite.
Vaccination
Article détaillé : Vaccin hépatite B.Et pourtant, depuis 1982, on peut éviter l’infection grâce à un vaccin. Le vaccin contre l'hépatite B ne guérit pas les porteurs chroniques, mais il est efficace de 90 à 95% pour prévenir l'apparition de cet état. Le vaccin anti-VHB est aussi le premier vaccin contre une infection sexuellement transmissible et peut être considéré comme le premier vaccin contre un cancer.
Grâce aux actions de l’OMS, depuis quelques années, beaucoup de pays ont ajouté le vaccin contre l’hépatite B à leur programme national de vaccination. Cependant, dans les pays pauvres, là où les zones endémiques sont les plus importantes, le coût de cette vaccination pose problème. L’OMS a alors lancé en 1999 la création de l’Alliance mondiale pour les vaccins et la vaccination (GAVI), dont un des buts est de vacciner le plus d'enfants possible afin de les prémunir contre certaines maladies pour lesquelles il existe un vaccin, comme l’hépatite B.
La vaccination est obligatoire pour les personnels de Santé depuis le 18 janvier 1991. Cette prévention est essentielle car le risque pour ces professionnels est 5 à 8 fois plus élevé que celui de la population générale. Sauf pour les personnes vaccinées avant l’âge de 13 ans, il est préconisé un contrôle sérologique 6 à 8 semaines après le rappel. Un taux d’anticorps de 10 mUI/ml est considéré comme protecteur, auquel cas aucun rappel ultérieur n’est recommandé.
Nature du vaccin
Le vaccin contre l’hépatite B est constitué d’antigène HBs (antigène de surface de l’hépatite B ou AgHBs). Il y a deux types de vaccins disponibles.
Le plus ancien est préparé à partir d’antigènes HBs purifiés à partir de plasma de porteurs sains. Le premier vaccin utilisé chez l’homme a été mis au point en 1976 par le professeur Philippe Maupas, virologue à la faculté de médecine et de pharmacie de Tours, et testé chez le personnel du service d’hémodialyse, très exposé à la maladie[43].
Le deuxième est préparé par génie génétique : c’est une protéine recombinante obtenue par insertion du gène du VHB codant pour la protéine d’enveloppe virale (antigène HBs) dans des cellules de levures ou des cellules ovariennes de hamster.
Les vaccins dérivés du plasma continuent cependant à être utilisés, les deux types de vaccins étant d’une efficacité identique et tous les deux sans danger, mais seuls les vaccins issus du génie génétique sont autorisés en France[44].
Après la vaccination l’antigène de surface de l’hépatite B peut être détecté dans le sérum pendant plusieurs jours, ce phénomène est connu sous le nom d'antigènémie vaccinale[45].
Un taux d’anticorps anti-HBs protecteurs (10 mUI/ml) est obtenu 2 à 3 mois après le début de la vaccination.
Vaccins commerciaux
- Vaccin Genhevac B® : il est constitué d’une suspension purifiée d’antigènes HBs contenant les protéines S et PréS, obtenues par clonage et expression du gène viral dans les cellules ovariennes de hamster.
- Vaccin Engerix B® : il contient l’antigène HBs purifié obtenu par clonage et expression du gène viral dans les cellules de levure Saccharomyces cerevisiae. Il existe deux présentations de ce vaccin : Engerix B20® pour l’adulte et Engerix B10® pour le nourrisson et l’enfant de moins de 15 ans.
- Vaccin HBVaxPro® : il contient l’antigène HBs purifié obtenu par clonage et expression du gène viral dans les cellules de levure Saccharomyces cerevisiae. Il existe trois présentations, une pour les adultes, une pour les enfants jusqu’à 15 ans et une pour les sujets dialysés.
- Vaccin Fendrix® : il contient l’antigène HBs et un adjuvant adsorbé sur phosphate d’aluminium, ce vaccin est adapté aux personnes atteintes d’insuffisance rénale.
- Twinrix® : c’est un vaccin combiné contre les hépatites A et B. Il existe en deux présentations, Twinrix® Adulte (à partir de 15 ans) et Twinrix® Enfant.
- Infanrix Hexa® : il s’agit d’un vaccin hexavalent destiné aux nourrissons. C’est un vaccin combiné anti-diphtérique, anti-tétanique, anti-coquelucheux, anti-poliomyélitique, anti-Haemophilus influenzae b, et contenant 10 μg d’antigène HBs.
Schéma de la vaccination anti-VHB
La cible dépend de la prévalence de l'hépatite dans le milieu considéré. Elle est conseillée pour toute la population dans les pays de forte endémie mais peut concerner seulement les personnes jugées les plus à risque dans les pays à faible endémie, même si cette attitude est discutée[46].
Le schéma initialement prévu était le suivant :
- 3 injections par voie intramusculaire (dans la région deltoïdienne pour les adultes et dans la cuisse pour les nourrissons), la deuxième injection se fait un mois après la première et la troisième se fait 5 mois après la seconde.
- rappel un an après la première injection
- rappels tous les 5 ans
Le schéma actuellement recommandé est le suivant :
- 2 injections par voie intramusculaire (dans la région deltoïdienne pour les adultes et dans la cuisse pour les nourrissons), la deuxième injection se fait un mois après la première.
- rappel 6 mois après la première injection.
- Pour les personnes vaccinées avant l’âge de 25 ans et non exposées professionnellement, aucun rappel ultérieur ni aucun contrôle sérologique n’est préconisé.
Controverses
De nombreuses études portant sur des millions de sujets ont documenté l’innocuité du vaccin anti-VHB. Les réactions, suite à la vaccination, les plus couramment observées sont des réactions cutanées mineures au point d’injection ou des douleurs musculaires et articulaires transitoires. Un peu plus d’une centaine d’atteintes démyélinisantes centrales ont été notifiées entre 1989 et 1995 pour environ 17,5 millions de sujets vaccinés en France, soit moins de 0,6‰ d’entre eux. Compte tenu du sexe et de l’âge des sujets vaccinés, les fréquences de scléroses en plaques observées ne sont pas supérieures à celles attendues dans la population générale.
En février 2001, les deux études suivantes[47], publiées dans la revue "New England Journal of Medicine" : Vaccinations and the Risk of Relapse in Multiple Sclerosis (C. Confavreux et al.) et Hepatitis B Vaccination and the Risk of Multiple Sclerosis (A. Ascherio et al.) disculpaient le vaccin de l'hépatite B, accusé de pouvoir entraîner l'apparition de cas de sclérose en plaques.
En France, l'Académie nationale de médecine rappelle en 2008 que « 8 études nationales et internationales ont démontré l’absence de relation statistiquement significative entre la SEP et la vaccination contre l’hépatite B »[48],[49].
Echec de la vaccination
Les non ou faibles répondeurs sont :
- les personnes âgées : l’efficacité du vaccin décroît avec l’âge (ceci est notable dès 40 ans)
- les individus séropositifs au VIH : les personnes immunodéprimées
- les sujets atteints de défaillance rénale chronique
- les individus alcooliques
- les personnes HLA DR3+ ou DR7+ : cette non réponse serait due à des défaillances au niveau des cellules T auxiliaires.
Il faut savoir que le tabagisme et l’obésité sont aussi des facteurs favorisant la non-réponse au vaccin.
Amélioration de la vaccination anti-VHB pour les non ou faibles répondeurs
Un vaccin à base d’antigènes de surface PréS2 et S produit par la levure induit des titres en anticorps protecteurs après 2 injections chez 80 à 91% des sujets qui n’avaient pas été protégés auparavant avec un vaccin « conventionnel ». Un autre vaccin renfermant les antigènes PréS1, PréS2 et S (vaccin Hepa-Gene-3) a été testé sur des sujets souffrant d’insuffisance rénale et non répondeurs au vaccin classique. Au bout d’un an, 70% d’entre eux avaient des titres d’anticorps protecteurs. D’autres approches existent et sont en cours de recherche comme les vaccins à base d’ADN plasmidique.
Vers un vaccin à ADN ?
Ce type de vaccin est basé sur une injection directe d’ADN nu (sans vecteur protéique ou lipidique associé) par voie intramusculaire ou intradermique. L’ADN est capturé par des cellules et le génome viral est exprimé par celles-ci. La protéine correspondante est donc synthétisée par les cellules. Un des avantages majeurs d’un tel vaccin est l’expression à long terme de l’antigène. Ce qui pourrait permettre d’obtenir une réponse immunitaire plus soutenue et plus durable et donc permettre de supprimer les injections de rappel. Un autre avantage est la synthèse in vivo de l’antigène et sa présentation sous forme de peptides antigéniques associés aux molécules CMH de classe I, permettant d’induire une réponse cytotoxique médiée par les lymphocytes T CD8+.
L’injection d’ADN chez l’homme suscite des interrogations concernant le devenir de cet ADN injecté et la possibilité de son intégration dans un chromosome des cellules hôtes. Si cela était le cas, une mutagénèse insertionnelle serait possible. Le choix de l’injection d’un tel vaccin au niveau de cellules musculaires n’est pas arbitraire. En effet, les cellules musculaires sont post-mitotiques et donc, l’absence de divisions favorise peu les intégrations.
Discrimination des porteurs de l'hépatite B en Chine
En Chine, les porteurs de l'hépatite B, plus de 100 millions, feraient l’objet d’une discrimination à l'emploi et l'éducation. Il existerait environ une vingtaine de lois à caractère discriminatoire. Des examens sanguins sont demandés dans le cadre professionnel et éducatif. Les porteurs de l'hépatite B sont exclus d’éducation dès l’école maternelle dans certaines provinces chinoises. En 2009, l'association Yirenping (yirenping.org) [50],[51] qui fait campagne depuis quelques années en Chine contre la discrimination à l’égard des porteurs de l'hépatite B Chine a lancé une pétition sur Internet, et malgré la fermeture demandée par la cyber police chinoise, a recueilli 2040 signatures adressées à Wen Jiabao.[52]
Voir aussi
Lien interne
- Hépatite virale
- Hépatite A
- Hépatite B en Chine
- Hépatite C
- Hépatite D
- Hépatite E
- Hépatite F
- Hépatite G
- Maurice Hilleman
- Baruch Samuel Blumberg,
- Médecine tropicale
Lien externe
Liens en anglais
Notes et références
- ↑ Chang MH, « Hepatitis B virus infection », dans Semin Fetal Neonatal Med, vol. 12, no 3, 2007, p. 160–7 [lien PMID lien DOI]
- ↑ Barker LF, Shulman NR, Murray R, et al, « Transmission of serum hepatitis. 1970 », dans JAMA, vol. 276, no 10, 1996, p. 841–4 [lien PMID]
- ↑ Williams R, « Global challenges in liver disease », dans Hepatology, vol. 44, no 3, 2006, p. 521–6 [lien PMID lien DOI]
- ↑ Pungpapong S, Kim WR, Poterucha JJ, « Natural history of hepatitis B virus infection: an update for clinicians », dans Mayo Clin. Proc., vol. 82, no 8, 2007, p. 967–75 [lien PMID]
- ↑ a et b Zuckerman AJ, Hepatitis Viruses. In: Baron's Medical Microbiology (Baron S et al, eds.), Univ of Texas Medical Branch, 1996 (réimpr. 4th ed.) [présentation en ligne]
- ↑ Locarnini S, « Molecular virology of hepatitis B virus », dans Semin. Liver Dis., vol. 24 Suppl 1, 2004, p. 3–10 [lien PMID lien DOI]
- ↑ Howard CR, « The biology of hepadnaviruses », dans J. Gen. Virol., vol. 67 ( Pt 7), 1986, p. 1215–35 [lien PMID]
- ↑ Kay A, Zoulim F, « Hepatitis B virus genetic variability and evolution », dans Virus Res., vol. 127, no 2, 2007, p. 164–76 [lien PMID]
- ↑ a et b Beck J, Nassal M, « Hepatitis B virus replication », dans World J. Gastroenterol., vol. 13, no 1, 2007, p. 48–64 [lien PMID]
- ↑ Bouchard MJ, Schneider RJ, « The enigmatic X gene of hepatitis B virus », dans J. Virol., vol. 78, no 23, 2004, p. 12725–34 [lien PMID lien DOI]
- ↑ Bruss V, « Hepatitis B virus morphogenesis », dans World J. Gastroenterol., vol. 13, no 1, 2007, p. 65–73 [lien PMID]
- ↑ Kramvis A, Kew M, François G, « Hepatitis B virus genotypes », dans Vaccine, vol. 23, no 19, 2005, p. 2409–23 [lien PMID lien DOI]
- ↑ Magnius LO, Norder H, « Subtypes, genotypes and molecular epidemiology of the hepatitis B virus as reflected by sequence variability of the S-gene », dans Intervirology, vol. 38, no 1-2, 1995, p. 24–34 [lien PMID]
- ↑ Lurman A. (1885) Eine icterus epidemic. (In German). Berl Klin Woschenschr 22:20–3.
- ↑ MacCallum, F.O., Homologous serum hepatitis. Lancet 2, 691, (1947)
- ↑ Dane DS, Cameron CH, Briggs M, « Virus-like particles in serum of patients with Australia-antigen-associated hepatitis », dans Lancet, vol. 1, no 7649, 1970, p. 695–8 [lien PMID]
- ↑ Galibert F, Mandart E, Fitoussi F, Tiollais P, Charnay P, « Nucleotide sequence of the hepatitis B virus genome (subtype ayw) cloned in E. coli », dans Nature, vol. 281, no 5733, 1979, p. 646–50 [lien PMID]
- ↑ « Hepatitis B vaccine », dans Lancet, vol. 2, no 8206, 1980, p. 1229–30 [lien PMID]
- ↑ Alter HJ, Blumberg BS, « Further studies on a "new" human isoprecipitin system (Australia antigen) », dans Blood, vol. 27, no 3, 1966, p. 297–309 [lien PMID]
- ↑ B.S. Blumberg et al., « A Serum Antigen (Australia Antigen) in Down’s Syndrome Leukemia and Hepatitis », dans Annals of Internal Medicine, 1967, p. 924-31
- ↑ Petersen NJ, Barrett DH, Bond WW, Berquist KR, Favero MS, Bender TR, Maynard JE, « Hepatitis B surface antigen in saliva, impetiginous lesions, and the environment in two remote Alaskan villages », dans Appl. Environ. Microbiol., vol. 32, no 4, 1976, p. 572-574 [lien PMID]
- ↑ Shapiro CN, « Epidemiology of hepatitis B », dans Pediatr. Infect. Dis. J., vol. 12, no 5, 1993, p. 433–7 [lien PMID]
- ↑ Redd JT, Baumbach J, Kohn W, et al., « Patient-to-patient transmission of hepatitis B virus associated with oral surgery », dans J Infect Dis, vol. 195, no 9, 2007, p. 1311–4 [[pdf] texte intégral (page consultée le 12-12-2007)]
- ↑ Alter MJ, « Epidemiology and prevention of hepatitis B », dans Semin. Liver Dis., vol. 23, no 1, 2003, p. 39-46 [lien PMID lien DOI]
- ↑ www.fmcgastro.org
- ↑ a , b et c Yun-Fan Liaw, Chia-Ming Chu, Hepatitis B virus infection, Lancet, 2009;73:582-592
- ↑ Iannacone M, Sitia G, Ruggeri ZM, Guidotti LG, « HBV pathogenesis in animal models: recent advances on the role of platelets », dans J. Hepatol., vol. 46, no 4, 2007, p. 719–26 [lien PMID lien DOI]
- ↑ Iannacone M, Sitia G, Isogawa M, Marchese P, Castro M, Lowenstein P, Chisari F, Ruggeri Z, Guidotti L, « Platelets mediate cytotoxic T lymphocyte-induced liver damage », dans Nature Medicine, vol. 11, no 11, 2005, p. 1167-1169 [texte intégral lien PMID]
- ↑ Kerkar N, « Hepatitis B in children: complexities in management », dans Pediatric transplantation, vol. 9, no 5, 2005, p. 685–91 [lien PMID lien DOI]
- ↑ Taylor JM, « Hepatitis delta virus », dans Virology, vol. 344, no 1, 2006, p. 71–6 [lien PMID lien DOI]
- ↑ Oliveri F, Brunetto MR, Actis GC, Bonino F, « Pathobiology of chronic hepatitis virus infection and hepatocellular carcinoma (HCC) », dans The Italian journal of gastroenterology, vol. 23, no 8, 1991, p. 498–502 [lien PMID]
- ↑ Bonino F, Chiaberge E, Maran E, Piantino P, « Serological markers of HBV infectivity », dans Ann. Ist. Super. Sanita, vol. 24, no 2, 1987, p. 217–23 [lien PMID]
- ↑ Lok AS, McMahon BJ, « Chronic hepatitis B », dans Hepatology, vol. 45, no 2, 2007, p. 507–39 [lien PMID lien DOI]
- ↑ Chu CM, Liaw YF, « Predictive factors for reactivation of hepatitis B following hepatitis B e antigen seroconversion in chronic hepatitis B », dans Gastroenterology, vol. 133, no 5, 2007, p. 1458–65 [lien PMID lien DOI]
- ↑ Zoulim F, « New nucleic acid diagnostic tests in viral hepatitis », dans Semin. Liver Dis., vol. 26, no 4, 2006, p. 309–17 [lien PMID lien DOI]
- ↑ Hollinger FB, Lau DT, « Hepatitis B: the pathway to recovery through treatment », dans Gastroenterol. Clin. North Am., vol. 35, no 4, 2006, p. 895–931 [lien PMID lien DOI]
- ↑ Lai CL, Yuen MF, « The natural history and treatment of chronic hepatitis B: a critical evaluation of standard treatment criteria and end points », dans Ann. Intern. Med., vol. 147, no 1, 2007, p. 58–61 [lien PMID]
- ↑ U.S. Food and Drug Administration. March 30, 2005. FDA Talk Paper: FDA Approves New Treatment for Chronic Hepatitis B. fda.gov. Retrieved on 11Septembre, 2007.
- ↑ Hui CK, Lau GK, « Peginterferon-alpha2a (40 kDa) (Pegasys) for hepatitis B », dans Expert review of anti-infective therapy, vol. 3, no 4, 2005, p. 495–504 [lien PMID lien DOI]
- ↑ 25 Février, 2005. Pegasys approved in the European Union for the treatment of chronic hepatitis B : Only pegylated interferon approved for the treatment of chronic hepatitis B Retrieved on September 11, 2007.
- ↑ October 27, 2006. FDA Approves Telbivudine for Treatment of Chronic Hepatitis B. hivandhepatitis.com. Retrieved on 11 Septembre, 2007.
- ↑ CHIRON J. P. COURSAGET P. YVONNET B., « Philippe Maupas : Inventeur du vaccin contre l'hépatite B », dans Revue d'histoire de la pharmacie, vol. 46, 1988, p. 279-292
- ↑ Zuckerman JN, « Vaccination against hepatitis A and B: developments, deployment and delusions », dans Curr. Opin. Infect. Dis., vol. 19, no 5, 2006, p. 456–9 [lien PMID lien DOI]
- ↑ Martín-Ancel A, Casas ML, Bonet B, « Implications of postvaccination hepatitis B surface antigenemia in the management of exposures to body fluids », dans Infect Control Hosp Epidemiol, vol. 25, no 7, 2004, p. 611–3 [lien PMID]
- ↑ Zuckerman J, van Hattum J, Cafferkey M et als. Should hepatitis B vaccination be introduced into childhood immunisation programmes in northern Europe?, Lancet Infect Dis, 2007;7:410-419
- ↑ Consulter les deux articles
- ↑ L'Académie de médecine défend la vaccination contre l'hépatite B, Agence France-Presse, 12 février 2008.
- ↑ Communiqué sur la vaccination contre l'hépatite B en France, Académie nationale de médecine, 12 février 2008.
- ↑ New report accuses MNCs of hepatitis B discrimination in China
- ↑ China's cyber-activists spin a risky web
- ↑ Les porteurs du virus de l’hépatite B adressent une pétition au Premier Ministre Wen Jiabao, 12/3/2009, Charlotte Cailliez (Aujourd'hui la Chine)
Bibliographie Hépatite B
- Les virus transmissibles par le sang, Médecine Sciences Sélection, ouvrage collectif : texte réunis par Jean Jacques Lefrère, 1996.
- Hépatites virales B et C, Pathologie Sciences, C. Trépo, P. Merle, F. Zoulim, 2006.
- Virologie Humaine et Animale, DUNOD, C. Pasquier, S. Bertagnoli, F. Messud-Petit, J. Izopet, 2005
- Les hépatites virales, 2e édition MASSON, C. Eugène, L. Costentin, S. Beaulieu, 2004.
- Hépatites virales, dépistage, prévention, traitement, Expertise Collective INSERM, 1997.
- Chronic Hepatitis B, Hepatology, 2007 Feb;45(2):507-39, Lok AS, McMahon BJ.
- Antiviral drugs in current clinical use, Journal of Clinical Virology 30 (2004) 115–133, Erik De Clercq
- Drug Targets and Molecular Mechanisms of Drug Resistance in Chronic Hepatitis B, Gastroenterology 2007;132:1574–1585, M. GHANY, T. J. LIANG
- Telbivudine for the Management of Chronic Hepatitis B Virus Infection, Clinical Therapeutics 2007;29(12):2635-2653, S. James Matthews
- Entecavir for the Treatment of Chronic Hepatitis B Virus Infection, Clinical Therapeutics 2006;28(2):184-201, S. James Matthews
- Adefovir Dipivoxil: A New Antiviral Agent for the Treatment of Hepatitis B Virus Infection, Clinical Therapeutics 2003;25(12):184-201, Roula B. Qaqish, Keri A. Mattes, David J. Ritchie
- Treatment of chronic viral hepatitis, Réanimation 2007;16:618-625, V. Vochelle, C. Trépo, P. Merle
- Nucleoside analogues resistance in the treatment of chronic hepatitis B virus infection, La revue de médecine interne 24 (2003) 786–793, P. Halfon, S. Pol, M. Bourlière, J. Courcambeck, P. Cacoub
Bibliographie générale
- Christian Trépo, Philippe Merle, Fabien Zoulim : Hépatites virales B et C , (Pour professionnels, patients et entourage), Ed.: John Libbey Eurotext, 2006, Coll.: Pathologie science formation , ISBN 2742006044
- Portail de la médecine
- Portail des maladies infectieuses
Catégorie : Hépatite
Wikimedia Foundation. 2010.