- Hydrate de méthane
-
 Combustion d’hydrate de méthane (USGS).
Combustion d’hydrate de méthane (USGS).
Cadre en haut à gauche : structure du clathrate.Un hydrate de méthane (ou clathrate de méthane) est un composé organique naturellement présent dans les fonds marins, sur certains talus continentaux, ainsi que dans le pergélisol des régions polaires. C'est un des réservoirs de carbone planétaires.
Les hydrates de méthane sont une source potentielle d’énergie fossile pour remplacer le pétrole (ils sont réputés présents en grande quantité, surtout en fond marin, mais sont difficilement exploitables) ; ils restent une source directe de méthane ou indirecte de CO2, deux puissants gaz à effet de serre.
Appelé familièrement « glace qui brûle » ou « glace de méthane », ce composé glacé est inflammable dès qu'il fond et en présence d'oxygène ou d'un oxydant : il s’agit en effet d’une fine « cage » de glace dans laquelle est piégé du méthane (un clathrate) issu de la décomposition de matière organique relativement récente (par rapport à celle qui a donné le pétrole et le gaz naturel) effectuée par des bactéries anaérobies.
Lors de la production de gaz naturel, d'autres hydrates peuvent se former (éthane et propane). Lorsque la longueur de la molécule augmente (butane, pentane), les hydrates formés ne peuvent plus entrer dans la structure en cage formée par la glace et ont tendance à déstabiliser la formation d'hydrates.
Les hydrates de gaz naturels (Natural gas hydrate ou NGH en anglais) sont caractérisés par une plus faible pression (25 mégapascals, compression 1/170) et une plus haute température (0°C), que les LNG (Liquified natural gas, gaz naturels liquéfiés) ou les CNG (Compressed natural gas, gaz naturels comprimés).
Sommaire
Découverte
Le navire de recherche Sonne remonte en juillet 1996 de l’océan Pacifique, et d’une profondeur de 785 m, 500 kg d’hydrate de méthane[1].
La structure des hydrates de méthane
L'hydrate de méthane est formé de molécules d'eau formant des cages qui piègent des molécules de gaz comme le méthane ou le sulfure d'hydrogène (gaz tous deux présents dans l'hydrate remonté par le navire Sonne). Ces cages peuvent stocker de considérables quantités de gaz (par exemple 164 cm3 de méthane dans 1 cm3 d'hydrate).
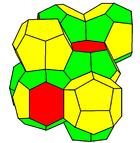
Plus précisément, la structure de base de l'hydrate de méthane correspond à la structure de type I des clathrates de gaz[2] : cette structure [3] (également appelée structure de Weaire-Phelan) comprend 2 cages de petite taille et 6 cages de plus grande taille :- chacune des 2 cages de petite taille a la forme d'un dodécaèdre irrégulier (polyèdre formé de 12 faces en forme de pentagones irréguliers et qui comprend 30 arêtes et 20 sommets) ;
- chacune des 6 cages de grande taille a la forme d'un trapèzoèdre hexagonal tronqué (polyèdre formé de 2 hexagones réguliers et de 12 pentagones irréguliers et qui comprend 36 arêtes et 24 sommets) ;
- chacun des sommets de ces 8 cages est occupé par une molécule d'eau tandis que le gaz méthane occupe l'intérieur de ces cages.
Certains de ces sommets étant communs à deux ou plusieurs cages, le nombre total de molécules d'eau de la structure de base de l'hydrate de méthane n'est que de 46 molécules (au lieu de 184) !Réservoirs naturels
Les hydrates de méthane sont stables à basse température et à forte pression.
Ces conditions se rencontrent dans deux milieux très différents :
Réservoir océanique
Du méthane est stocké sous forme d'hydrates de méthane dans les sédiments océaniques profonds et au niveau des talus continentaux à des profondeurs de quelques centaines de mètres.
Réservoir continental
On trouve également des hydrates de méthane dans le pergélisol des régions circumpolaires de l'Eurasie et de l'Amérique.
Inventaire
Depuis les premières estimations dans les années 1970, la quantité d'hydrate de méthane dans le réservoir océanique a été révisée à la baisse mais reste considérable. Selon une estimation récente[4], cette quantité serait comprise entre 1 et 5×1015 m3 de gaz, soit entre 0,5 et 2,5 ×1012 tonnes de carbone. La quantité d'hydrates de méthane dans le réservoir continental est moins bien connue. La surface relativement faible (10 millions de km²) occupée par le pergélisol laisse supposer qu'elle est moindre que dans le réservoir océanique.
Par comparaison, les réserves connues de pétrole en 2005 étaient d'environ 2×1011 m3 (voir l'article Réserves pétrolières).
Applications
Source potentielle d'énergie
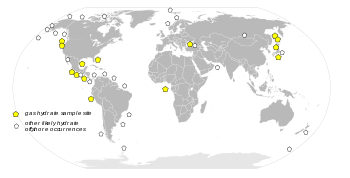 Distribution mondiales des ressources supposées ou confirmées d'hydrate de méthane, 1996.
Distribution mondiales des ressources supposées ou confirmées d'hydrate de méthane, 1996.
Source: USGSLes réserves d'hydrate de méthane sont si considérables que de nombreuses compagnies pétrolières s'y intéressent. Mais la récupération de ce composé est difficile et coûteuse, voire dangereuse pour le climat planétaire et les difficultés technologiques qui en résultent semblent actuellement loin d'être résolues.
Les Japonais, qui ont un besoin vital de nouvelles sources d'énergie, ont beaucoup investi dans le domaine, avec un programme de recherche (2001-2008) visant à localiser et qualifier les ressources sous-marines potentielles du pays, puis un plan de sept ans (« Programme sur l'exploitation de l'énergie marine et des ressources marines », voté en mars 2009). Deux extractions expérimentales devraient être faites en 2012 et en 2014 dans le secteur de la Fosse de Nankai au Sud du pays où des ressources importantes ont été détectées[5],[6]
Des hydrates de méthane ont déjà pu être exploités à Messoyakha (petit champ gazier peu profond de Sibérie occidentale, situé juste à la limite de stabilité des hydrates de méthane ; En conséquence, sa partie basse était un gisement de gaz "normal" (du gaz libre dans du sable) tandis que le haut était rempli d'hydrates. L'exploitation du gaz conventionnel a réduit la pression et a déstabilisé les hydrates, dont le méthane a alors pu être utilisé.
L'exploitation des hydrates de méthane pourrait poser de sérieux problèmes en matière d'effet de serre. Leur combustion émet en effet du CO2, mais pas plus que le gaz naturel (et moins que le charbon et le pétrole). Un risque est qu'en exploitant les hydrates sous-marins instables, l'on fasse involontairement remonter de grandes quantités de méthane dans l'atmosphère (cela équivaudrait à exploiter du gaz naturel avec des fuites énormes), or le méthane a un pouvoir beaucoup plus élevé que le CO2 en tant que gaz à effet de serre. Son potentiel de réchauffement global mesuré à l'échelle d'un siècle à partir de sa diffusion dans l'atmosphère est en effet compris entre 22 et 23 fois celui du dioxyde de carbone. Et cela en tenant compte d'une durée de vie moyenne des molécules de CH4 de seulement une douzaine d'années avant leur décomposition par les UV, des phénomènes de combustion ou d'oxydation, et diverses réactions chimiques.
Les industriels doivent tester en mer des méthodes de décompression des hydrates permettant de le récupérer intégralement. C'est un des projets du Japonais JOGMEC[7].
Un projet allemand dit « SUGAR (acronyme signifiant Submarine Gashydrat-Lagerstätten: Erkundung, Abbau und Transport)» lancé l'été 2008 par l'Institut Leibniz pour les sciences marines de Kiel[8], sous tutelle des Ministères fédéraux de l'économie et de la technologie (BMWi) et de l'enseignement et la recherche (BMBF) avec 30 partenaires économiques et scientifiques, avec un budget initial de près de 13 millions d'euros vise à extraire du méthane marin et à stocker à sa place du CO2 capté sur des centrales thermiques ou autres installations industrielles[9].
Rentabilité économique
Les études de production
Des études japonaises et américaines ont été réalisées depuis 2001 dans le but de démontrer que l'imperméabilisation d'un système d'approvisionnement NGH était possible dans le cadre de l'exploitation des gisements de gaz naturel offshore et non pas dans l'exploitation des gisements d'hydrates eux-mêmes (puisque celle-ci n'a pas encore pu être réalisée de façon effective dans un cadre d'approvisionnement à l'échelle industrielle).
Les études de faisabilité réalisées à cet effet ont donc démontré que l'utilisation de systèmes d'approvisionnement NGH basés sur les techniques de production d'hydrate de méthane synthétique était rentable dans le cadre d'une exploitation rationnelle des gisements de gaz naturel de moyenne et moindre importance : l'exploitation des gisements de gaz naturel comprend par définition un investissement très important dans les technologies de liquéfaction du gaz. L'investissement de base et le coût de construction et de mise en service d'une unité de liquéfaction rend l'exploitation des gisements de faible ou moyenne importance non économiquement viable.
Transport et stockage du méthane
L'exploitation des hydrates de méthane ne se limite pas aux fonds sous-marins. En effet, les hydrates de méthane sont une bonne alternative pour le transport du méthane sur des distances relativement longues. Ainsi, on réduirait grâce aux hydrates de méthane le transport dangereux du gaz naturel liquéfié ou encore la construction de gazoducs.
De plus, le transport des hydrates par bateau pourrait être moins coûteux en énergie que celui du gaz naturel liquéfié, car les conditions de température et de pression seraient moins difficiles à préserver que dans les méthaniers actuels. À contrario, la quantité finale de gaz libre transportée par rapport au poids de la cargaison est en la défaveur des hydrates au niveau du coût de transport.
Si la distance reste inférieure à 6 000 km, le système d'acheminement NGH devient alors moins coûteux que le classique LNG. La production et la regazéification étant à la base déjà moins coûteuses avec le NGH et nécessitant de moindres investissements, le système marque ici toute sa supériorité sur le système de compression classique par liquéfaction du gaz naturel.
Natural Gas Hydrate (NGH) [réf. nécessaire] Liquefied Natural Gas (LNG) [réf. nécessaire] Modes de transport et de stockage Solide Liquide Température de transport -20 °C -162 °C Densité 0,85 - 0,95 0,42 - 0,47 Contenus d'1 m³ de produit 170 m³ CH4 et 0,8 m³ H2O 600 m³ CH4 Des recherches sont en cours de développement pour :
- permettre de transformer le méthane gazeux en hydrates pour son transport entre le gisement et le centre de consommation.
- produire des hydrates de méthane en tant que stock d'hydrogène susceptible d'être utilisé dans des piles à combustibles
- maîtriser la formation d'hydrates de méthane dans les gazoducs où ces hydrates peuvent boucher des canalisations et/ou les endommager lorsqu'ils dégèlent. À cette fin, des biologistes tentent de comprendre comment certains organismes vivant peuvent inhiber la production de ces hydrates[10].
- transposer au CO2 des technologies proches de celles qui pourraient être développées pour les hydrates de méthane, avec l'idée de pouvoir « emprisonner » le CO2 dans de la glace (comme le méthane) et former ainsi des hydrates de CO2. Ceci pourrait peut-être permettre de garder sous pression les gisements sous-marins d'hydrates de méthane s’ils deviennent exploitables, et ainsi limiter aussi le dégagement du CO2 dans l'atmosphère.
Hydrates de méthane et changement climatique
On craint que le réchauffement climatique puisse suffisamment élever la température du pergélisol pour que les clathrates qui y sont présents fondent au moins partiellement, ce qui relâcherait énormément de méthane dans l'atmosphère, lequel viendrait à son tour augmenter l'effet de serre, d'où un effet d'emballement.
Voir aussi
Références
- (fr) Archimède : Énergie des abysses, émission du 26 octobre 1999, sur Arte.tv.
- voir le dossier "Les océans", Pour la Science n° 73 d'octobre-décembre 2011, page 11
- on connaît 2 autres structures possibles pour les clathrates de gaz, la structure II et la structure H, mais elles correspondent à d'autres gaz que le méthane
- A.V. Milkov, 2004, Global estimates of hydrate-bound gas in marine sediments: how much is really out there?, Earth-Sci. Rev., vol. 66, n° 3-4, p. 183-197.
- H. Saito et N. Suzuki, Terrestria organic matter controlling gas hydrate formation in the Nankai Trough accretionary prism, offshore Shikoku, Japan - Journal of Geochemical Exploration, 95 (2007) 88-100
- Vers des expériences sous-marines d'extraction d'hydrate de méthane (Bulletin ADIT/Ambassade de France au Japon / BE Japon 501 18/05/2009)
- site internet de JOGMEC
- IFM-GEOMAR ; Kieler Leibniz Institut für Meereswissenschaften
- Communiqué relatif au projet SUGAR
- CNRC canadien, avec Virginia Walker, biologiste de l'Université Queen's, et Peter Englezos, ingénieur chimiste de l'Université de la Colombie-Britannique, cités par le bulletin ADIT 335 de l'ambassade de France au Canada, en mai 2008
Bibliographie
- Le méthane et le destin de la Terre : les hydrates de méthane : rêve ou cauchemar? Gérard Lambert, Jérôme Chappellaz, Jean-Paul Foucher, Gilles Ramstein; préface de Édouard Bard; EDP Sciences 2006
Liens externes
- (fr) Les hydrates de méthane: une réserve énergétique énorme, mais une bombe écologique en puissance, département de géologie et génie géologique de l’Université Laval.
- (fr) Études sur les hydrates de gaz naturels au Canada, article publié dans le "Recorder", Canadian Society of Exploration Geophysicists.
- (fr) Comprendre les sources d'énergie
Catégories :- Hydrate
- Énergie fossile
- Changement climatique
- Gaz
- Matières premières
- Gisement d'hydrocarbures
- Abysses
Wikimedia Foundation. 2010.