- Histone H1
-
Histone
Les histones sont des protéines basiques en contact étroit avec l'ADN. À ce jour, cinq histones sont décrites :
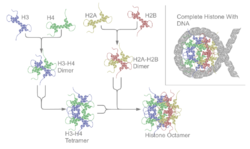
- les histones H2A, H2B, H3 et H4 forment un octamère globulaire (de structure 2x(H2A,H2B,H3,H4)) qui permet l'enroulement de 146 paires de bases d'ADN en un tour trois quart afin de former un nucléosome ou "collier de perles" : 1er degré de condensation de l'ADN (11 nm) ;
- l'histone H1 permet quant à elle la compaction des nucléosomes et rigidifie la structure hélicoïdale ainsi obtenue (obtention d'un solénoïde : 2ème degré de condensation de l'ADN - 30 nm -). Contrairement à plusieurs ARNm, les histones n'ont généralement pas de queue poly(A).
Il y a environ deux cents paires de bases entre deux nucléosomes, cette valeur variant selon les espèces (par exemple, on en compte cent soixante cinq pour la levure). Le niveau suivant de compaction de l'ADN fait intervenir d'autres protéines dites « non histones. »Le degré de condensation de l'ADN autour des nucléosomes d'histones et des protéines non histones est variable le long des chromosomes, dans la chromatine. Il est faible dans l'euchromatine que l'on dit « ouverte » et accessible à la machinerie des ARN polymérases. Il est élevé dans l'hétérochromatine, que l'on dit « fermée » et « inaccessible » à la machinerie de transcription.
Ce degré de condensation est regulé par des modifications des extrémités N-terminales des histones, comme des phosphorylations, acétylations, méthylations, ubiquitinations, sumoylations, etc. l'ensemble de ces modifications étant catalysées par des enzymes spécifiques. Les modifications covalentes des histones agiraient soit directement en modifiant la compaction de l'enroulement d'ADN autour des nucléosomes, soit indirectement en constituant des « marques » permettant le recrutement de protéines capables de modifier la structure de la chromatine. Le modèle des modifications covalentes des histones agissant comme un code (le « code des histones ») a été proposé par Strahl et Allis en 2000 dans la revue Nature. Cependant, ce code est, semble-t-il, loin d'être universel et plutôt relativement spécifique selon les gènes et les cellules considérés.
Dans les spermatozoïdes, les histones sont remplacées par des protamines, protéines riches en arginine et en cystéine. La richesse en cystéine permet la formation de pont disulfure. Cette structure protège l'ADN lors d'éventuels déplacements liés à la fécondation.
Le code des Histones
Le code des histones établit un lien direct entre la modification de certains résidus de la queue des histones qui crée des liaisons pour des effecteurs protéiques et l’état transcriptionnel de la chromatine. Une modification d’histone peut en influencer une autre de manière synergique ou antagoniste ; c’est un mécanisme qui génère et stabilise des empreintes spécifiques. L’acétylation (ajout de groupement acétyl) s’effectue sur certains résidus lysine précis par des enzymes nommées histones acétyl transférases (HAT). Elle diminue généralement l’interaction inter-nucléosomes et entre les queues des histones et le fragment d’ADN qui fait le lien entre les nucléosomes. Ceci entraîne le relachement de la chromatine, la faisant passer à l'état euchromatinien, et permet ainsi une meilleure accessibilité aux autres facteurs. L’acétylation est associée à une activation de la transcription et est facilement réversible grâce à l’action des histones désacétylases (HDAC).
La méthylation, quant à elle, peut s’effectuer soit sur des lysines soit sur des arginines. C’est une modification stable et jusqu’alors très peu d’histones déméthylases ont été découvertes. Selon les résidus méthylés elle est associée à une activation ou une répression de la transcription.
De manière générale, ces deux types de modifications sont antagonistes, et la désacétylation des lysines doit précéder leur méthylation. Cet antagonisme entraine la mise en place d'un certain équilibre dynamique entre les territoires hétérochromatiniens (généralement non exprimables et méthylés sur certains acides aminés clés) et euchromatiniens (généralement exprimables et acétylés). Par exemple, la Lysine 9 de l'histone H3 est connue pour être associée à une répression de la chromatine environnante lorsqu'elle est méthylée. Cette méthylation est reconnue par une protéine, HP1, qui se fixe donc sur H3 méthylée. À son tour, HP1 attire la protéine Suv39, une Histone MethylTransférase, qui pourra méthyler la lysine 9 de l'histone H3 du nucléosome voisin, et ainsi de suite. On voit donc, comment, de proche en proche, les histones H3 seront méthyléés et la chromatine sera condensé. Cependant, cette invasion hétérochromatinienne sera stoppée si la lysine 9 de H3 rencontrée est déjà acétylée. Ainsi se met en place un équilibre compétitif entre domaine chromatiniens exprimés et réprimés.
Les modifications des queues d'histones jouent le rôle de « marques » épigénétiques qui entraînent le recrutement de différentes classes de protéines, puisque les lysines acétylées ou méthylées sont reconnues par des domaines protéiques différents. De plus, le recrutement de certains facteurs au niveau de la chromatine nécessite l’existence préalable de modifications d’histones et de protéines déjà liées. Le code des histones est donc interprété dans le contexte d’autres facteurs associés à la chromatine et c’est la combinaison d’interaction entre les histones modifiées et d’autres facteurs qui détermine si une protéine est recrutée à la chromatine.
Les variants d'histones
Dans plusieurs espèces eukaryotes, des variants d’histones ont été découvert. Ces variants ont une séquence qui diffère au niveau de quelques acides aminés en comparaison avec les histones dits canoniques. Ces variants jouent des rôles majeurs dans différents aspects de la biologie tels que la réparation de l’ADN[1], l’organisation centromerique[2], l’inactivation du chromosome sexuel[3] et une condensation spécifique des cellules gametes males[4][5].
Références
- ↑ Histone H2A variants H2AX and H2AZ
- ↑ Centromere-specific assembly of CENP-a nucleosomes is mediated by HJURP.
- ↑ H2AX is required for chromatin remodeling and inactivation of sex chromosomes in male mouse meiosis
- ↑ Analysis of the histone H3 gene family in Arabidopsis and identification of the male-gamete-specific variant AtMGH3.
- ↑ The role of histones in chromatin remodelling during mammalian spermiogenesis
Catégories : Expression génétique | Information génétique
Wikimedia Foundation. 2010.