- 1314-51-8
-
Sesquisulfure de phosphore
Sesquisulfure de phosphore 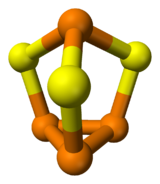
Structure chimique du Sesquisulfure de Phosphore Général Nom IUPAC Sesquisulfure de phosphore No CAS Apparence solide jaune Propriétés chimiques Formule brute P4S3 [Isomères] Masse molaire 220,09 g∙mol-1
P 56,29 %, S 43,71 %,Propriétés physiques T° fusion 174 °C T° ébullition 408 °C Masse volumique 2.08 g∙cm-3 solide[1] Précautions Directive 67/548/EEC 
Xn
F
NPhrases R : 11, 22, 50, Phrases S : (2), 7, 16, 24/25, 61, SGH[2] 


DangerUnités du SI & CNTP, sauf indication contraire. Le sesquisulfure de Phosphore est un composé chimique de formule chimique P 4S3.
En fonction de leur pureté, la couleur des échantillons peut varier du jaune-vert au gris.
Sommaire
Histoire
La première allumette inflammable par friction est l'invention du chimiste anglais John Walker en 1827. Il mit au point un mélange de sulfure d'antimoine (III), de chlorate de potassium, gomme et d'amidon, qui pouvait s'enflammer en frottant sur une surface rugueuse. Les premières allumettes présentaient d'importants défauts, la flamme étant instable et la réaction trop violente. De plus, l'odeur qu'elles produisaient était désagréable.
En 1831, le français Charles Sauria ajouta du phosphore blanc afin d'atténuer l'odeur. L'allemand Jakob Friedrich Kammerer fut à l'origine de leur production industrielle en 1832. Ces allumettes étaient encore instables et devaient être conservées dans une boîte hermétique. Malheureusement, les ouvriers qui travaillaient à leur fabrication étaient atteints par des maladies osseuses, en particulier au niveau des mâchoires, liées à l'exposition au phosphore blanc (Ostéonécrose du maxillaire). Après une campagne dénonçant ces pratiques, qui menaient à des infirmités graves, défigurantes et parfois mortelles, des actions législatives contraignirent l'industrie à changer de méthode et à protéger les ouvriers.
Le Sesquisulfure de phosphore a été découvert par G. Lemoine. En 1899 deux chimistes Français, Savene et Cahen, avaient démontré que le produit n’était pas toxique et pouvait être utilisé pour fabriquer des allumettes de sûreté et ils brevêtèrent leur procédé. La même année Albright et Wilson fut la première entreprise à produire commercialement le sesquisulfure de phosphore bien qu’il soit instable et dangereux à fabriquer.
Il se dissout à part égale dans le sulfure de carbone (CS2), ce qui souligne la remarquable capacité du CS2 à dissoudre les composés riches en soufre.
Cette molécule hétérocyclique possède symétrie moléculaire C3v. Il s'agit d'un dérivé du phosphore (P4), obtenu par insertion d'atomes de soufre entre trois liaisons P-P. Les distances PS et PP sont dont respectivement de 2,090 et 2,235 Å. [1]
Autres sulfures de phosphores et sélénides
Plusieurs molécules de sulfure de phosphore sont connues en plus de P4S3: trois isomères de P4S4, Deux isomères de P4S5, P4S6, P4S7, P4S8, P4S9, et le pentasulfure de P4S10.[3] Le P4S2 est également connu mais instable au dessus de -30 °C.[4]
P4Se3 and P4S3 adoptent les mêmes structures.
Applications
P4S3 est un intermédiaire dans la production du pentasulfure de phosphore (P4S10).
Un mélange moitié-moitié, en poids, de P4S3 et de chlorate de potassium, associé à d'autres matériaux, permet de fabtiquer les têtes d’allumettes utilisables sans "grattoir".[5] Mais aussi des allumettes de sûreté, encore appelée « allumettes suédoises » en raison de la nationalité suédoise de son inventeur Gustaf Erik Pasch, datant de 1844. La « sûreté » provient du fait qu'elle nécessite un grattoir spécial, dont les éléments chimiques interagissent avec ceux de l'extrémité de l'allumette pour s'enflammer. Le grattoir est composé de poudre de verre et de phosphore rouge, tandis que l'extrémité de l'allumette est enduite de sulfure d’antimoine et de chlorate de potassium. La chaleur engendrée par le frottement transforme le phosphore rouge en phosphore blanc, qui à son tour contribue à l'inflammation de l'allumette. Une société américaine développa un procédé similaire et le breveta en 1910.
Voir aussi
- Phosphore Chimie
- Phosphore législation maladie professionnelle
- Ostéonécrose du maxillaire
- allumettes
- grève des ouvrières des manufactures d’allumettes à Londres en 1888
Références
- ↑ a et b Leung, Y. C.; Waser, J.; van Houten, S.; Vos, A.; Wiegers, G. A.; Wiebenga, E. H. “The crystal structure of P4S3”. Acta Crystallographica , Volume 10, pages 574-582, year 1957. DOI:10.1107/S0365110X57002042
- ↑ Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- ↑ Holleman, A. F.; Wiberg, E. Inorganic Chemistry. Academic Press: San Diego, 2001. (ISBN 0-12-352651-5).
- ↑ Heal, H. G. The Inorganic Heterocyclic Chemistry of Sulfur, Nitrogen, and Phosphorus. Academic Press: London; 1980. (ISBN 0-12-335680-6).
- ↑ D. E. C. Corbridge. Phosphorus: An Outline of its Chemistry, Biochemistry, and Technology. 5th Edition. Elsevier: Amsterdam 1995. (ISBN 0-444-89307-5). For a discussion of safety matches, see pages 115-116.
- Portail de la chimie
Catégories : Composé du phosphore | Produit chimique nocif | Produit chimique facilement inflammable | Produit chimique dangereux pour l'environnement | Sulfure
Wikimedia Foundation. 2010.
