- Entropie d'un corps pur
-
Le troisième principe de la thermodynamique stipule que l'entropie d'un corps pur est nulle à la température de 0 K. Donc on peut calculer l'entropie molaire d'un corps pur de façon absolue. Ce calcul permet de dresser des tables thermodynamiques où sont reportées les entropies molaires standards de la plupart des composés, définies à la température de référence de 298 K:
 .
.Les entropies molaires standards permettent de calculer l'entropie standard de réaction,
 et d'avoir ainsi accès à l'enthalpie libre standard de réaction à T, connaissant les enthalpies standards de formation:
et d'avoir ainsi accès à l'enthalpie libre standard de réaction à T, connaissant les enthalpies standards de formation:et à la constante d'équilibre,
 .
.Sommaire
Rappels thermodynamiques
Les grandeurs thermodynamiques d'une quantité déterminée de corps pur ( n constant) ne dépendent que de deux variables indépendantes.
À pression constante on choisit la fonction d'état enthalpie dont la variation est égale à la chaleur mise en jeu.
Fonction d'état enthalpie : H(T,p)
Sa différentielle est égale à:

Si p = cte

la grandeur
 est la capacité calorifique molaire à pression constante, appelée
est la capacité calorifique molaire à pression constante, appelée  et qui s'exprime en J.K-1.mol-1.
et qui s'exprime en J.K-1.mol-1.La chaleur mise en jeu pour une mole est donc égale à:

Pour n moles

Variation de l'entropie d'un corps pur à pression constante
Variation en fonction de T
La différentielle de l'entropie est égale à:

Donc pour une transformation isobare mettant en jeu n moles, partant de la température T1 jusqu'à la température T2, la variation d'entropie sera égale:

Cp est la capacité calorifique molaire à pression constante du corps pur qui peut être solide, liquide ou gazeux: Cp(sol); Cp(liq); Cp(gaz).
Cp est fonction de T mais si l'intervalle de T n'est pas trop important (quelques dizaines voire centaines de degrés) on peut considérer en première approximation que Cp est constant. Il s'ensuit:

Cette relation approchée est valable pour les trois états de la matière.
Variation au cours d'un changement d'état
Lors du changement d'état d'un corps pur effectué à T et P constantes, la variation d'entropie est égale au rapport de l'enthalpie de changement d'état appelée encore chaleur latente molaire de changement d'état:L, sur la température de changement d'état. Par exemple pour la fusion:

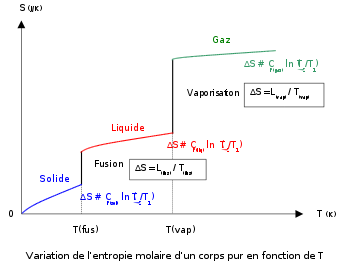
Diagramme S = f(T) à pression constante
Il est possible de matérialiser sur un diagramme l'évolution de l'entropie d'un corps pur en fonction de T. Comme son entropie est nulle à zéro kelvin, on peut ainsi calculer sa valeur absolue. L'entropie est la seule fonction d'état thermodynamique, calculable.
Remarques
- Le diagramme proposé ci-contre correspond au cas de figure où l'on observe la succession des phases: solide, liquide et gaz au cours du chauffage d'un corps pur, effectué à pression constante. Cela signifie que la pression choisie est supérieure à celle du point triple figurant dans le diagramme de phase du corps pur. Dans le cas contraire, le gaz est formé directement à partir du solide par sublimation (c'est le cas par exemple de la neige carbonique à la pression atmosphérique).
- En toute rigueur, la capacité thermique Cp est fonction de T: Cp = a + bT + cT2 . Cette expression n'est valable que si la température n'est pas proche de 0 K. En revanche, pour des valeurs proches du zéro absolu (jusqu'à quelques dizaines de degrés), la capacité thermique suit le modèle de Debye: Cp = cte.T3. Cette dernière expression est compatible avec le fait que l'entropie est nulle à 0 K et permet d'éviter une division par zéro dans le calcul de l'entropie.
Variation de l'entropie en fonction de P à T constante
Les solides et les liquides sont des phases condensées peu compressibles, c’est-à-dire peu sensibles à la pression. Si la valeur de la pression est proche de quelques dizaines d'atmosphères, l'influence de celle-ci sur les grandeurs d'état est de ce fait, négligeable. Il n'en est pas de même pour les gaz qui eux, sont compressibles et donc sensibles à la pression.
Calculons la variation d'entropie d'un gaz parfait en fonction de P à T constante.
Ecrivons la différentielle de l'enthalpie


- Appliquons le premier principe

avec: δWfp : travail des forces de pression
- Appliquons le second principe
 , si l'on suppose que la transformation est réversible.
, si l'on suppose que la transformation est réversible.d'où

et

d'où
 car pour un gaz parfait, H ne dépend que de T.
car pour un gaz parfait, H ne dépend que de T.Si la température est constante, on obtient:

Il s'ensuit si le gaz est parfait:
 et
et 



Lors d'une détente ( p2 < p1 ), l'entropie d'un gaz parfait augmente. La détente est un phénomène spontané irréversible au cours duquel le gaz occupe tout le volume qui lui est offert ( V2 > V1 ). L'augmentation d'entropie est donc conforme au second principe de la thermodynamique.
Voir
Catégories :- Grandeur thermodynamique
- Grandeur en thermochimie
Wikimedia Foundation. 2010.