- Addition electrophile
-
Addition électrophile
L’Addition électrophile est une réaction chimique d’addition en chimie organique où une liaison π est supprimée par la création de deux liaisons covalentes.
Sommaire
Principe général
 attirance d'un électrophile par des électrons π
attirance d'un électrophile par des électrons π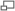
L'addition électrophile se base sur l'attirance qu'a un groupement électrophile pour le champ des électrons π d'une double liaison (d'un alcène dans la plupart des cas). Les liaisons π sont en effet bien plus cassables que les liaisons σ.
 .
.Une addition consiste donc à l'appropriation des électrons π par un électrophile qui formera une liaison σ avec l'un des carbones de la double liaison. Dans la majorité des cas, l'addition électrophile sera suivie de l'addition d'un nucléophile. Cette réaction conduira à un grand nombre de composés, tels que des alcools, thiols, halohydrines ou encore époxydes.
Addition de H+
Synthèse de composés halogénés
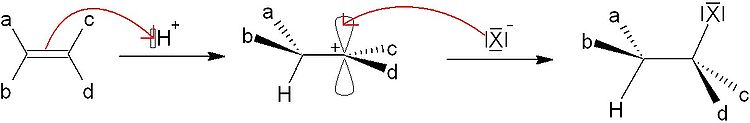
L'ajout d'un acide halohydrique (chlorhydrique, bromhydrique ou iodhydrique) sur un alcène conduit à la formation d'un composé halogéné. L'électrophile H+ réagit sur les électrons π pour conduire à un carbocation intermédiaire. L'ion halogénure restant vient alors attaquer le carbone déficitaire pour finalement former la molécule halogénée. On constate donc que l'addition électrophile et nécessairement suivie d'une addition nucléophile pour stabiliser le carbocation.
- Régiosélectivité : le proton H+ choisira de se positioner sur le carbone permettant de conduire au carbocation le plus stable. Cette règle est connue sous le nom de régiosélectivité de Markovnikov.
Exemple : Le propylène CH3-CH=CH2 pourra passer par l'intermédiaire CH3-CH2-C+H2 ou CH3-C+H-CH3. Les effets inductifs des méthyles stabilisent le deuxième carbocation. D'après la règle Markovnikov, c'est donc ce dernier qui se formera à quasiment 100%.
- Stéréosélectivité : quelle que soit la configuration de l'alcène de départ (Z ou E lorsque les a≠b≠c≠d), la réaction conduira a un mélange des quatre stéréoisomères (si les deux carbones sont asymétriques) RR, SS, RS et SR, l'halogénure X- attaquant indifféremment le carbocation par un côté ou l'autre. Cette synthèse n'est donc pas stéréosélective, il n'y a aucun intérêt à choisir l'isomère Z plutôt que le E au départ, et inversement.
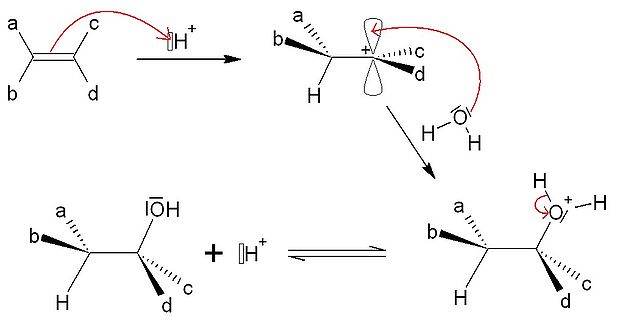
Hydratation, synthèse d'alcools
Selon un procédé identique, on peut hydrater un alcène pour former un alcool. On a besoin d'être en milieu acide pour activer la réaction (formation du carbocation). La forme oxonium R-O+H2 est en équilibre avec l'alcool sur le papier mais comme on est en présence d'une catalyse homogène acide, l'ion H+ formé réagit avec l'alcène de départ et donc déplace l'équilibre vers la formation de l'alcool.
Cette réaction n'est pas stéréosélective, et la régiosélectivité est toujours liée au carbocation intermédiaire (H+ est toujours l'électrophile).
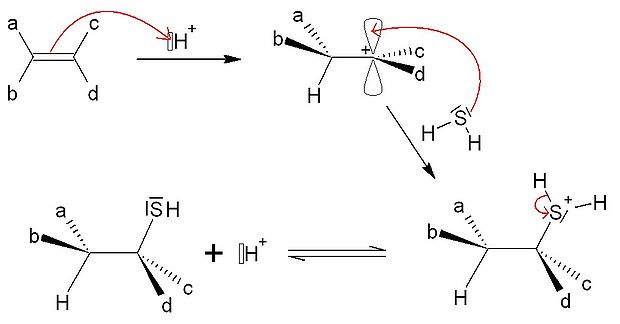
Synthèse de thiols
L'addition de l'analogue soufré de l'eau, c'est-à-dire l'acide sulfhydrique (ou sulfure d'hydrogène) H2S, conduit quant à elle à la synthèse d'un thiol, qui est lui l'analogue d'un alcool.
Les propriétés de cette réactions sont les mêmes que pour l'addition de l'eau.
Addition de X+
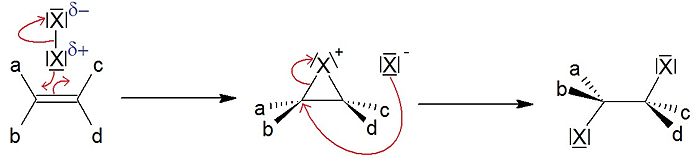
Addition de dihalogènes
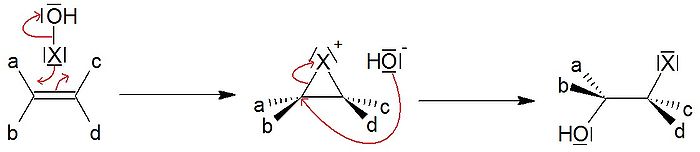
Article détaillé : Halogénation.Lorsqu'un dihalogène X2 (Cl2, Br2, I2) est proche du champ des électrons π d'une double liaison, il se polarise. Dans le cas du brome, X+ vient ensuite former sur le substrat un pont halonium (bromonium) par dessus la liaison C-C. L'halogénure X- préalablement libéré attaque ce composé intermédiaire en anti, générant ainsi un composé dihalogéné.
- Cette réaction ne présente pas de régiosélectivité particulière, en raison de la symétrie du pont halonium qui couvre la totalité de la liaison C-C.
- Par contre, cette addition est qualifiée de diastéréosélective. En effet, l'attaque de l'halogénure se faisant en anti, on forme un couple d'énantiomères (si les deux carbones sont asymétriques). De plus, si l'on part de l'isomère configurationnel Z et que l'on obtient le couple RR/SS, alors on obtient le couple RS/SR avec l'isomère E, et vice-versa. Le terme de diastéréosélectivité est conservé si le couple RS/SR est un composé méso.
Addition d'acides hypohalogéneux, synthèse d'halohydrines
Selon le même principe, les acides hypohalogéneux (HOX) viennent réagir sur une double liaison pour former un composé présentant un groupement hydroxyde et un halogène sur le carbone voisin. Ces composés sont appelés halohydrines.
Les atomes d'oxygène n'ayant pas forcement la même priorité selon Cahn, Ingold et Prelog que les halogènes, on n'obtiendra pas les mêmes stéréoisomères qu'avec l'addition d'un dihalogène. On a toutefois toujours une réaction diastéréspécifique.
Formation d'epoxydes
Article détaillé : époxyde.L'action d'un peracide sur un alcène conduit à un époxyde
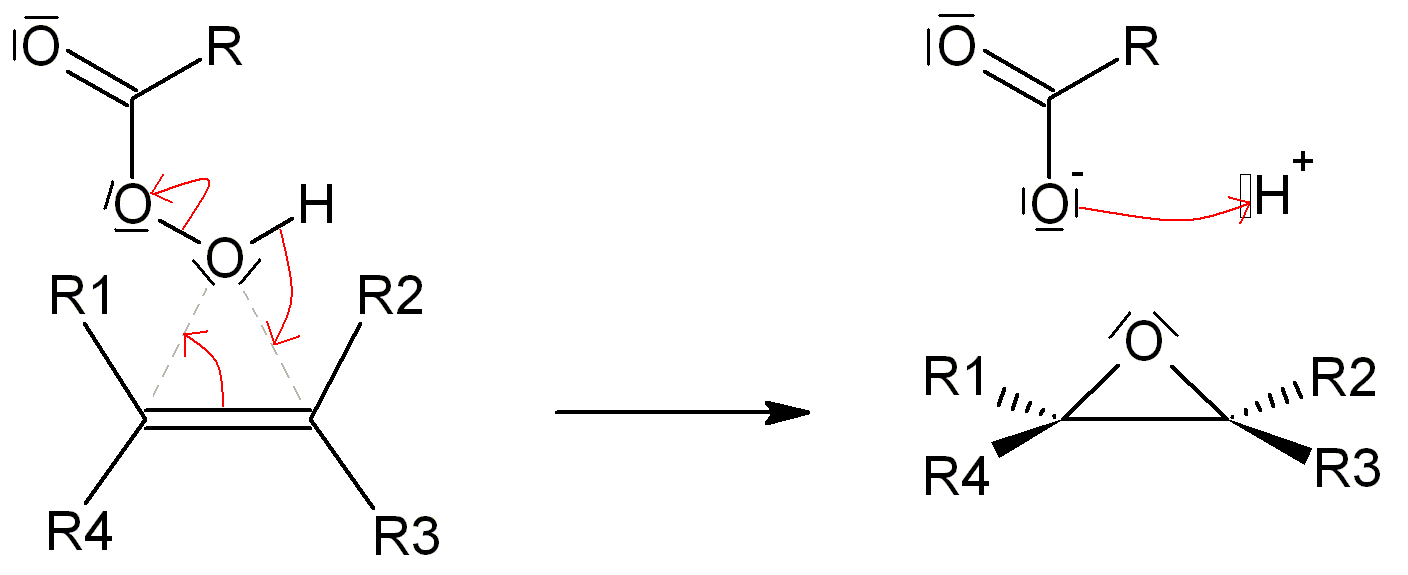
Bien que très stable, on peut ensuite attaquer l'époxyde par un nucléophile fort, à l'instar de l'attaque d'un pont halonium. On peut ainsi générer une grande palette de composés.
Voir aussi
- Portail de la chimie
Catégorie : Réaction d'addition
Wikimedia Foundation. 2010.