- Cinetique enzymatique
-
Cinétique enzymatique
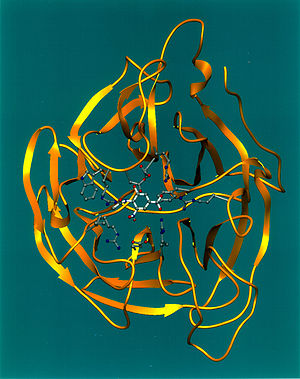 Neuraminidase du virus de la grippe aviaire représentée avec un diagramme ruban tridimensionnel (en jaune), montre l'intégration d'un inhibiteur (modèle éclaté) dans un emplacement en forme de "cavité" à la surface de l'enzyme. Cette "cavité" représente le site actif de la neuraminidase, jouant un rôle crucial dans le passage des virus à travers la membrane des les cellules hôtes.
Neuraminidase du virus de la grippe aviaire représentée avec un diagramme ruban tridimensionnel (en jaune), montre l'intégration d'un inhibiteur (modèle éclaté) dans un emplacement en forme de "cavité" à la surface de l'enzyme. Cette "cavité" représente le site actif de la neuraminidase, jouant un rôle crucial dans le passage des virus à travers la membrane des les cellules hôtes.
La cinétique enzymatique a pour objet d'identifier et de décrire les mécanismes des réactions biochimiques, catalysées par les enzymes (réaction enzymatique), en étudiant leur vitesse c'est-à-dire leur évolution en fonction du temps. En partant des enzymes isolées et en allant vers les systèmes métaboliques organisés et intégrés, la cinétique enzymatique permet de décrire quantitativement les propriétés catalytiques des enzymes et les mécanismes mis en place pour leur régulation.
Les enzymes jouent un rôle central dans la régulation des processus biologiques. Elles sont généralement constituées de molécules protéiques issues de la traduction du génome, à l'exception des ribozymes constitués d'ARN. Les enzymes interviennent en diminuant la barrière énergétique entre les réactants permettant d'accélérer les réactions des milliers de fois plus qu'en absence de catalyse.
L'activité catalytique des enzymes est hautement spécifique, c'est-à-dire qu'une enzyme donnée, parmi les milliers qui existent, ne peut catalyser qu'une réaction chimique bien précise (p. ex. l'hexokinase permet à l'aide d'une molécule d'ATP de phosphoryler le glucose pour obtenir le glucose-6-phosphate substrat clé dans la glycolyse et la synthèse du glycogène). En effet, la réaction chimique catalysée par une enzyme s'effectue au niveau d'une région bien déterminée de celle-ci, appelée site actif. Dans ce domaine, les acides aminés adoptent une configuration spatiale précise qui confère à cette région des caractéristiques chimiques spéciales rendant compte le cette spécificité vis-à-vis du substrat (voir figure ci-contre).
Il existe une relation entre la vitesse d'une réaction catalysée par une enzyme et la concentration ou la disponibilité du substrat. L'activité enzymatique dépend aussi du pH, de la température et souvent de la concentration des ions et des cofacteurs. La régulation de cette activité peut être assurée par des composés appelés effecteurs (généralement de faible poids moléculaire). Les effecteurs positifs (ou activateurs) stabilisent la configuration catalytique active de l'enzyme. Les effecteurs négatifs (ou inhibiteurs), agissent au contraire, en favorisant l'état moins actif (inhibiteurs non compétitifs) ou entrent en compétition avec les molécules de substrat en bloquant le site actif (inhibiteurs compétitifs).
La cinétique enzymatique constitue un élément fondamental dans la compréhension de la manière dont les enzymes fonctionnent et conduit à de nombreuses applications dans les industries chimique et agroalimentaire ainsi que dans les biotechnologies et la médecine (pharmacologie, toxicologie).
Sommaire
Mécanisme de la catalyse enzymatique
Une réaction chimique est un état d'équilibre entre les réactifs et les produits. Dans une réaction classique les réactifs se transforment en produits jusqu'à disparition totale ou non d'un réactif, c'est l'état d'équilibre. En enzymologie, les réactifs sont les substrats de l'enzyme et comme beaucoup enzymes ont une activité réversible, les produits peuvent devenir substrats. Pour qu'une réaction chimique se fasse, il faut délivrer une certaine énergie, l'énergie d'activation (comme si les réactifs devaient franchir un col pour se transformer). Une enzyme diminue l'énergie d'activation à fournir (en quelque sorte elle modifie le chemin pris par les réactifs) la réaction se retrouve donc accélérée mais l'état d'équilibre atteint n'est pas modifié, il ne dépend pas de l'enzyme. En théorie, comme tous les catalyseurs, une enzyme est retrouvée intacte en fin de réaction.
Comment l'enzyme diminue l'énergie d'activation ?
L'enzyme, lors de son interaction avec le substrat, modifie la réactivité moléculaire en formant un complexe enzyme-substrat, elle forme un état intermédiaire. Il existe en effet au sein de ces structures en 3D que sont les enzymes des sites de fixation où le substrat se fixe et des sites de réaction (ou catalyse) où la réaction est facilitée. Ces sites sont constitués de radicaux d'acides aminés formant la chaine protéique de l'enzyme. Ces acides aminés rapprochés grâce au repliement dans l'espace de la chaine protéique forment le site actif, il peut être activés par des ions magnésiums par exemple. Donc, l'enzyme facilite la réaction du substrat en diminuant l'énergie d'activation, ceci en passant par un ou plusieurs états intermédiaires.
Modèles de la cinétique enzymatique
Modèle de Michaëlis-Menten
On part de la réaction
On fait l'hypothèse d'un état quasi-stationnaire (AEQS pour Approximation de l'État Quasi-Stationnaire) sur l'espèce ES : ES étant instable, on suppose qu'elle disparait aussi vite qu'elle apparait.
Si v est la vitesse de la réaction,
![v=\frac {d[P]}{dt}= k_2 [ES]](/pictures/frwiki/54/61c27683ca5c45558a331cf84cea9d10.png)
![\frac {d[ES]}{dt}=0=k_1[E][S] - k_{-1} [ES] - k_2 [ES]](/pictures/frwiki/48/00e9f52d6c0736059680a4711745f0eb.png) (cf cours de chimie)
(cf cours de chimie)donc
![[ES]=\frac {k_1}{k_{-1}+k2}[E][S]](/pictures/frwiki/48/0d287b716b733455030bf76c1d3f090f.png) et en remplaçant [ES]
et en remplaçant [ES]![v=\frac{k_2k_1}{k_{-1}+k_2}[S][E]](/pictures/frwiki/100/dbbd140b7ef270470d9d582dfdfafd85.png)
Si on fait un bilan de matière sur E
[E] + [ES] = [E]0, où [E]0 est la quantité initiale d'enzyme
et en remplaçant E,
![v=\frac{k_2[E]_0}{1+\frac{k_{-1}+k_2}{k_1[S]}}](/pictures/frwiki/56/825b977101c1e9172b29aa7c4c52fa3d.png)
Si on défini vmax = k2[E]0 et
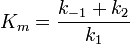
On a
![v = \frac {v_{max}[S]}{[S]+K_m}](/pictures/frwiki/57/91fed0c258a135acc4be413d3a804526.png)
Modèle de Briggs-Haldane
Cinétique à un substrat
Soit A le substrat, P et Q des produits, la réaction est la suivante :
A+E ⇆ (E-A) ⇆ (E-P-Q) ⇆ P+Q+E
Cinétique à plusieurs substrats
Il existe des enzyme avec deux substrats et deux produits appelées bi/bi Différents modèles existent suivant les enzymes, soient A et B les réactifs, P et Q les produits, E l'enzyme.
- cinétique bi/uni :
A+B+E ⇆ (E-A)+B ⇆ (E-A-B) ⇆ (E-P) ⇆ E+P si la fixation est ordonnée
ou
A+B+E ⇆ (E-A-B) ⇆ (E-P) ⇆ E+P si elle n'est pas ordonnée
ces enzymes sont le plus souvent des ligases comme l'ATP synthase, ADP+Pi ⇆ ATP (où Pi = phosphate inorganique)
- cinétique ordonnée :
A+B+E ⇆ (E-A)+B ⇆ (E-A-B) ⇆ (E-P-Q) ⇆ (E-Q)+P ⇆ P+Q+E
les formes entre parenthèse signifie qu'il s'agit de complexes enzyme-substrat(s) il n'y a qu'un ordre de réaction
- cinétique aéatoire :
A+B+E ⇆ (E-A-B) ⇆ P+Q+E
Il n'y a pas d'ordre de fixation, les complexes peuvent se dissocier avant la réaction et se reformer dans un ordre différent.
- cinétique de Théorel Chance :
A+B+E ⇆ (E-A)+B ⇆ (E-P)+B ⇆ E'+P+B ⇆ (E'-B)+P ⇆ (E-Q)+P ⇆ P+Q+E
E' est la même enzyme mais ayant changé de conformation.
- cinétique dite ping pong :
A+B+E ⇆ (E-A)+B ⇆ (E-P)+B ⇆ (E-B)+P ⇆ (E-Q)+P ⇆ P+Q+E
Le départ de P du site actif est déclenché par l'arrivée de B.
Contrôle de l'activité enzymatique
Conditions du milieu réactionnel
Certaines conditions modifient l'activité de l'enzyme :
- Le pH du milieu réactionnel.
- La force ionique du milieu réactionnel.
- La présence d'activateurs ou d'inhibiteurs.
- La concentration en substrat.
- La température de réaction. (D'après la loi d'Arrhenius et suivant la température de dénaturation de l'enzyme)
Inhibition et activation
Inhibition compétitive: Arrive lorsque deux composés (substrat) veulent se lier au même enzyme car ils ont une configuration spatiale partiellement identique et peuvent tous les deux accéder au site catalytique (on peut faire l'analogie avec deux clés semblable qui peuvent ouvrir la même serrure). Exemple: il y a compétition entre méthacholine et acétylcholine car elles ont toutes les deux un groupement choline qui active l'enzyme. Il en résulte: E+S1+S2→ES1+ES2→E+P1+P2 (les réactions sont réversibles) Il se peut aussi que le substrat compétitif se lie au site catalytique sans être modifié. Si l'enzyme est saturée par un substrat l'autre (d'affinité moindre=Kd plus élevé)ne sera pas catalysé d'où le terme compétitif. Il pourra par contre le déplacer par action de masse (i.e si sa concentration est beaucoup plus forte il le déplacera même si son Kd est plus élevé)
Inhibition non compétitive: Arrive lorsque un agent non relié au substrat est capable de lier l'enzyme au niveau de son site hallostérique. Cela laisse le site catalytique vacant, mais va souvent en modifier sa configuration spatiale cela peut empêcher la liaison enzyme substrat de se faire au niveau du site actif ou entrainer la liaison. Tout dépend de si le changement de configuration au niveau du site catalytique augmente l'affinité du substrat pour le dernier (active l'enzyme) ou la diminue.
Interactions coopératives et allostériques
1. C'est le cas des enzymes possédant des sous unités ou protomères (toujours par nombre pair). Ces enzymes ont une cinétique particulière. Leur fonctionnement n'est pas michaëlien et l'affinité pour le substrat augmente de manière non linéaire avec la concentration en substrat.
Cette cinétique particulière provient de transconformations spatiales, il existe une transition allostérique entre deux formes extrêmes :
- tendue, l'enzyme est la moins affine pour son substrat.
- relachée, l'enzyme est très affine pour son substrat.
L'allostérie est à l'origine de régulations. Dans le métabolisme cellulaire par exemple, lors de la glycolyse, la phosphofructokinase est régulée de manière allostérique par l'ATP lors de la synthèse de fructose-1,6-biphosphate.
Attention, il existe des enzymes possédant des sous unités n'étant pas allostériques : phosphatase alcaline, β-galactosidase.
2. Description de la cinétique, La courbe Vi=f([S]) soit Vitesse initiale en fonction de la concentration en substrat est d'allure sigmoïde, lors de faibles concentrations en substrat, l'affinité est faible, lors de fortes concentrations en substrat, l'affinité est maximale (on est à Vmax). L'affinité augmente le plus à 1/2 de Vmax où on peut noter une valeur particulière analogue au km le K50.
3. Équation de Hill,
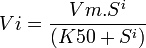
i étant un indice de coopérativité, plus il est grand, plus l'allure de la courbe est sigmoïde, si i=1, on retombe sur l'équation de michaelis, l'enzyme n'est pas allostérique.
rqi : i est différent du nombre de protomères.
4. Origine du phénomène, La fixation d'une première molécule de substrat sur l'enzyme lui permet d'acquérir une conformation moins tendue ce qui permet à une seconde molécule de substrat de se fixer et ainsi de suite jusqu'à ce que tous les sites de chaque protomère soit saturé.
Références
- Portail de la chimie
- Portail de la biochimie
Catégories : Enzymologie | Catalyse
Wikimedia Foundation. 2010.

![\mathrm{E + S \overset{k_1}\underset{k_{-1}}\rightleftharpoons ES \xrightarrow[]{k_2} E + P }](/pictures/frwiki/54/6f3c059ce514e15adc7f86299478a96a.png)
