- 75-28-5
-
Isobutane
2-méthylpropane 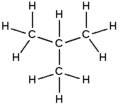
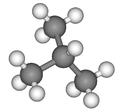
Formule développée et représentation 3D de l'isobutane Général Nom IUPAC 2-méthylpropane Synonymes iso-butane
i-butane
triméthylméthane
1,1-diméthyléthane
réfrigérant R600aNo CAS No EINECS PubChem SMILES InChI Apparence gaz comprimé liquéfié incolore, d'odeur caractéristique[1]. Propriétés chimiques Formule brute C4H10 [Isomères] Masse molaire 58,1222 g∙mol-1
C 82,66 %, H 17,34 %,Propriétés physiques T° fusion -159,42 °C[2] T° ébullition -11,7 °C[2] Solubilité 49 mg⋅l-1 (eau,20 °C)[2] Masse volumique 2,506 kg⋅m-3 (15 °C,1 bar)[2] T° d’auto-inflammation 460 °C[2] Point d’éclair -83 °C[2] Limites d’explosivité dans l’air 1,5 - 8,3 Vol.%
37 - 231 g/m3[2]Pression de vapeur saturante 3,019 bar à 20 °C
4,1 bar à 30 °C
6,78 bar à 50 °C[2]Thermochimie S0liquide, 1 bar 200,79 J∙mol-1∙K-1[3] ΔfH0gaz -134,2 kJ∙mol-1[3] ΔfusH° 4,54 kJ∙mol-1 à -159,4 °C[3] ΔvapH° 19,99 kJ∙mol-1 à 25 °C
21,297 kJ∙mol-1 à -11,7 °C[3]Cp 96,65 J∙mol-1∙K-1 (25 °C, gaz)
129,7 J∙mol-1∙K-1 (-13,1 °C, liquide)[3]PCI -2 869 kJ∙mol-1[3] Propriétés optiques Indice de réfraction 1,352 Précautions Directive 67/548/EEC 
F+Phrases R : 12, Phrases S : 2, 9, 16, [4] Transport 23 1969 NFPA 704 SIMDUT[5] 

SGH[6],[7] 

Danger
Avec >0,1% de butadiène :



DangerÉcotoxicologie LogP 2.8[1] Composés apparentés Autres composés butane Unités du SI & CNTP, sauf indication contraire. L'isobutane ou 2-méthylpropane est un hydrocarbure de formule brute C4H10 que l'on trouve sous forme de gaz dans les conditions habituelles de température et de pression. C'est un isomère du butane.
Sommaire
Utilisation
L'isobutane est un réactif de base pour la production du peroxyde de di-tert-butyle (un composant important des carburants où il joue le rôle d'anti-détonnant), de l'isobutène (par déshydrogénation catalytique) et de l'acide méthacrylique (par oxydation[8]).
C'est aussi un fluide frigorigène et un aérosol utilisé en substitution aux CFC pour limiter les impacts sur la couche d'ozone et l'effet de serre notamment à cause de son faible impact sur l'environnement :
- ODP ou potentiel de déplétion ozonique : 0 (R600a)
- GWP ou PRG (potentiel de réchauffement global) : 3 (R600a)
Il est la source du radical tert-butyl (CH3)3C- qui est d'une grande importance en synthèse organique pour son rôle de groupe protecteur grâce à son encombrement stérique.
Production et synthèse
L'isobutane est obtenu via 2 procédés[8] :
- par distillation de la fraction du pétrole appelée gaz de pétrole liquéfié.
- par isomérisation catalytique acide du butane.
Danger, risques
Son caractère inflammable nécessite une gestion particulière des risques, et des méthodes d'intervention appropriées : pas de flamme, pas de chalumeau, interdiction de fumer dans un atelier d'intervention, qui doit être ventilé et équipé de dispositifs d'extraction basse.
Pour toute intervention sur une unité hermétique, on emploiera la technique Lokring.
Notes et références
- ↑ a et b ISOBUTANE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- ↑ a , b , c , d , e , f , g et h Entrée de « Isobutane » dans la base de données de produits chimiques GESTIS de la BGIA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 17 avril 2009 (JavaScript nécessaire)
- ↑ a , b , c , d , e et f Isobutane sur http://www.nist.gov/. Consulté le 17 avril 2009
- ↑ « isobutane » sur ESIS, consulté le 15 février 2009
- ↑ « Isobutane » dans la base de données de produits chimiques Reptox de la CSST (organisme canadien responsable de la sécurité et de la santé au travail), consulté le 23 avril 2009
- ↑ Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- ↑ Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- ↑ a et b Karl Griesbaum, Arno Behr, Dieter Biedenkapp, Heinz-Werner Voges, Dorothea Garbe, Christian Paetz, Gerd Collin, Dieter Mayer, Hartmut Höke, Ullmann's Encyclopedia of Industrial Chemistry, Hydrocarbons, Wiley-VCH Verlag GmbH & Co, 2000
Voir aussi
- Portail de la chimie
Catégories : Produit chimique extrêmement inflammable | Alcane ramifié | Réfrigérant
Wikimedia Foundation. 2010.


