- Électrolyse de l'eau
-
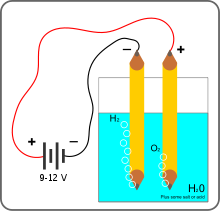
 Schéma du voltamètre d'Hoffmann utilisé pour l'électrolyse de l'eau.
Schéma du voltamètre d'Hoffmann utilisé pour l'électrolyse de l'eau.
L’électrolyse de l'eau est un procédé électrolytique qui décompose l'eau en dioxygène et dihydrogène gazeux avec l'aide d'un courant électrique, pour lequel, dans l'enseignement, une source de tension de 6 volts est couramment utilisée. La cellule électrolytique est constituée de deux électrodes - habituellement en métal inerte (dans la zone de potentiel et de pH considérée) comme le platine- immergées dans un électrolyte (ici l'eau elle-même) et connectées aux pôles opposés de la source de courant continu.
Sommaire
Historique
La première électrolyse de l'eau a été réalisée le 2 mai 1800 par deux chimistes britanniques, William Nicholson (1753 - 1815) et Sir Anthony Carlisle (1768-1840), quelques jours après l'invention de la première pile électrique (publication soumise le 20 mars 1800 dans une lettre en français au président de la Royal Society, Joseph Banks) par Alessandro Volta.
Principe et description du processus
Le courant électrique dissocie la molécule d'eau (soit H2O) en ions hydroxyde (OH)- et hydrogène H+ : dans la cellule électrolytique, les ions hydrogène acceptent des électrons à la cathode dans une réaction d'oxydation en formant du dihydrogène gazeux (soit H2), selon la réaction de réduction:
 ,
,
alors qu'une oxydation des ions hydroxyde - qui perdent des électrons donc - se produit à l'anode afin de "fermer" le circuit électrique (équilibre de la réaction chimique en charges) :
 ,
,
ce qui donne l'équation de décomposition par électrolyse suivante :
La quantité de dihydrogène gazeux produite est donc deux fois celle de dioxygène. Selon la loi d’Avogadro, le volume récupéré d'hydrogène produit est aussi deux fois plus important que celui de l'oxygène.
Spontanéité du processus
 Voltamètre d'Hofmann sur courant continu.
Voltamètre d'Hofmann sur courant continu.
La décomposition de l'eau en dihydrogène et dioxygène dans les conditions normales de température et de pression n'est pas favorisée thermodynamiquement, les potentiels standard des deux demi-réactions étant négatifs.
d'autre part, l'énergie libre de Gibbs pour le processus dans des conditions standard est à valeur largement positive (environ 474,4 kJ). Ces considérations rendent la réaction « impossible » à effectuer sans ajouter des électrolytes en solution.
Choix de l'électrolyte
Article détaillé : Électrolyte.L'eau pure conduit peu l'électricité, ce qui conduit à l'emploi d'un additif hydrosoluble - électrolyte - dans la cellule d'électrolyse pour « fermer » le circuit électrique (autrement dit, faire en sorte que les potentiels chimiques en jeu permettent la réaction chimique). L'électrolyte se dissout et se dissocie en cations et anions (c'est-à-dire respectivement des ions chargés positivement et négativement) qui peuvent « porter » le courant. Ces électrolytes sont habituellement des acides, des bases ou des sels.
Une attention particulière doit être portée au choix de l'électrolyte : en effet, l'anion apporté est en compétition directe avec les ions hydroxydes pour la perte d'électron. Un électrolyte anionique avec un potentiel standard d'électrode inférieur à celui de l'hydroxyde sera oxydé à sa place, ne produisant donc pas de dioxygène. De manière similaire, un cation avec un potentiel standard d'électrode supérieur à celui de l'ion hydrogène sera réduit à sa place, et donc il n'y aura pas de production de dihydrogène.
Les cations suivants ont des potentiels d'électrode inférieurs à celui de H+, et sont par conséquent acceptables pour un usage en tant que cations d'électrolyte : Li+, Rb+, K+, Cs+, Ba2+, Sr2+, Ca2+, Na+, et Mg2+, soit des alcalins ou alcalino-terreux. Le sodium et le lithium, qui forment des sels solubles et peu chers, sont les plus fréquemment utilisés.
Si un acide est utilisé comme électrolyte, le cation libéré est H+ et il n'existe alors pas de compétition avec H+ libéré par la dissociation de l'eau. Dans ce cas de figure, l'anion le plus communément utilisé est SO42- (l'acide ajouté est l'acide sulfurique H2SO4), très difficile à oxyder. Le potentiel standard d'oxydation de cet ion en ion peroxydisulfate est de 2,05 V. À l'anode :
D'autres acides forts sont fréquemment utilisés comme électrolytes.
Techniques
Cette expérience est simple à répéter. Deux électrodes reliées aux pôles d'une pile et plongées dans un verre d'eau additionnée d'un peu d'électrolyte est suffisant pour produire un « courant » visible de bulles de dihydrogène ou de dioxygène à chaque électrode. La présence d'ions hydroxyde (OH-) peut être détectée par un indicateur de pH comme la phénolphtaléine ou le bleu de bromothymol.
Voltamètre d'Hoffmann
Article détaillé : Voltamètre d'Hoffmann.Le voltamètre d'Hoffmann est parfois utilisé comme cellule électrolytique de taille réduite. Il consiste en trois tubes joints par la base. Le cylindre médian est ouvert en haut pour permettre l'addition d'eau et d'électrolyte. Une électrode de platine est placée à l'intérieur de chacun des tubes latéraux, plus précisément à leur base, et connectée à un des deux pôles d'une source d'électricité. Lorsque le courant passe au travers du voltamètre d'Hofmann, du dioxygène gazeux se forme à l'anode et du dihydrogène à la cathode. Chaque gaz déplace l'eau et peut être collecté à l'extrémité des deux tubes latéraux.
Électrolyse industrielle
De nombreuses cellules électrolytiques industrielles sont tout à fait similaires au voltamètre d'Hofmann, avec des disques ou des volumes en « ruches d'abeilles » de platine comme électrodes. L'hydrogène est habituellement « créé », collecté et brûlé sur place, son énergie volumique étant trop faible pour être stocké ou transporté de manière économiquement rentable. L'oxygène gazeux est traité comme un sous-produit.
Électrolyse à haute température
Article détaillé : Électrolyse à haute température.L'électrolyse à haute température (connue aussi sous le sigle HTE - high-temperature electrolysis, ou électrolyse en phase vapeur) est une méthode qui est actuellement étudiée pour l'électrolyse de l'eau par machine thermique. L'électrolyse à haute température est plus efficace que le procédé à température ambiante puisqu'une partie de l'énergie nécessaire à la réaction est apportée via la chaleur, moins chère à obtenir que l'électricité, et que les réactions d'électrolyse ont un meilleur rendement à haute température.
Applications
Environ quatre pour cent du dihydrogène gazeux produit dans le monde est produit par électrolyse, et habituellement utilisé sur place. Le dihydrogène est utilisé pour la synthèse d'ammoniac comme engrais par le procédé Haber-Bosch, et pour la conversion du pétrole lourd en fractions plus légères par hydrocraquage.
Efficacité et rendement
Le rendement énergétique de l'électrolyse de l'eau peut varier de manière importante. La gamme de rendement varie entre 50-70 % [1], quand d'autres indiquent 80-94% [2]. Ces valeurs se réfèrent seulement au rendement de la conversion de l'énergie électrique en énergie chimique de l'hydrogène. L'énergie perdue lors de la génération de l'électricité n'est pas comptabilisée. Ainsi, lorsque l'on considère une centrale nucléaire convertissant la chaleur des réactions nucléaires en hydrogène par électrolyse, le rendement total est de l'ordre de 25-40 % [3].
Un blocage cinétique impose une grande tension électrique pour obtenir une intensité décente, et donc un rendement significatif.
Articles connexes
Références
- Électrolyse de l'eau, Experiments on Electrochemistry. Consulté le 20 novembre 2005
- Électrolyse de l'eau, Do Chem 044. Consulté le 20 novembre 2005
Wikimedia Foundation. 2010.