- Thaumatine
-
Thaumatine Caractéristiques générales Localisation Forêt tropicale africaine
La thaumatine, ou plutôt les thaumatines, désigne une famille de protéines au goût sucré présente dans le fruit du Katemfe, un arbre originaire de la forêt tropicale africaine[1]. Elle est utilisée mondialement dans l’alimentation humaine et la pharmacologie comme édulcorant, exhausteur de goût ou masqueur d’amertume. C’est l'édulcorant naturel ayant le pouvoir sucrant le plus élevé : il est estimé entre 2 000 et 3 000 fois plus sucré que le saccharose (sucre de table) à poids égal[2].Sommaire
Source
La thaumatine fait référence au mélange de deux protéines extraites des graines du fruit du Thaumatococcus danielli (Benth)[3], connu sous le nom de Katemfe[1]. Le Katemfe est originaire de la forêt tropicale africaine et pousse sur une grande étendue englobant plusieurs pays comme le Ghana, la Côte d’Ivoire, le Togo, la Sierra Leone ou encore le Nigeria[4]. Les thaumatines sont contenues dans l’arille des graines du fruit mûr.
Des protéines de structure similaire à la thaumatine ont été retrouvées dans plusieurs espèces diverses, telles que le riz (Oryza sativa)[5] et le Caenorhabditis elegans[6] (un métazoaire).
Rôle biologique
La production de thaumatine semble être une réponse biologique aux attaques par un pathogène viroïde car plusieurs homologues de la thaumatine ont montré des inhibitions significatives in vitro de plusieurs champignons.
Histoire
Le premier témoignage d’utilisation du fruit du Katemfe provient d’un chirurgien de l’armée britannique, W.F. Danielli, en poste dans l’Afrique de l’Ouest au cours de la décennie 1840[7]. Il rapporta que les indigènes utilisaient le fruit pour améliorer la qualité gustative des fruits acides et d’un vin de palme. Le nom latin de l’arbre fut par la suite donné par le naturologue George Bentham d'après le nom du chirurgien : Thaumatococcus danielli[8].
Les indigènes du Ghana, de la Côte d’Ivoire, du Togo, de la Sierra Leone et du Nigeria, cultivent le fruit et utilisent ses graines depuis des décennies pour sucrer les aliments et les boissons[4].
Dans les années 1970, l’entreprise Talin Food commença l’extraction de la partie sucrée du fruit et la commercialisa sous le nom de Talin® comme édulcorant intense. Les fruits utilisés proviennent des arbres de la Côte d’Ivoire[4].
En 1972, les chercheurs d’Unilever isolent et identifient les deux protéines responsables du goût sucré qu’ils nommèrent thaumatine I et thaumatine II[1].
Par la suite, en 1984, quatre autres protéines naturelles homologues de la thaumatine ont été mises en évidence et nommées thaumatines III, a, b et c[9]. Cependant, le nom générique thaumatine réfère à la mixture des homologues I et II, qui sont les composés les plus abondants dans la graine.
En 1985, le Comité mixte FAO/OMS d'experts des additifs alimentaires (JECFA) a établi l’innocuité de la thaumatine[10].
De nos jours, l’entreprise Naturex ayant racheté Overseal, c'est elle qui commercialise le Talin®, toujours à partir d'extraits du fruit[8].
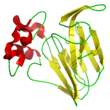
Structure
Les thaumatines I et II, prédominantes dans les graines, possèdent un poids moléculaire de 22 kDa[3], soit 2 fois plus gros que les protéines sucrantes mabinlines (12 kDa[11]). La thaumatine comme composé chimique possède le numéro CAS [3].
Primaire
Les thaumatines I et II, constituées d’une chaîne de 207 acides aminés, sont très similaires et ne diffèrent que sur 5 acides aminés : en position 46 (N au lieu de K), 63 (S au lieu de R), 67 (K au lieu de R), 76 (R au lieu de Q) et 113 (N au lieu de D).
Tableau 1 : Nature et quantité des acides aminés de la thaumatine I[12] Acide aminé Quantité Acide Aspartique 22 Thréonine 20 Sérine 14 Acide Glutamique 10 Proline 12 Glycine 24 Alanine 16 Cystéine 16 Valine 10 Méthionine 1 Isoleucine 8 Leucine 9 Tyrosine 8 Phénylalanine 1 Lysine 11 Arginine 12 Tryptophane 3 Total 207 Tableau 2 : Séquences des acides aminés des protéines sucrantes Thaumatine I (TI) et thaumatine II (TII)[1]. UniProtKB/Swiss-Prot TI 1 ATFEIVNRCS YTVWAAASKG DAALDAGGRQ LNSGESWTIN VEPGTNGGKI
TII 1 ATFEIVNRCS YTVWAAASKG DAALDAGGRQ LNSGESWTIN VEPGTKGGKITI 51 WARTDCYFDD SGSGICKTGD CGGLLRCKRF GRPPTTLAEF SLNQYGKDYI
TII 51 WARTDCYFDD SGRGICRTGD CGGLLQCKRF GRPPTTLAEF SLNQYGKDYITI 101 DISNIKGFNV PMNFSPTTRG CRGVRCAADI VGQCPAKLKA PGGGCNDACT
TII 101 DISNIKGFNV PMDFSPTTRG CRGVRCAADI VGQCPAKLKA PGGGCNDACTTI 151 VFQTSEYCCT TGKCGPTEYS RFFKRLCPDA FSYVLDKPTT VTCPGSSNYR
TII 151 VFQTSEYCCT TGKCGPTEYS RFFKRLCPDA FSYVLDKPTT VTCPGSSNYRTI 201 VTFCPTA TII 201 VTFCPTA
Séquences des acides aminés des protéines sucrantes Thaumatine I (TI) et thaumatine II (TII)[1]. Secondaire
Les thaumatines I et II possèdent 4 hélices alpha et 11 brins bêta.
La chaîne peptidique contient 8 ponts disulfures internes, responsables de sa remarquable stabilité à la chaleur[13].
Tableau 3 : Localisation des ponts disulfures. Pont numéro Position de départ Position d’arrivée 1 9 204 2 56 66 3 71 77 4 121 193 5 126 177 6 134 145 7 149 158 8 159 164 Tertiaire
La structure tertiaire de la thaumatine se compose de trois domaines distincts :[14]
- 11 brins bêta dans le feuillet bêta (1-53, 85-127 et 178-207, domaine I)
- une région plus importante riche en ponts disufures (128-177, domaine II).
- une région riche en ponts disufures (54-84, domaine III).
Propriétés
Goût sucré
La thaumatine possède un goût très sucré, propriété inhabituelle chez les protéines, mais connue. En effet, d’autres protéines (voir tableau ci-dessous) ayant une capacité sucrante ont été identifiées ; la thaumatine est cependant la plus sucrée.
Tableau 4 : Protéine sucrante et pouvoir sucrant[15] Protéine Thaumatine Monelline Mabinline Pentadine Brazzéine Curculine Miraculine Pouvoir sucrant a 1 600-3 000 3 000 100-400 500 500-2 000 550 0 b a : Pouvoir sucrant comparé au sucre (sucre = 1) à poids égal.
b: Pas sucré dans l'eau, seulement en présence d'acide.
Son pouvoir sucrant est estimé entre 1 600 et 3 000 plus intense que le saccharose (sucre de table) à poids égal[1],[11].
Tableau 5 : Pouvoir sucrant équivalant de la thaumatine. Concentration
de sucrePouvoir sucrant
à poids égal.0,6% 5 500[16] 5% 3 500[17] 6% 3 000[2] 7% 1 600[1] 7% 3 000[11] 8% 2 500[18] 10% 2 000[2],[18] 15% 1 800[17] Si, par convention, il est reconnu que la thaumatine est 3 000 fois plus sucrée que le sucre[19], il faut cependant garder en mémoire que cette valeur évolue en fonction du pourcentage. Comme montré dans le tableau ci-dessous, plus la concentration de sucre (poids/volume) est élevée, plus le pouvoir sucrant de la thaumatine diminue.
La perception du sucré augmente linéairement avec l’augmentation de la concentration[20]. La perception du sucré est plus tardive et perdure plus longtemps que celle du sucre. Elle est similaire au profil de la monelline[21], cependant le goût sucré persistant en bouche pourrait être considéré comme inacceptable par les consommateurs[20].
Mélangé avec d’autres édulcorants tels que la saccharine, l’acésulfame potassium, les stéviosides, ou bien xylitol, la thaumatine démontre des propriétés de synergie et une réduction de son goût persistant[17].
Utilisé à de faible concentration (de 0,5 à 4 ppm), la thaumatine est un parfait exhausteur de goût et masqueur d’amertume.
Propriété physique
Le point isoélectrique des thaumatines est de 12[1].
La thaumatine est très stable à la chaleur en milieu acide, mais elle ne l’est pas en milieu alcalin. En effet, après 4h passées à 80 °C et pH 2, ou bien à pH 4 pendant 2 h, la protéine est toujours sucrée. Par contre, après 15 minutes à pH 7 toujours à 80 °C, la protéine a perdu son goût sucré[13].
Sa remarquable stabilité à la chaleur et à la pression, due à la présence de 8 ponts disulfures, permet son utilisation dans une variété de procédés alimentaires (UHT, pasteurisation, cuisson et extrusion)[8].
La protéine est très soluble dans une large variété de liquides et solvants. Elle est très soluble dans l’eau, jusqu’à 20 % (pourcentage massique) à pH 3[8]. Elle est soluble jusqu’à 5%m dans l’éthanol à 60 % et le propylène glycol[22]. La dissolution dans de l’éthanol plus concentré (jusqu’à 90%) est aussi possible quand la protéine est pré-hydratée. La protéine est aussi soluble dans le glycérol et les sucres alcools[8].Elle est cependant insoluble dans l'acétone[3].
En tant que protéine, la thaumatine est considérée comme non cariogène. Elle est métabolisée et ingérée aussi vite que l'albumine de l'œuf, une fois ingérée par le corps sous forme d’acides aminés[7].
Elle produit 4 kcal/g comme n’importe quelle autre protéine ; cependant l’apport calorifique est négligeable au vu de son niveau d’utilisation très faible (0,5 à 10 ppm) dans l’alimentation[2].Usage alimentaire
La matière issue du végétal comporte quelques problèmes concernant la qualité et surtout la quantité : les aléas climatiques ne permettent pas une production stable et ne répondent pas toujours à la demande.
Le Comité mixte FAO/OMS d'experts des additifs alimentaires (JECFA), qui a évalué toxicité de la thaumatine, a établi en 1985 son innocuité, lui attribuant une dose journalière admissible (DJA) (Acceptable Daily Intake (ADI) (en)) non spécifiée (not specified (en)[3]). Cela signifie que cette substance peut être utilisée selon le concept des bonnes pratiques de fabrication (BPF) (Good Manufacturing Practice (GMP) en anglais).La thaumatine fait partie de la Liste III du Codex General Standard for Food Additives (GSFA), autorisant son utilisation dans tous les aliments, sauf exception, en accord avec les BPF[23].
USA
La Flavor and Extract Manufacturers Association (FEMA) a attribué le statut GRAS (Generally recognized as safe) à la thaumatine (numéro 3732) pour son utilisation dans plus de 30 catégories d’aliments (par exemple dans les boissons alcoolisées, son utilisation est limitée à 25 ppm). Dans ces applications, la thaumatine apparaît sur la liste des ingrédients comme « Arôme naturel ».
Europe
La thaumatine est autorisée comme additif alimentaire dans l'Union européenne (numéro E957) [24]. Principalement comme exhausteur de goût dans les chewing-gums avec sucres ajoutés (au maximum 10 mg/kg) et dans les desserts laitiers et non laitiers (au maximum 5 mg/kg) (arôme naturel). Et comme édulcorant dans les boissons aromatisées sans alcool à base d’eau (au maximum 0,5 mg/l).
Le reste du monde
L'utilisation de la thaumatine est autorisée dans l'alimentation comme édulcorant en Israël, au Canada, en Australie et en Afrique du sud. Le ministère de la santé au Japon autorise l'utilisation de la thaumatine comme un additif alimentaire sans danger et son dosage n'est pas limité[25].
Production
À travers le monde, il existe plusieurs producteurs de thaumatines, les plus connus étant Overseal en Europe commercialisant Talin® (mélange de thaumatines I & II)[8] et le producteur Japonais San-Ei Gen FFI commercialisant Sunsweet T® (mélange de thaumatines I & II)[13].
Extraction
L'extrait de thaumatine est purifié par ultrafiltration sélective ; cependant un résidu organique non protéique reste dans le produit commercialisé. Le résidu se constitue principalement d'arabino-galactans et d'arabinoglucuronoxylan polyosides, ces deux éléments sont des constituants présents dans les gommes et mucilages de plantes[7].
Purification
La thaumatine I peut être purifiée à partir d'un extrait de pulpe de fruit par une chromatographie à échange d'ion suivie par une filtration par chromatographie sur gel[26].
Annexes
Notes et références
- (en) H Van der Wel, K Loeve, « Isolation and characterization of thaumatin I and II, the sweet proteins from Thaumatococcus daniellii Benth. », dans European Journal of Biochemistry, vol. 31, 1972, p. 221-225. PMID 4647176
- (en) JD Higginbotham, « Sensory properties and potential applications of thaumatin, an intensely sweet protein. », dans Journal of the Science of Food and Agriculture, vol. 32, no 8, 1981, p. 843-848 [lien DOI]
- (en) JECFA, « Thaumatin », JECFA monograph sur http://www.fao.org, FAO, 2006, p. 1-3. Consulté le 16/07/2008.
- (en) M Witty, JD Higginbotham (Editors) (1994). Thaumatin. CRC Press 1994. ISBN 0-8493-5196-0
- (en) K Hiroyuki & R Terauchi, « Regulation of expression of rice thaumatin-like protein: inducibility by elicitor requires promoter W-box elements. », dans Plant Cell Rep., 2008 [résumé, lien DOI (pages consultées le 16/07/2008.)]
- (en) Shatters RG Jr, Boykin LM, Lapointe SL, Hunter WB & Weathersbee AA 3rd., « Phylogenetic and structural relationships of the PR5 gene family reveal an ancient multigene family conserved in plants and select animal taxa. », dans J Mol Evol., no 63, 2006, p. 12-29 [résumé, lien DOI (pages consultées le 16/07/2008)]
- (en) Anonymous (1985) Thaumatin WHO Food Additives Series 20, 1985
- (en) Anonyme, « Talin® Thaumatin naturally », www.overseal.com. Consulté le 22-01-2008
- (en) AM Ledeboer, CT Verrips et BM Dekker (1984). Cloning of the natural gene for the sweet-tasting plant protein thaumatin. Gene, 30, 23-32. PMID 6510718
- (en) Anonymous (1985) Summary of Evaluations Performed by the Joint FAO/WHO Expert Committee on Food Additives for Thaumatin. Re-Issued 12/11/2001.
- (en) Y Kurihara (1992) Characteristics of anti-sweet substances, sweet proteins and sweetness inducing proteins. Critical Reviews in Food Science and Nutrition, 32, 231-252. PMID 1418601
- (en) RB Iyengar, P Smits, F Van der Ouderaa, H Van der Wel, J Van Brouwershaven, P Ravestein, G Richters et PD Van Wassenaar (1979) The complete amino-acid sequence of the sweet protein thaumatin I. Eur. J. Biochem., 96, 193-204. PMID 456365. DOI:10.1111/j.1432-1033.1979.tb13029.x
- (en) R Kaneko, N Kitabatake (2001) Sweetness of sweet protein thaumatin is more thermoresistant under acid conditions than under neutral or alkaline conditions. Bioscience Biotechnology & Biochemistry, 65, 409-413. PMID 11302177
- (en) AM De Vos, M Hatada M, H Van der Wel, H Krabbendam, AF Peerdeman et SH Kim (1985) Three-dimensional structure of thaumatin I, an intensely sweet protein. Proc. Natl Acad. Sci. USA, 82, 1406-1409.
- (en) I Faus, H Sisniega (2004) Sweet-tasting Proteins. Biopolymers. Volume 8. Polyamides and Complex Proteinaceous Materials II.p203-209.. Eds. Wiley-VCH. ISBN 3-527-30223-9
- (en) RS Shallenberger (1993) Taste Chemistry, Blackie Academic & professional: Glasgow. ISBN 978-0-7514-0150-9
- (en) MLE Burge, Z Nechutny (1978) Sweetening compositions containing protein sweeteners. Tate & Lyle Ltd. Patent 702199
- (en) Dziezack, J.D. Special report: Sweeteners and product development. Food Technology 1986, 40, 111-130.
- Anonyme (2007) La thaumatine : E957 Isabru www.isabru.org.
- (en) SS Schiffmann and CA Gatlin (1993) Sweeteners: State of Knowledge Review. Neuroscience and Behavioral Reviews, 17, 313-345. PMID 8272285
- (en) JF Pfeiffer, RB Boulton and AC Noble (2000) Modelling the sweetness response using time-intensity data. Food Quality & Preference, 11, 129-134. DOI:10.1016/S0950-3293(99)00036-1
- (en) Anonymous (1996) Thaumatin - The sweetest substance known to man has a wide range of food application. Food Technology 1996, 50, 74-75.
- (en) Codex Alimentarius Commission, « Food Additive Details - Thaumatin (957) », GSFA Online sur http://www.codexalimentarius.net, Codex Alimentarius, 2007. Consulté le 16/07/2008.
- Parlement européen et Conseil de l'Europe, « DIRECTIVE 95/2/CE concernant les additifs alimentaires autres que les colorants et les édulcorants », dans Journal Officiel, no L 61, 20 février 1995, p. 1-56 [texte intégral (page consultée le 15/04/2008)]
- (en) Japan External Trade Organization, « Specifications and Standards for Foods, Food Additives, etc. Under The Food Sanitation Law (Abstract 2006) » sur http://www.jetro.go.jp, JECTRO, Mars 2007, p. 1-153. Consulté le 24/09/2008.
- (en) R Kaneko et N Kitabatake (1999) Heat-induced formation of intermolecular disulfide linkages between thaumatin molecules that do not contain cysteine residues. J. Agric. Food Chem., 47, 4950-4955. PMID 10606557
Articles connexes
Autres édulcorants naturels :
Liens et documents externes
- (en) THAUMATIN Compendium of Food Additive Specifications (Addendum 7) - Joint FAO/WHO Expert Committee on Food Additives 53rd session
- Portail de la biochimie
- Portail de la biologie cellulaire et moléculaire
- Portail de l’alimentation et de la gastronomie
- Portail de la chimie
Wikimedia Foundation. 2010.