- Stilbene
-
Stilbène
Stilbène 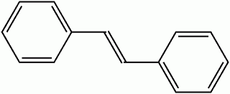
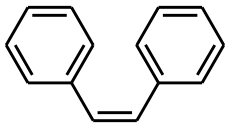
Représentation topologique du (E)et du (Z)-stilbèneGénéral Nom IUPAC trans-1,2-diphényléthylène Synonymes - E-Stilbène
- Z-Stilbène
No CAS (E)
(Z)Apparence solide blanc cassé Propriétés chimiques Formule brute C14H12 [Isomères] Masse molaire 180,2451 g∙mol-1
C 93,29 %, H 6,71 %,Propriétés physiques T° fusion 122 à 125 °C T° ébullition 305 à 307 °C Solubilité Insoluble. Précautions Directive 67/548/EEC Phrases R : 22, 37, 38, 62, Phrases S : 22, 26, 36, 37, 45, NFPA 704 Inhalation irritant Peau irritant Ingestion nocif Unités du SI & CNTP, sauf indication contraire. Le stilbène, dont il existe deux formes (trans-1,2-diphényléthylène (E-Stilbène) et cis-1,2-diphénylethylène (Z-stilbène)), est un hydrocarbure aromatique, de formule C14H12.
Le même terme de stilbène désigne aussi la classe des dérivés hydroxy-, méthoxy- du stilbène simple, ainsi que leurs formes hétérosidiques ou polymériques.
Ce sont des polyphénols naturels présents dans de nombreuses familles de plantes supérieures (comme le trans-resvératrol du raisin).
Rassemblés avec les bibenzyls et les phénanthrènes, ils forment la famille des stilbénoïdes.Le stilbène est une des substances illicitement utilisées par certains éleveurs sous forme libre ou dérivée (sels ou esters).
Cette substance est interdite en France, y compris dans les territoires d'outre-mer[1].Son nom vient du Grec stilbos qui signifie brillant, lié à ses propriétés de fluorescence.
Sommaire
Description
Le stilbène est un liquide huileux, jaune, qui existe sous deux formes diastéréoisomères (E) et (Z), cette dernière étant la moins stable pour cause de gênes stériques et présentant un point de fusion entre 5 °C et 6 °C, tandis que la forme (E) a un point de fusion avoisinant les 125 °C.
Le cis-stilbène peut être transformé par photolyse dans son isomère, le trans-stilbène, doté d'une fluorescence bleue.
Toxicologie, écotoxicologie
C'est un perturbateur endocrinien.
Recommandation
- Ne pas manger et ne pas boire pendant l'utilisation
- Conserver dans un récipient hermétique
Les stilbènes
Cette famille de polyphénols naturels est constituée de dérivés hydroxy-, méthoxy- du stilbène simple, ainsi que leurs formes hétérosidiques ou polymériques. On les trouve chez de nombreuses plantes supérieures.
En réponse à des attaques de pathogènes extérieurs (insectes, micro-organismes), les plantes se protègent en produisant des composés toxiques contribuant au blocage local des attaquants. Certaines de ces substances, comme des alcaloïdes (nicotine), des terpénoïdes (pyréthrines) ou des isoflavones (roténoïdes) ont été très étudiées. D’autres comme les stilbènes sont beaucoup moins connues.
Les stilbènes permettraient pourtant de mieux comprendre pourquoi par exemple divers cépages de vignes sont plus ou moins résistants aux attaques fongiques. Pezet et als. (2004)[2] ont montré que les feuilles de vignes inoculées par le mildiou (Plasmopara viticola) vont au bout de quelques heures produire localement des stilbènes. Elles synthétisent tout d’abord du resvératrol en grande quantité mais suivant les variétés le destin de ce composé va varier. Pour les cultivars sensibles au mildiou, le resvératrol est glycosylé en un composé non toxique, le picéide, alors que pour les cultivars résistants au mildiou, le resvératrol est oxydé en un composé toxique, la viniférine. Le resvératrol s’est révélé être une molécule bénéfique, non seulement pour la plante mais aussi pour l’homme. Ces nombreuses propriétés thérapeutiques ont suscité et suscitent toujours un grands nombre d’études[3].
Des observations semblables ont été faites sur les conifères. Un pin subissant une attaque fongique va se défendre en produisant des stilbènes comme le pinosylvine[4] , un épicea produira plusieurs dimères de glucosides de stilbènes[5].
LES STILBENES
Gluc=O-β-D-glucosylNom Origine R3 R4 R5 R’3 R’4 R’5 Squelette
carbonéPinosylvine Pinus strobus H H H OH H OH 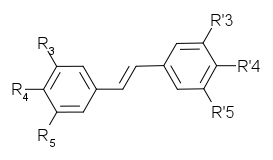
Piceatannol Picea abies OH H OH OH OH H trans-resvératrol Raisin, cacahuète,
Polygonum, PiceaOH H OH H OH H trans-ptérostilbène Ptérocarpus, raisin OCH3 H OCH3 H OH H Rhapontine, Ponticine Rhubarbe, Picea abies Gluc H OH OH OCH3 H trans-picéide Raisin, rhubarbe,
Picea, PolygonumGluc H OH H OH H Astringine Picea abies Gluc H OH OH OH H Les viniférines sont des oligomères du resvératrol.
Utilisations
- Les stilbènes sont utilisés dans l'industrie des colorants. Ils fournissent des groupes chromophores jaunes ou orangés[6].
- Les stilbènes servent de milieu d'émission pour les lasers à colorant[7].
Annexes
Articles connexes
Liens externes
Bibliographie
Notes et références
- ↑ Arrêté du 4 décembre 2008 relatif à la mise en oeuvre de la conditionnalité au titre de 2008
- ↑ (en) R. Pezet, K. Gindro, O. Viret, J.-L. Spring, « Glycosylation and oxidative dimerization of resveratrol are respectively associated to sensitivity and resistance of grapevine cultivars to downy mildew », dans Physiological and Molecular Plant Pathology, vol. 65, 2004
- ↑ (en) Bharat B. Aggarwal (Ed.), Shishir Shishodia (Ed.), Resveratrol in Health and Disease, CRC Press, 2005, 712 p.
- ↑ (en) M. S. KEMP, R. S. BURDEN, « PHYTOALEXINS AND STRESS METABOLITES IN THE SAPWOOD OF TREES », dans Phytochemistry, vol. 25, no 6, 1986
- ↑ (en) Sheng-Hong Li, Xue-Mei Niu, Stefan Zahn, Jonathan Gershenzon, Jennie Weston, Bernd Schneider, « Diastereomeric stilbene glucoside dimers from the bark of Norway spruce (Picea abies) », dans Phytochemistry, vol. 69, 2008, p. 772-782
- ↑ [1]
- ↑ B. Cagnac, J-P Faroux, Lasers, EDP Sciences, CNRS éditions, 2002
- Portail de la chimie
Catégories : Hydrocarbure aromatique | Alcène | Colorant organique | Marqueur fluorescent
Wikimedia Foundation. 2010.


