- Silicate de sodium
-
Silicate de sodium 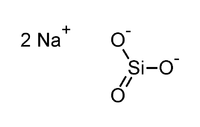
Formule,
et échantillon de silicate de soudeGénéral Synonymes Métasilicate de disodium
Sel disodique de l'acide silicique
trioxosilicate de disodiumNo CAS No EINECS No E E550 SMILES InChI Apparence solide cristallin de formes variables, incolore à blanc,hygroscopique[1]. Propriétés chimiques Formule brute Na2SiO3 Masse molaire[2] 122,0632 ± 0,0012 g·mol-1
Na 37,67 %, O 39,32 %, Si 23,01 %,Propriétés physiques T° fusion 1 089 °C[1],
72 °C (pentahydrate),
48 °C (nonahydrate)Solubilité 175 g·l-1 dans l'eau à 20 °C
(200gr selon l'INRS[3])Masse volumique 2,6 g·cm-3[1] Thermochimie S0solide 113.8 J.K-1.mol ΔfH0solide -1519 kJ/mol Précautions Directive 67/548/EEC 
CPhrases R : 34, 37, Phrases S : (1/2), 13, 24/25, 36/37/39, 45, Transport 80 3253 SIMDUT[4] 
SGH[5] 
DangerInhalation irritant respiratoire Peau corrosif (provoque des brûlures) Yeux risque de brûlures Composés apparentés Cations apparentés Silicate de potassium Unités du SI & CNTP, sauf indication contraire. Le (méta)silicate de sodium (ou Sel disodique de l'acide silicique ou Trioxosilicate de disodium) est une substance chimique de formule Na2SiO3, inodore et très soluble dans l'eau. C'est une base forte formant des solutions très alcaline, corrosive pour la peau et les muqueuses (pH 13 en solution à 1 %).
Le '(méta)silicate de sodium se forme naturellement par réaction de la silice (dioxyde de silice) avec le carbonate de sodium à l'état fondu du silicate de sodium et du dioxyde de carbone.- Na2CO3 + SiO2 → Na2SiO3 + CO2
On le trouve sous deux formes principales
- forme anhydre (il se présente alors comme un solide cristallin translucide à blanc de formule NA2SiO3) ;
- forme hydratée (NA2SiO3.nH20), il est parfois qualifié de « verre liquide » (water glass ou liquid glass pour les anglophones).
Dans les commerce, ses formes les plus courantes sont
- la forme anhydre (n° CAS = 6834-92-0) ;
- la forme pentahydratée (n° CAS = 10213-79-3) ;
- la forme nonahydratée (n°CAS = 13517-24-3).
Sommaire
Histoire
Le « verre liquide » a été défini dans Manuel of Chemical Technology de Von Wagner (traduit en 1892 en anglais) comme tout silicate alcalin soluble, d'abord observé par Van Helmont en 1640 comme une substance fluide apparaissant lorsqu'on fait fondre du sable (silice) avec un excès d'alcali.
Johann Rudolf Glauber a - en 1648 - produit ce qu'il a appelé de la « silice fluide », à partir de potasse et silice.
Von Fuchs, en 1825, a obtenu du verre liquide par réaction d'acide silicique sur un alcali, le résultat étant soluble dans l'eau « mais non affecté par les changements atmosphériques »[6].
Von Wagner en distingue plusieurs types ; de soude, de potasse, « double » (soude et de potasse), etFixin. Le type Fixin était un fixatif constitué d'un mélange sursaturé en silice de « verre liquide » (de potasse et de soude), utilisé pour stabiliser des pigments inorganiques à l'eau déposés sur du ciment (pour les enseignes extérieures et murales).
Propriétés
Le silicate de soude est une poudre blanche très soluble dans l'eau, produisant un solution alcaline.
Il fait partie d'une famille de composés apparentés comprenant l'orthosilicate de soude, Na4SiO4, le pyrosilicate, de soude Na6Si2O7 et d'autres composés proches, qui sont tous sont vitreux, très alcalins, incolores et solubles dans l'eau.
Le silicate de sodium est stable en solution de pH neutre ou alcalin.
Dans une solution acide, l'ion silicate réagit avec les ions hydrogène pour former de l'acide silicique, qui quand il est chauffé et grillé forme le gel de silice, une substance dure et vitreuse.Désignations chimiques
Chaque substance a son propre numéro de registre CAS et son propre numéro EINECS. Le numéro du CAS ou EINECS du silicate de sodium et d'autres substances apparentées sont les suivants[7] :
Nom de la substance N°CAS N°EINECS acide silicique, sel de sodium 1344-09-8 239-981-7 métasilicate de disodium 6834-92-0 229-912-9 silicate de soude 15859-24-2 215-687-4 Usages
Disponible en solution aqueuse et sous forme solide, il est notamment utilisé :
- dans les ciments ;
- comme ignifugeant ;
- dans certains matériaux réfractaires ;
- dans l'industrie textile ;
- dans certains produits d'entretien (ménagers ou industriels, tels que détergeant, désinfectants, produit de nettoyage alimentaire)
- dans l'industrie de la transformation du bois ;
- dans l'industrie métallurgique (décapant, dégraissant)
- dans certaines colles, peintures et produits de blanchiment
- pour la préparation de produits cosmétiques
- dans l'industrie automobile ;
- dans les cartonneries, pour coller la cannelure (ou microcannelure) à une ou plusieurs feuille plate, ou plusieurs cannelures entre elles, ou plusieurs feuilles de carton ondulé entre elles. Lors du passage dans les machines à haute température, le silicate de soude polymérise et colle solidement les feuilles de papier entre elles ;
- dans l'alimentation, comme additif alimentaire, alors réglementé sous le numéro E550, comme anti-agglomérant[8] et - au début du XXe siècle avec un grand succès - pour la conservation des œufs. Quand des œufs frais sont plongés dans une solution de silicate de soude, les bactéries capables de dégrader l'œuf en sont tenues à l'écart et l'humidité y est maintenue, conservant l'œuf pour au maximum neuf mois. Il fallait percer la coquiller des œufs ainsi conservés avant de les faire cuire dans de l'eau bouillante, pour permettre à la vapeur de s'échapper car la coque n'en était plus poreuse[9] ;
- comme mastic de réparation rapide : du silicate de soude et du silicate de magnésium dissous dans de l'eau sont utilisés en pâte épaisse pour réparer des pots d'échappements. Quand le dispositif d'échappement atteint sa température de fonctionnement, la chaleur sèche la pâte qui polymérise en une sorte de verre, permettant une réparation (temporaire, car néanmoins relativement fragile) ;
- comme étanchéifiant de réparation en milieu liquide et chaud (il a ainsi été en 2011 utilisé pour boucher des fissures suite à l'accident de la centrale nucléaire de Fukishima. Le silicate de sodium en solution peut colmater des fuites dans des joints (ex joint de culasse, avec du « verre liquide » injecté via le radiateur d'une voiture par exemple et envoyé dans les parties chaudes du moteur, car à 100-105°C, le silicate de sodium perd ses molécules d'eau pour former un produit d'étanchéité très puissant qui ne fond qu'au dessus de 810°C. Un joint de culasse réparé au silicate de soude peut rester étanche jusqu'à deux ans voire plus, avec une étanchéification très rapide (dans les minutes suivant l'application). Ce type d'utilisation n'est possible que dans un milieu qui atteindra la température de polymérisation de 100-105°C ;
- comme inhibiteur de la corrosion dans certains circuits d'eau
- comme substrat de croissance de certaines algues dans les écloseries d'aquaculture ;
- pour la fabrication (anciennement) de munitions, par exemple pour les cartouches de revolvers à poudre noire produites par la Colt's Manufacturing Company de 1851 à 1873, notamment durant la guerre de Sécession. Le silicate de sodium scellait les papier nitrés combustibles ensemble pour former une cartouche en papier conique contenant la poudre noire, ainsi que pour coller la balle de plomb ou de la balle conique à l'extrémité ouverte de la « cartouche » de papier. Ces cartouches collées au silicate de sodium étaient insérées entières dans les fûts de revolvers, ce qui accélérait le temps rechargement. Cet usage a été détronné par l'invention des cartouches à gaine de laiton à partir de 1873[10],[11] ;
- dans l'industrie du forage : mélangé au fluide de forage, il permet de stabiliser les parois de puits de forage et d'éviter leur effondrement ou l'alésage des parois, notamment dans des couches argileuses ou dans les formations contenant des minéraux argileux gonflants tels que la smectite ou la montmorillonite ;
- pour renforcer une maçonnerie ou du béton, du stuc, plâtre, etc. (ainsi rendu moins poreux ou hydrofuges, grâce à une réaction chimique avec l'excès de Ca(OH)2 (portlandite) présent dans le béton, qui lie de façon permanente les silicates, ce qui rend leur surface plus dure et hydrofuge. Il est généralement conseillé d'appliquer ce traitement uniquement après le temps de durcissement initial (7 jours ou plus selon les conditions) ;
- pour inactiver des moteurs de véhicules : pour les voitures devant être retirées définitivement de la circulation, une solution de silicate de sodium est utilisée à peu de frais, pour détruire rapidement et définitivement le moteur. On remplace son huile minérale par 2 litres de solution, qui précipitent et endommagent définitivement les rouages et pistons en quelques minutes[12]. Cette procédure est par exemple obligatoire aux États-Unis dans le cadre du programme Car Allowance Rebate System (CARS)[12],[13] ;
- pour produire des matériaux réfractaires, en tant que liant de matériaux ininflammables et isolants tels que vermiculite et perlite. Des panneaux réfractaires ou de protection passive contre l'incendie peuvent ainsi être produits, ainsi que des protections moulées (autour de tuyaux par exemple). En mélangeant le silicate de soude avec des poudres minérales finement broyées (poussière de vermiculite par exemple), on peut produire des adhésifs à haute température (l'intumescence disparaît). Le silicate de soude étant peu coûteux et disponible en abondance, il a été utilisé dans de nombreuses applications réfractaires.
Protection passive contre le feu
 Le silicate de soude présente des propriétés expansive et d'incombustibilité intéressantes pour certains usages contre les dégâts du feu.
Le silicate de soude présente des propriétés expansive et d'incombustibilité intéressantes pour certains usages contre les dégâts du feu.
En solution, ce produit attaque certains métaux dont l'aluminium, l'étain, le plomb, le zinc, le cuivre et leurs alliages en dégageant de l'hydrogène (ce qui induit un risque d'explosion). Il doit pour cette raison être stocké dans du plastique ou de l'inox.
Sa densité est de 2,61,
Écotoxicologie
Elle ne semble pas avoir été très étudiée. Elle semble essentiellement liée à son caractère corrosif, mais atténuée, au moins dans les milieux exposés aux pluies par son caractère lessivable, en raison de sa grande solubilité.
Toxicité
Les effets de toxicité chroniques ne semblent pas avoir été testés chez l'homme[3], mais un cas au moins de forte sensibilisation allergique a été décrit ;
Des effets toxiques aigus existent chez l'homme [14],[15],[16],[17],[18], comme chez d'autres organismes animaux (testés en laboratoire). Ils semblent due à l'alcalinité de la molécule qui par ingestion provoque une hémorragie stomaccale et du duodénum, ainsi qu'une érosion de l'intestin grêle. Chez le chien et le porc expérimentalement exposés (quel que soit l'âge de l'animal), au delà de 250 mg/kg, ce produit a produit des nécroses ulcératives aigues de l'épithélium du tractus digestif supérieur, des poumons (avec œdème) et des reins (nécrose des tubes rénaux proximaux)[3].Inhalé, il irrite fortement le tractus respiratoire et corrode les muqueuses olfactives[17]. Des réponses d'hypersensibilité existent chez la souris (mesurées par le gonflement oedémateux de l'oreille) mais il est considéré comme un allergène faible[19],[3];
En exposition prolongée à dose plus faible, il produit une réaction inflammatoire ulcérative de la bouche et muqueuses et des dermites ; Les espèces de mammifères y semblent différemment sensibles, par exemple une polydipsie, polyurie et lésions des tubes rénaux apparaissent (chez le chien) pour une exposition à 2400 mg.kg dans la nourriture durant 4 semaines, mais pas chez le chat)[3].
DL 50 orale
Elle est - pour une solution aqueuse à 10 % - de 1280 mg/kg (de 847 chez le mâle à 1350mg/kg chez la femelle), et pour la souris de 770 mg/kg (de 770 chez la femelle à 820mg/kg chez le mâle)[3].
NOAEL
Elle est de 792 mg/kg/j chez le rat exposé durant 2 ans via son eau de boisson[3].
Les détergents contenant ce produit sont de puissants irritants pour la peau, les yeux et le tractus respiratoire. En poudre anhydre sur la peau, il n'est pas irritant chez les animaux qui (lapin par ex) ne transpirent pas.
Mutagénicité
il ne semble pas mutagène selon le test d'Ames et chez Bacillus subtilis, il n'induit pas de lésion de l'ADN; on n'a pas détecté d'aberration chromosomique dans la moelle osseuse de souris exposées à 740-1340 mg.kg par voie orale) [20]
Cancérogénicité
Il est théoriquement potentiellement cancérigène en tant qu'agent corrosif, sur les cellules squammeuses de l'œsophage par exemple, mais des rats exposés via leur boisson durant 2 ans à 792 mg/kg/j n'ont pas développé de tumeurs[3].
Il est connu qu'une silicose peut être induite par l'inhalation de particules de silice, mais elle n'est pas observée avec l'inhalation de métasilicate de disodium en solution, probablement car il est très soluble est pour cette raison rapidement et totalement éliminé de l'organisme[3].Reprotoxicité
Ce produit est reprotoxique chez le rat mais non chez la souris[3]
- les rats exposés à 790 à 1580 ppm dans l'eau de boisson, du sevrage à la fin de la reproduction ont produit 20 % de descendants en moins,
et la survie des petits au sevrage a été fortement affectée (24 % de la normale) (1). Mais aucun effet n'a été observé sur la reproduction des souris gavées de 12,4-50-200mg/kg du 1er au 18ème jour de gestation[20].
Voir aussi
Articles connexes
Liens externes
- (fr)
Bibliographie
Références
- METASILICATE DE SODIUM, ANHYDRE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- Fiche toxicologique INRS
- « Métasilicate de sodium » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- VonWagner, Rudolf (1892 translation of 13th edition by Willian Crookes) Manual of Chemical Technology [1]
- ESIS: European chemical Substances Information System
- Codex Alimentarius (1989) Noms de catégorie et système international de numérotation des additifs alimentaires. CAC/GL 36-1989, p1-35.
- How To Store Fresh Eggs
- Tom Kelley, « Making and Using Combustible Paper Pistol Cartridges », August, 1995
- (en) Kirst, W.J., Self Consuming Paper Cartridges for the Percussion Revolver, Northwest Development Co., 1983
- Helliker, Kevin. "The Killer App for Clunkers Breathes Fresh Life Into 'Liquid Glass'" The Wall Street Journal, 4 August 2009.
- Engine Disablement Procedures for the CARS program, cars.gov
- Pierces S.W. ; Sodium Metasilicate in alkaline materials. Patty's Tosicology, 5ème ed. Wiley J & Sons, New-York, 2001, Vol3 pp 598-600
- Sodium Metasilicate ; In : Base de données HSDB, Toxnet
- Lewis RJ Hawleys"s condensed chemical dictinary, New-york, John Wiley and sons, 2001
- Elmore AR ; Cosmetic ingredient review expert Panel. Final report on the safety assessment of potassium silicate , sodium metasilicate and sodium silicate. International Journal of Toxicology, 2005, 24 suppl. 1, Pp 103-117
- Tanaka T, Miyachi Y, Horiot T, Ulcerative contact dermatitits caused by sodium silicate. Coexistence of primary contact dermatitis and contact urticaria. Arch Dermatol, 1982, Jul ; 118(7):518-520
- Karrow NA. et al. odium metasilicate hyypersensitivity in Balb/c mice. American Journal of Contact Dermatitits, 2002, 13, pp 133-139
- HERA Risk assessment on soluble silicates (draft) http://www.cees-silicates.org/recentpublicationscees.htlm.



