- SF6
-
Hexafluorure de soufre
Hexafluorure de soufre 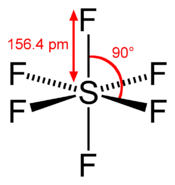
Formule chimique et vue 3DGénéral Nom IUPAC Hexafluorure de soufre No CAS No EINECS Apparence gaz comprimé liquefie, incolore, inodore.[1] Propriétés chimiques Formule brute SF6 Masse molaire 146,055 g∙mol-1
F 78,05 %, S 21,95 %,Propriétés physiques T° fusion -51 °C[1] T° ébullition -63,8 °C (sublimation) Solubilité 0.041 g/l (eau) Masse volumique 6,16 (densité relative par rapport à l'air: 5,114) Pression de vapeur saturante 21.5 bar (à 21 °C) Point critique 45,55 °C - 3 76×106 Pa Précautions Transport - 1080 SIMDUT[2] 
Unités du SI & CNTP, sauf indication contraire. L’hexafluorure de soufre est un composé chimique de soufre et de fluor, de formule chimique SF6. C’est un gaz inerte, sans odeur, incolore.
Sommaire
Applications
Le SF6 est utilisé :
- comme gaz détecteur de fuites
- dans la métallurgie pour la production d’aluminium et de magnésium ;
- dans la fabrication de semi-conducteurs (en raison de son caractère inerte et de sa densité permettant de maintenir la pureté du milieu contre les poussières et éléments oxydants), ainsi que dans la gravure ionique réactive du silicium ;
- dans la construction électrique : postes électriques (Gas Insulated Substation) et appareillage électrique à haute tension pour sa forte rigidité diélectrique et sa bonne stabilité à l'arc électrique;
- dans les accélérateurs de particules : pour les mêmes raisons ;
- dans des applications médicales : par exemple pour la désinfection des matériels respiratoires contre les microbes aérobies ;
- dans la semelle de certaines chaussures de sport jusqu’aux années 2000 (avant d’être remplacé par de l’azote, à cause de son caractère de gaz à effet de serre).
- dans certains tours de magie : à cause de sa très forte densité (de même que l’hélium pour la raison inverse) ;
- dans des spectacles : inspiré, il rend la voix plus grave (à cause de sa forte densité qui modifie la vitesse de propagation des ondes sonores dans l’espace vibratoire des cordes vocales) à l’inverse de l’hélium ; cette pratique est cependant déconseillée à cause des risques élevés de suffocation.
- L'intérêt pédagogique du SF6 est d'avoir des caractéristiques physiques permettant une mise en évidence du Point critique "relativement" facilement. Tc vaut en effet environ 41 °C sous une pression de 42 bar. L'expérience permet de faire "le tour" du Point critique en observant le phénomène d'opalescence critique.
Danger en cas d’exposition à une concentration élevée et prolongée
Ce gaz est suffocant à haute concentration. Il n'est pas toxique. La ventilation du local dans lequel il est employé suffit normalement à réduire les risques de suffocation.
Applications électriques
Ce gaz est un excellent isolant électrique. Sa rigidité diélectrique est 2,5 fois supérieure à celle de l’air. Cette bonne tenue électrique, alliée à sa très bonne stabilité lorsqu’il est traversé par un arc électrique (ionisation très faible), en fait un matériau de choix pour l’isolement des disjoncteurs haute tension. Plus généralement, il est utilisé dans les matériels des postes électriques. La particularité de l’industrie électrique est de recycler en grande partie l’hexafluorure de soufre utilisé : les appareils en fin de vie sont vidés de leur gaz, et ce gaz après traitement est utilisé pour remplir de nouveaux appareils.
En 2002, dans l’Europe des 15, le SF6 utilisé dans l’appareillage électrique n’a représenté que 0,05 % des émissions de gaz à effet de serre. Entre 1995 et 2005, les émissions de SF6 de l’industrie électrique ont diminué de 40 %.[3]
Aspects environnementaux
Le SF6 est l'un des 6 types de gaz à effet de serre visés par le Protocole de Kyoto. Son potentiel de réchauffement global (PRG) est 22 800[4] fois supérieur à celui du CO2, ce qui en fait potentiellement le plus puissant gaz à effet de serre sur Terre. Cela signifie que chaque kilogramme de SF6 émis dans l’atmosphère a le même impact sur l’effet de serre global à long terme que 22 800 kilogrammes de CO2. Sa contribution à l’effet de serre global est cependant inférieure à 0,3 % en raison de sa faible concentration par rapport au CO2.[5] Enfin, une diminution des émissions de SF6 a été observée de 1990 à 2004 (-40% au Canada et -34% en France).[6],[7], mais il faut néanmoins tenir compte du fait que c'est aussi le gaz à effet de serre qui a la plus longue durée de vie dans l'atmosphère : 50 000 ans[8].
Notes et références
- ↑ a et b HEXAFLUORURE DE SOUFRE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- ↑ « Hexafluorure de soufre » dans la base de données de produits chimiques Reptox de la CSST (organisme canadien responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- ↑ (en) Communiqué de presse du Capiel.
- ↑ (en) Intergovernmental Panel on Climate Change, Working Group 1, Climate Change 2007, Chapter 2.
- ↑ A. A. Lindley, A. McCulloch, Regulating to reduce emissions of fluorinated greenhouse gases, Journal of Fluorine Chemistry, n° 126, pp. 1457–1462 (2005).
- ↑ Rapport d’inventaire national 1990–2004 - Sources et puits de gaz à effet de serre au Canada.
- ↑ CITEPA - Données annuelles nationales - GES - SF6
- ↑ Selon le gouvernement français, dans le texte introductif de la rubrique "Emissions de Ges" de la Mission interministérielle de l'effet de serre (consultée le 11 mai 2008)
Voir aussi
Liens externes
Articles connexes
- Portail de la chimie
Catégories : Composé du fluor | Fluorure | Composé du soufre | Gaz à effet de serre
Wikimedia Foundation. 2010.
