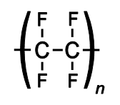
- Polytetrafluoroethylene
-
Polytétrafluoroéthylène
Polytétrafluoroéthylène Général Nom IUPAC Poly(difluorométhylène) Synonymes Polytétrafluoroéthène, PTFE, Téflon (dans le langage courant) No CAS SMILES Apparence solide blanc inodore Propriétés chimiques Formule brute C2F4 [Isomères] Masse molaire 100,015 g∙mol-1
C 24,02 %, F 75,98 %,Propriétés physiques T° fusion 327 °C [1] Solubilité insoluble Masse volumique 2,16 g·cm−3 [1] Conductivité thermique 0,25 Wm-1K-1 à 25 °C Cristallographie Structure type semi-cristalline Propriétés optiques Indice de réfraction non transparent[2] Transparence opaque sauf films très minces amorphes[2] Précautions SIMDUT[4] Produit non contrôlé Classification du CIRC Groupe 3 : Inclassable quant à sa cancérogénicité pour l'Homme[3] Unités du SI & CNTP, sauf indication contraire. Le polytétrafluoroéthylène (sigle PTFE), est un fluoropolymère issu du tétrafluoroéthylène.
Ce polymère technique a été découvert par hasard en 1938 par le chimiste Roy J. Plunkett (1910-1994) travaillant pour la société Du Pont de Nemours. Il fut introduit commercialement en 1949. Il est commercialisé sous les marques déposées Teflon, Hostalen, Hostaflon ou Fluon. La marque la plus connue est Teflon de Du Pont de Nemours.
Il possède des propriétés remarquables qui le distinguent des autres polymères thermoplastiques, notamment une excellente résistance thermique et chimique, ainsi qu'un coefficient de frottement extrêmement faible.
Dans la vie courante, le Téflon est largement utilisé comme revêtement anti-adhésif dans les ustensiles de cuisine.
Sommaire
Description
Le PTFE est doux, facilement déformable, semi-cristallin, opaque, blanc et alimentaire. Son allongement est élevé (propriétés mécaniques de type élastomère) et sa résistance aux contraintes et aux radiations est faible. Il présente une remarquable résistance à la plupart des produits chimiques, un coefficient de frottement extrêmement faible et reste stable à température élevée (jusqu'à 327 °C)[5]. Ces propriétés inhabituelles lui confèrent une valeur inestimable pour un grand nombre d'applications.
Le polytétrafluoroéthylène est par ailleurs le seul matériau auquel les pattes de la plupart des geckos arboricoles n'adhèrent pas.Utilisations
Le PTFE représente environ 90 % de la consommation de fluoropolymères, soit ~ 20 000 t/an.
Dans l'industrie, il est utilisé dans les roulements, les joints, l'isolation électrique à hautes températures, les revêtements et garnitures non adhésives pour les cuves, etc. Dans la vie courante, il constitue le revêtement de certains ustensiles de cuisine et s'utilise en ruban afin d'assurer l'étanchéité de montages filetés.- Il est utilisé comme revêtement anti-adhésif des poêles et autres ustensiles de cuisine, et de manière générale comme lubrifiant solide.
- Étant inerte chimiquement, il est souvent utilisé pour recouvrir l'intérieur de récipients ou des tuyaux contenant des composés chimiques réactifs.
- En musique traditionnelle, les luthiers utilisent du PTFE en rouleau pour fabriquer des anches de cornemuse. Il est également utilisé par la marque française de guitare électrique Vigier, pour faire des sillets.
- En plomberie, il est utilisé pour assurer l'étanchéité des raccords à visser en lieu et place de la filasse (de la laine ou du chanvre généralement) et de la poix.
- Le tissu Gore-Tex est constitué principalement de PTFE.
- On l'utilise pour tous types d'habits anti-pluie.
- On s'en sert pour gainer certaines balles de pistolets.
- En électronique, particulièrement dans le domaine micro-onde, le PTFE est utilisé comme substrat (de permittivité relative voisine de 2,2). Il possède en effet un angle de perte très faible et un fort point de claquage. Malheureusement, sa rigidité mécanique est mauvaise (le PTFE est souple) ; pour compenser ce défaut, les fabricants de substrats, noient souvent une ou deux épaisseurs de fibre de verre à l'intérieur du substrat, ce qui rigidifie la plaque sans trop altérer ses performances diélectriques. L'angle de perte très faible fait du PTFE un isolant de choix dans les câbles HF haute-performance.
- Sa rigidité diélectrique élevée en fait un élément de choix dans la réalisation de pièces isolantes dans de nombreux domaines de l'électricité, comme par exemple le fil de câblage haute tension.
- Dans l'automobile, il est utilisé pour fabriquer des gaines d'accélérateur (Push-pull) ou pour recouvrir certaines pièces de frottement.
- Dans le domaine de la santé, il est utilisé comme matériau d'implantation de choix en hémodialyse par exemple où la pose d'une prothèse vasculaire en PTFE peut s'avérer utile en cas d'impossibilité de création d'une fistule artério-veineuse native. Le PTFE est un matériau extrêmement neutre pour l'organisme. On le retrouve dans diverses prothèses et certains bijoux de body-art (piercing, implants, ...).
- Au cours de tests comportementaux, il est utilisé pour délimiter le compartiment vertical d'un espace à l'intérieur duquel les insectes sont contraints : en effet les pattes des insectes n'adhèrent pas au PTFE.
- Dans le domaine informatique, le PTFE est utilisé comme bases des souris (les patins) pour offrir un mouvement régulier, une glisse améliorée, une réponse plus rapide et un équilibre amélioré, ce qui ravira les joueurs aguerris.
- En chimie, il est utilisé dans de nombreux instruments (surtout des barreaux magnétiques, robinets et autres), son coefficient de friction très faible permet de fabriquer des pièces qui, non seulement ne réagissent pas avec les produits chimiques, mais qui sont auto-lubrifiantes.
Enfin, le PTFE est parfois utilisé pour les gaines des bus informatiques.
Propriétés
Chimiques
- Généralement excellente inertie chimique, notamment avec les acides (oléum, eau régale, acide nitrique fumant), les bases (soude ou potasse concentrées), les alcools, les cétones et les hydrocarbures. Il résiste à l'acide fluoroantimonique, l'acide le plus fort connu actuellement, qui dissout le verre.
- Le PTFE n'est pas compatible avec la diéthylamine, le diméthyl-formamide, le fluor et le cyanure aureux.
Thermiques
- Température de fusion : 342 °C (vierge) 327 °C (fritté)[2] (thermostable)
- Température de transition vitreuse : environ -30 °C
- Températures limites d'emploi (usage permanent) : -150 à 250 °C[2] (un des plus larges intervalles d'utilisation des polymères thermoplastiques)
- Chaleur spécifique : 1 000 JK-1kg-1
- Coefficient d'expansion thermique : 100 à 160 10-6K-1
- Température de déflection à la chaleur (HDT[6]) à 0,45 MPa : 120 °C
- Température de déflection à la chaleur (HDT) à 1,8 MPa : 54 °C
Physiques
- Masse volumique : 2,15 kg.dm-3 pour 50 % de cristallinité[7]
- Absorption d'eau sur 24 heures : 0,01 % (hydrophobe)
- Indice limite d'oxygène (ILO) : 95 % (valeur très élevée, matière ininflammable, auto-extinguible)
- Perméabilité au diazote à 25 °C : 1.1013cm²s-1Pa-1
- Perméabilité au dihydrogène à 25 °C : 7.1013cm²s-1Pa-1
- Perméabilité au dioxyde de carbone à 25 °C : 7.1013cm²s-1Pa-1
- Perméabilité au dioxygène à 25 °C : 3.1013cm²s-1Pa-1
- Perméabilité à l'eau à 25 °C : 25.1013cm²s-1Pa-1
- Résistance aux ultra-violets : excellente
Mécaniques
Le comportement mécanique est de type élastomère et identique entre -80 et 250 °C.
- Dureté Shore D : 50-65
- Dureté Rockwell : 25
- Module de Young : 300 à 800 MPa
- Résistance à la traction : 10 à 40 MPa
- Allongement à la rupture : 100 à 400 %
- Coefficient de frottement : 0,05 à 0,2
- Résistance au choc Izod : pas de rupture[2]
- Coefficient de Poisson : 0,46
Électriques
Les propriétés électriques du PTFE sont exceptionnelles.
- Permittivité relative à 1 MHz : 2,0 à 2,1
- Facteur de dissipation à 1 MHz : 0,0003 à 0,0007
- Rigidité diélectrique : 15 à 17 kV mm-1
- Résistivité : 1 018 à 1 019 ohm.cm
Inconvénients
- La mise en œuvre est difficile et particulière : ne pouvant être transformé par fusion (il est non moulable sur matériel de transformation classique), il est formé par une méthode de frittage.
- Le PTFE se dégrade à 400 °C, proche de sa température de transformation (380 °C), avec dégagement d'acide fluorhydrique (corrosif) et de monomère gazeux (dépolymérisation).
- Propriétés mécaniques faibles.
- Impression ou collage pratiquement impossibles.
- Coût élevé (polymère technique) et donc utilisation relativement peu développée.
Les autres fluoropolymères ont été développés pour atténuer ces inconvénients.
Par exemple, le polytrifluorochloroéthylène (PCTFE, issu du monomère CFCl=CF2) (point de fusion ~ 213 °C) se transforme un peu plus facilement que le PTFE. Il montre un intervalle d'emploi (en usage permanent) de -250 à 150 °C[2]. Il offre une tenue au froid et des propriétés mécaniques[8] meilleures que le PTFE, par contre sa tenue thermique et chimique est moindre.Toxicité
Le PTFE est chimiquement inerte et non toxique à basse température, mais commence à émettre des produits toxiques à 230 °C (température normalement atteinte par une poêle après 2 à 5 minutes d'utilisation normale). La décomposition du PTFE engendre au-delà de 350 °C des émissions parfois mortelles pour les oiseaux, pouvant causer des symptômes s'apparentant à la grippe chez les humains[9].
Par comparaison, les graisses de cuisine (huiles et beurres) commencent à brûler autour de 200 °C. Une étude de 1959 a conclu que la toxicité des émanations du revêtement (par chauffage sec) était moindre que celle des fumées générées par des huiles de cuisine surchauffées[10].
En 1973, une étude a confirmé ces résultats précédents. Elle a, de plus, montré que l'exposition aux produits de cuisson du beurre à 260 °C, pendant quatre heures, dans une poêle sans revêtement, était toxique à 100 % (mortelle) pour les perruches tandis que les mêmes conditions avec une poêle à revêtement n'entraînait aucun décès chez les animaux jusqu'à 280 °C[11]. Par ailleurs, au cours des quarante dernières années, les poêles anti-adhésives ont été largement utilisées et il n'a été reporté qu'un cas mineur ayant un effet limité sur la santé et lié à la surchauffe d'une poêle[12].
En 2005, l'Agence de protection de l'environnement des États-Unis (EPA) a trouvé que l'acide perfluorooctanoïque (APFO ou PFOA en anglais, aussi connu sous le nom de C8), un produit chimique clef employé pour fabriquer le Téflon, était cancérigène. Cette découverte est une partie d'un rapport (en anglais)[13] qui est en cours de relecture avant acceptation finale.
Les laboratoires DuPont qui le commercialisent ont été condamnés à payer plus de 16 millions de dollars aux autorités sanitaires des États-Unis pour avoir dissimulé certains risques potentiels[14]. Des études ont montré que l'APFO provoque des cancers chez l’animal[réf. nécessaire].
Une action en justice, menée par 60 000 habitants résidant près d'usines américaines du groupe, a condamné DuPont à dépenser 345 millions de dollars pour les dédomager et l'obliger à stopper l'émission d'APFO dans l'eau et le sol. À ce jour, ce produit chimique n'est pas accepté par l'EPA. En 2007, parmi d'autres composés perfluorés, l'acide perfluorooctanoïque, réputé persistant dans l’environnement, et accumulable dans les tissus adipeux des organismes vivants, toxique pour l’homme et les animaux a été trouvé[15] dans le sang du cordon ombilical de 100 % de 299 nouveau-nés testés à Baltimore, ce qui montre une contamination intra-utérine généralisée dans cette région. D'autres composés perfluorés ont été trouvés, mais à des doses plus faibles et/ou chez moins de sujets.
En janvier 2006, DuPont, la seule compagnie à utiliser l'APFO en usine sur le territoire américain, a annoncé son intention de supprimer les émissions de ce produit pour 2015. Elle recherche actuellement un substitut et n'a donc pas prévu de ne plus l'utiliser, ce produit étant essentiel dans la production du Teflon. Cette annonce englobe tous les produits de la société utilisant le Teflon. En effet, l'APFO rentre dans la fabrication du Teflon qui sert aussi bien pour les ustensiles de cuisine que pour les emballages, vêtements et revêtements pour le sol.
Il est reconnu que le Teflon rentre dans la production de poêles et plats anti-adhésifs. Il est seulement utilisé dans le processus de fabrication et il ne doit pas y avoir de traces mesurables d'APFO dans ces ustensiles[12].
Aspects environnementaux
Les effets indirects du PTFE est le fait qu’il peut produire des gaz à effet de serre dans l’atmosphère lorsque chauffé. En effet à 600 °C il y a production de PFB (polyfluorobutène) et à 650 °C de tétrafluorure de carbone (CF4)[réf. nécessaire][16]. Ces dernières[Lesquelles ?] possèdent un lien covalent qui est polarisé, absorbant la lumière qui est réflectée du soleil (parmi 30 % de la lumière qui est reflétée, 15 % est absorbée par les gaz à effet de serre par les vibrations de cisaillement de la molécule).
Le problème du CF4 et du PFB est que ces molécules possèdent un temps de vie très élevé (par exemple 50 000 ans pour le CF4) et une puissance relative de réchauffement de la planète par kilo intégré pour 100 ans de 6 500[17]. Si on comparait à ce que contribue le CO2, il possèderait un temps de vie 1 000 fois plus long. Il faudra aussi noter que le taux de croissance annuelle augmente de 2 % pour le CF4 comparativement au CO2 qui est de l’ordre de 0,4 %.
Problème : l'usage des chlorofluorocarbures (CFC) ayant été banni il y a quelques années, ceux-ci ont été remplacés par d’autres contribuants (par exemple CF4) non moins puissants en potentiel de réchauffement et possédant cette fois-ci un temps de résidence 500 fois plus long. Non seulement la dégradation à haute température du PTFE se fait ressentir dans le réchauffement de la planète, mais il se fait aussi ressentir dans les eaux souterraines, lacs, la mer et chez les animaux. En fait la plus haute concentration qui se fait ressentir parmi les PFC (composés perfluorés) est celle du PFOA.
Le PFOA fait partie des POP (polluants organiques persistants) donc ne se décompose pas ou peu dans la nature. Le PFOA a été retrouvé au pôle chez les ours polaires, poissons, chez l’humain et dans tous les océans du monde[18]. Le PFOA est bioaccumulable et bioamplifiable.
Récemment des études permettant la dégradation du PFOA sont en vigueur dans le monde. En fait les études montrent la dégradation du PFOA en présence de Fe(III) et sous lumière UV à 254 nm[19]. Ainsi des analyses chimiques liées à la production du PTFE seraient de plus en plus demandées dans le monde. Et donc, le domaine de la chimie environnementale analytique serait en plein essor.
Aspects analytiques
Le PFOA provient de la décomposition du polytétrafluoroéthylène à 360 °C[20]. Ce composé est réputé par sa toxicité accrue et son effet cancérigène chez l’homme et chez les animaux[21]. Il est préoccupant puisqu’il persiste dans l’environnement et s’accumule dans le corps humain[22]. Cependant, différentes méthodes d’analyses ont été mises au point afin de déterminer et quantifier ces composés[Lesquels ?] dans différents milieux (eaux, sang, sérum, foie, plasma, sols, air, ustensiles de cuisine, etc..).
Analyse dans les eaux
Des analyses de PFOA et d’autres composés PFC[Lesquels ?] ont été effectuées dans le bassin du fleuve Pô en Italie dans le courant de l’année 2006 afin de déterminer les concentrations de PFOA déversé dans l’Adriatique. La méthode d’analyse utilisée dans ce cas-ci est la SPE (Solid Phase Extraction) et la LC/MS/MS (chromatographie liquide couplée à la spectrométrie de masse en tandem)[23].
La SPE est une technique de préparation d’échantillon basée sur l’adsorption sélective des analyses sur une surface solide.
La LC/MS/MS permet de faire la séparation et la quantification des composés. L’avantage de cette méthode est qu’elle permet de faire le dosage simultané des substances de structures différentes. Elle est dotée d’une grande sensibilité, spécificité accrue et très haute sélectivité, rapidité, amélioration du S/N (rapport signal/bruit), exactitude et précision inégalée, réduction de la limite de détection, mais coûteuse.
Les analyses ont été faites en collectant des échantillons d’eaux de différentes rivières sur une période allant de février à mars 2007. Ces analyses ont révélé des fortes concentrations de PFOA pour la rivière Tánara au courant de l’année 2007 soit 1270 ng/l et des concentrations variant de 60 à 337 ng/l pour le fleuve Pô au courant de l’année 2006 pour les différentes dates d’échantillonnages. La limite de détection pour les analyses de PFOA est de 100 pg/l. À partir de ces concentrations et du débit des rivières, la quantité de PFOA a été déterminée pour l’année 2006 soit une masse ~ 0,3 kg/heure de PFOA ou ~ 2,6 tonnes/année qui a été déposée dans la mer Adriatique (une partie de la mer Méditerranée)[24].
Analyse dans les tissus
Des analyses ont été faites pour la détermination des acides perfluorocarboxyliques (PFCA en anglais) en utilisant la chromatographie gaz-liquide (GLC en anglais) avec un détecteur à capture d’électron (ECD). Cette analyse a permis d’extraire efficacement le PFOA (perfluorooctanoic acid), le PFNA (perfluorononanoic acid) et le PFDA (perfluorodecanoic acid) dans le foie des rats méthylés avec le diazométhane puis séparé par GLC. Les concentrations obtenues de PFDA dans le foie de rat 24 heures après une dose administrée de 20 mg/kg par poids du corps était de 113,9 ± 11,4 µg/g de foie[25].
Néanmoins, de nouvelles études sont en cours d’évaluation concernant la persistance du PFOA et ses possibles effets sur la santé de l'environnement ainsi que la santé humaine.
Citations
Une blague tirée d'un sketch : « Selon la pub : rien n'adhère au Teflon ! Comment font-ils pour accrocher le Teflon aux poêles ? »
La solution : Comme le Teflon ne colle pas naturellement au métal, les premières poêles anti-adhésives étaient plutôt fragiles et il fallait utiliser des ustensiles spéciaux pour ne pas égratigner le revêtement. La technique s'est grandement améliorée depuis. Les procédés de fabrication sont brevetés mais quelques idées circulent : une des possibilités serait que : d'abord, on sable le fond de la poêle afin de le rendre rugueux. Ensuite, on enduit la surface d'un apprêt spécial. Finalement, on applique le Teflon sur l'apprêt. Même si le Teflon ne se combine pas chimiquement au métal, il est tout de même possible de le faire adhérer mécaniquement, c'est-à-dire en faisant en sorte qu'il s'introduise et s'agrippe dans les petites fentes et crevasses à la surface de la poêle.
Une alternative: On dépose des polymères en plusieurs couches sur le métal. On commence par un polymère qui adhère bien au métal et qui ressemble vaguement au Teflon. La seconde couche est un autre polymère qui adhère au polymère de la couche précédente, mais qui ressemble plus au Teflon. On fait ces applications jusqu'à ce que l'on applique le Teflon.
Notes et références
- ↑ a et b Entrée du numéro CAS « 9002-84-0 » dans la base de données de produits chimiques GESTIS de la BGIA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 8 février 2009 (JavaScript nécessaire)
- ↑ a , b , c , d , e et f D'après Monnet : conférence CPT avril-mai 1974. Disponible dans : Jean Bost, Matières plastiques : chimie-applications, Technique & Documentation Lavoisier, Paris, 1980 (ISBN 285206068X)
- ↑ IARC Working Group on the Evaluation of Carcinogenic Risks to Humans, « Évaluations Globales de la Cancérogénicité pour l'Homme, Groupe 3 : Inclassables quant à leur cancérogénicité pour l'Homme » sur http://monographs.iarc.fr, 16 janvier 2009, CIRC. Consulté le 22 août 2009
- ↑ « Teflon » dans la base de données de produits chimiques Reptox de la CSST (organisme canadien responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- ↑ Son excellente tenue thermique et chimique est due à la grande stabilité de la liaison C-F (liaison de forte énergie : 485 kJ/mol).
- ↑ Heat deflection temperature en anglais.
- ↑ Le PTFE possède la valeur de masse volumique la plus élevée des matières plastiques.
- ↑ Son module d'élasticité est supérieur à celui du PTFE.
- ↑ (en) Can Teflon make you sick?, Medical News Today
- ↑ Dale Blumenthal, « Is That Newfangled Cookware Safe? ». Consulté le 20 mai 2006
- ↑ Griffith, F.D.; Stephens, S.S.; Tayfun, F.O. Exposure of Japanese quail and parakeets to the pyrolysis products of fry pans coated with Teflon and common cooking oils. American Industrial Hygiene Association Journal (1973), 34(4), pp. 176-178.
- ↑ a et b About Teflon®. Consulté le 20 mai 2006
- ↑ Perfluorooctanoic Acid Human Health Risk Assessment Review Panel. Consulté le 20 mai 2005.
- ↑ (en) Andrew Eder, DuPont gets more time to test PFOA, The News Journal, Environmental Working Group, publié le 10 février 2009. Consulté le 1 octobre 2009
- ↑ Étude de l’école de santé publique John Hopkins Bloomberg, publiée par Environmental science and technology.
- ↑ Canaries in the kitchen. Environmental Working Group [online]. Available at: http://ewg.org/reports/toxicteflon/es.php. Accessed March 15, 2006
- ↑ Baird, 1995 et Bunce, 1994, Vanloon et Duffy, 2000, Environnement Canada, 1997
- ↑ N. Yamshita, K. Kannan, S. Taniyasu, Y. Horii, G. Petrick, T.Gamo,Marine Pollution Bulletin, 51, (2005) 658–668
- ↑ H. Hori, A Yamamoto, K. Koike , S. Kutsuna, I. Osaka, R. Arakawa, Chemosphere, 71, 2008, 206-313
- ↑ Canaries in the kitchen:Teflon toxicosis. Environmental Working Group [on line]. Published May 14, 2003. Available at: http://ewg.org/reports/toxicteflon/es.php. Accessed March 08, 2008
- ↑ Dupont's Teflon Cover. Environmental Working Group [on line]. Published Mar 22, 2006. Available at: http://environmentalchemistry.com/yogi/environmental/200603tefloncoverup-pg3.html. Accessed March 08, 2008
- ↑ Environnement Canada. Plan d’action pour l’évaluation et la gestion de risque des acides perfluorocarboxyliques (APFC) et de leurs précurseurs [en ligne]. Publié en juin 2006. disponible sur le site http://www.ec.gc.ca/nopp/DOCS/rpt/PFCA/fr/actionPlan.cfm, consulté l5 janvier 2008
- ↑ R. Loos et al, Chemosphere, 71, 2008, 306-313
- ↑ R.Loos et al, Chemosphere, 71, 2008, 306-313, available [on line] at http://www.sciencedirect.com. Accessed March 08, 2008
- ↑ N. Kudo, N. Bandai, Y. Kawashima, Toxicologie Letters, 99, 12 novembre
Voir aussi
Articles connexes
- Teflon
- Éthylène tétrafluoroéthylène (ETFE)
- Perfluorocarbure (PFC)
- Tefal
Liens externes
- (en) Du Pont
- (fr) Action Fluor Québec qui diffuse des informations sur les dangers potentiels du polytétrafluoroéthylène
- Portail de la chimie
Catégories : Composé du fluor | Lubrifiant | Polymère
Wikimedia Foundation. 2010.