- Pile à combustible à membrane échangeuse de protons
-
Pile à combustible à membrane d'échange de protons
 Diagramme d'une PEMFC.
Diagramme d'une PEMFC.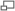
Les piles à combustible à membrane d'échange de protons, connues aussi sous le nom de piles à combustible à membrane électrolyte polymère (ou PEMFC selon l'acronyme des expressions anglaises proton exchange membrane fuel cells ou polymer electrolyte membrane fuel cells) sont un type de piles à combustible développées pour des applications dans les transports aussi bien que pour des applications dans les portables. Leurs caractéristiques propres incluent un fonctionnement des gammes de basses pressions et températures et une membrane électrolyte polymère spécifique.
Sommaire
Fonctionnement
Réactions
Article détaillé : Pile à combustible.Une PEMFC transforme l'énergie chimique libérée durant la réaction électrochimique du dihydrogène (H2) et du dioxygène (O2) en énergie électrique, processus "opposé" à la réaction thermochimique de ces deux corps produisant de l'énergie thermique. Un jet d'hydrogène est dirigé vers le côté anode de l'assemblage de la membrane-électrode (MEA). Il est à cet instant divisé catalytiquement en protons et électrons. Cette réaction d'oxydation dans la demi-cellule est décrite par :
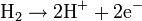
Dans le même temps, un flux d'oxygène est dirigé du côté cathode du MEA. Les molécules de dioxygène réagissent avec les protons traversant la membrane électrolyte polymère et les électrons arrivant par le circuit externe afin de former des molécules d'eau. Cette réaction de réduction dans la demi-cellule électrolytique est :
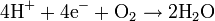
 PEMFC : schéma d'application.
PEMFC : schéma d'application.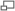
Membrane électrolyte polymère
Afin de fonctionner, la membrane doit conduire les ions hydrogène (protons), mais pas les électrons qui créeraient un court-circuit dans la pile à combustible. La membrane ne doit permettre à aucun gaz de passer de l'autre côté de la cellule, un problème aussi connu sous le nom de gas crossover (croisement de gaz). Enfin, la membrane doit être résistante à l'environnement réducteur à l'anode et, en même temps, à un environnement oxydant à la cathode.
Malheureusement, si la séparation de la molécule d'hydrogène est relativement facile en utilisant comme catalyseur du platine, séparer la molécule d'oxygène plus solide est plus difficile, ce qui cause des pertes électriques significatives. Un matériau de catalyse approprié pour ce processus n'a pas encore été encore découvert, et le platine reste la meilleure option. Une autre source significative de pertes est la résistance de la membrane au flux de protons, qui est minimisé en rendant cette membrane aussi fine que possible (de l'ordre de 50 μm).
La PEMFC est un candidat de premier plan pour les véhicules et d'autres applications mobiles de toutes tailles (jusqu'au téléphone mobile) en raison de sa compacité. Cependant, la gestion de l'eau est cruciale pour les performances : trop d'eau noiera la membrane, trop peu l'assèchera; dans les deux cas, le rendement sera faible. La gestion de l'eau est un sujet très pointu dans les systèmes PEM. De plus, la catalyse par platine sur la membrane est facilement empoisonné par le monoxyde de carbone CO (moins d'un ppm est habituellement accepté) et la membrane est sensible à des choses comme les ions métalliques, qui peuvent être introduits par la corrosion des palettes bipolaires métalliques.
Les systèmes PEM qui utilisent du méthanol (CH3OH) reformé ont été proposés, comme dans le Necar 5 de Daimler Chrysler; le reformage du méthanol - c'est-à-dire le faire réagir pour obtenir de l'hydrogène - est cependant un processus très complexe, qui nécessite aussi une élimination du monoxyde de carbone produit par la réaction. Un catalyseur platine-ruthénium est nécessaire car du monoxyde de carbone va inévitablement atteindre la membrane. Le niveau atteint ne doit pas excéder les 10 ppm. On notera de plus que les temps nécessaires de démarrage de ces réacteurs de reformation sont de l'ordre d'une demi-heure. Cependant, et de manière alternative, le méthanol et autres biocarburants peuvent alimenter la PEMFC sans être reformés, ce qui en fait une DMFC. Ces procédés fonctionnent avec un succès limité.
Le type de membrane le plus couramment utilisé est le nafion ® de DuPont ®, qui est basé sur une humidification de la membrane par de l'eau liquide pour le transport des protons. Cela implique une température de fonctionnement en deça de 80 - 90 ˚C sous peine de voir la membrane sécher. D'autres types de membranes plus récents, basés sur le polybenzimidazole (PBI) ou l'acide phosphorique, peuvent atteindre 220 ˚C sans nécessiter de gestion d'eau : les hautes températures permettent de meilleurs efficacités et densités énergétiques, facilitent le refroidissement (en raison des marges de températures plus importantes), réduisent la sensibilité à l'empoisennemt au CO et accroissent le contrôle sur le processus (absence de gestion d'eau pour la membrane). Cependant, ces nouveaux types ne sont pas courants et la plupart des laboratoires de recherche utilisent le nafion, ce qui se retrouve dans leurs publications scientifiques. Parmi les entreprises produisant des membranes PBI on retrouve Celanese et PEMEAS, et il existe actuellement un projet de recherche européen travaillant sur ces membranes.
Le rendement des PEM est de l'ordre de 40 à 50 %.
Historique
Avant l'invention des PEMFC, les types de piles à combustible existants comme les piles à combustible à oxyde solide étaient seulement employés dans des conditions extrêmes. De telles piles nécessitaient de plus des matériaux très coûteux et ne pouvaient être utilisées que pour des applications statiques en raison de leur taille. Ces questions se posaient aussi pour les PEMFC. Les PEMFC furent inventées au début des années 1960 par Willard Thomas Grubb et Lee Niedrach de General Electric (voir [1] en (en)). Des membranes en polystyrène sulfonaté furent initialement utilisés pour les électrolytes, mais elles furent remplacées en 1966 par l'ionomère nafion, supérieur en performance et durabilité.
Les PEMFC furent utilisées pour les engins spatiaux du programme Gemini de la NASA, mais elles furent remplacées par des piles à combustible alcalines lors du programme Apollo et dans la navette spatiale. En parallèle avec Pratt & Whitney, General Electric développa la première pile à combustible à membrane échangeuse de protons pour les missions spatiales Gemini au début des années 1960. La première mission à utiliser les PEMFC fut Gemini V. Cependant, les missions spatiales Apollo et leurs "héritiers" Apollo-Soyouz, Skylab et la navette spatiale ont employé des piles à combustible basées sur les plans de Bacon, développés par Pratt & Whitney.
Des matériaux extrêmement coûteux furent utilisés, et les piles à combustible requéraient de l'hydrogène et de l'oxygène très purs. Les premières piles tendaient aussi à fonctionner sous hautes températures, constituant ainsi un problème pour de nombreuses applications. Cependant, les piles à combustible étaient perçues comme intéressantes en raison des larges quantités de combustibles disponibles (H2, O2).
Malgré leurs succès dans les programmes spatiaux, les systèmes à piles à combustible étaient limités aux missions spatiales et autres applications spécifiques pour lesquels des coûts élevés pouvaient être tolérés. Ce ne fut qu'à la fin des années 1980 et du début des années 1990 que les piles à combustible devinrent une option réelle pour des applications de bases plus larges. De nombreuses innovations intéressantes, comme une baisse du besoin en platine comme catalyseur ou des électrodes en couches minces, conduirent à diminuer les coûts, rendant plus ou moins réaliste le développement des systèmes PEMFC. Cependant, il existe un débat important sur l'intérêt de l'hydrogène comme combustible pour les véhicules depuis quelques décennies (on pourra voir à ce propos The Hype about Hydrogen par Joseph J. Romm, publié en 2004).
Marché des PEMFC
On pourra citer comme frabricants :
- ReliOn, Inc.
- Ballard Power Systems
- UTC Power (connu aussi comme UTC Fuel Cells)
- PEMEAS USA
- E-TEK Inc
- Dupont
- 3M
- Johnson Matthey
- WL Gore
- Hydrogenics
- Plug Power
- Atlantic Fuel Cell.
- NuVant Systems Inc.
- IdaTech
- AREVA : HELION hydrogen power.
Liens externes
- (en) Collecting the History of Proton Exchange Membrane Fuel Cells
- (en) chembytes e-zine 2000 - Powering ahead
- (en) ReliOn, Inc. - About PEM Fuel Cells
- (en) Cet article est partiellement ou en totalité issu d’une traduction de l’article de Wikipédia en anglais intitulé « Proton exchange membrane fuel cell ».
- Portail de la chimie
Catégorie : Pile à combustible
Wikimedia Foundation. 2010.
