- Méthode De Charpentier - Volhard
-
Méthode de Charpentier - Volhard
La méthode de Charpentier - Volhard permet de doser les ions chlorures par un dosage en retour.
Sommaire
Principe
tous les dosages s'effectuent en milieu acide nitrique afin d'éviter la formation d'hydroxyde métallique
Première étape : précipitation des chlorures
En présence d 'un excès de solution aqueuse de nitrate d'argent (
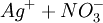 ), il se forme un précipité blanc de chlorure d'argent (AgCl) selon :
), il se forme un précipité blanc de chlorure d'argent (AgCl) selon :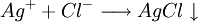
Deuxième étape : dosage de l'excès d'ions argent
L'excès d'ions argent est dosé par une solution titrée de thiocyanate de potassium (K + + SCN − ) en formant un précipité de thiocyanate d'argent (AgSCN)de couleur blanche selon :
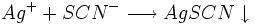
Fin du dosage
La fin du dosage est visualisé par l'utilisation d'un indicateur coloré: l'alun de fer ammoniacal 3 . À l'équivalence Ag + / SCN − , la formation du complexe avec l'alun de fer et d'ammonium (NH4Fe(SO4)2,12H2O) et le thiocyanate est donnée par l'équation suivante :
![SCN^- +Fe^{3+} \longrightarrow [Fe(SCN)]^{2+}](/pictures/frwiki/57/90b6e183b6bf2117255632a3ebb88586.png)
La solution prend alors une couleur rouge-orangée due à la complexation des ions Fe3 + avec les ions SCN − pour donner [Fe(SCN)]2 + . Cette couleur est visible que lorsque la concentration du complexe [Fe(SCN)]2 + = 10 − 5mol.L − 1 (c'est à dire lorsqu'il n'y a plus d'ions argent à complexer par le thiocyanate)
Protocole
Dosage des chlorures d'un lait
Décantation
Lors du dosage, les constituants des produits peuvent capturer des ions Ag + et ainsi fausser le dosage, donc il faut les éliminer par la décantation.
Dans une fiole jaugée de 200 ml, introduire :
- 20 mL de lait à analyser
- 2 ml d'acétate de zinc, goutte à goutte
- agiter et compléter a 200ml.
- Bien homogénéiser et laisser décanter 10 minutes environ : la décantation doit être nette, sinon recommencer
- filtrer la solution, le filtrat doit être limpide
Dosage du thiocyanate de potassium
Dans un becher:
- Introduire 50 mL d'eau distillée
- 1 mL d'acide nitrique ( HNO3\,)
- 2 mL d'alun de fer et d'ammonium
- 5 mL de nitrate d'argent prélevé a la pipette
- Titrer avec la solution de thiocyanate et faire deux essais
Dosage de l'essai
Dans un becher :
- Ajouter 50 ml de filtrat avec une pipette jaugé
- Ajouter 1 ml d'acide nitrique concentré
- Ajouter 2 ml d'alun de fer et d'ammonium
- Ajouter 5 ml de nitrate d'argent a la pipette jaugé et agiter
Titrer l'exces de nitrate d'argent par la solution de thiocyanate de potassium jusqu'à apparition d'une couleur orangé ou complexe chamois (couleur marron clair/orange)
Dosage des chlorures d'un produit a base de viande
Décantation
Dans un erlen :
- Peser une masse de 10 g exactement mesurée
- Ajouter 100 mL d'éthanol a 70°GL ( dissolution de la matière grasse ) et boucher l'erlen
- Chauffer pendant 15 minutes au bain marie bouillant en remuant de temps en temps
- laisser refroidir a température ambiante
- Ajouter 2 mL de ferrocyanure de potassium
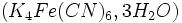
- Agiter
- Ajouter 2 mL d'acétate de zinc
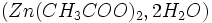
- Agiter
- Laisser reposer 30 minutes a température ambiante
- Transvaser quantitativement dans une fiole de 200ml et ajouter de l'eau distillée jusqu'au trait de jauge
- Bien mélanger et filtrer,reprendre le protocole au point 2.1.2
Calculs
il s'agit d'un dosage en retour : lors de la chute de burette le reste des ions Ag + réagissent avec les ions SCN − versée.une partie des ions Ag + ont précipité avec les ions Cl − avant le début de la chute de burette
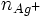 totale
totale 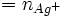 qui a réagi avec les Cl − +
qui a réagi avec les Cl − + 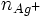 qui a réagit avec les
qui a réagit avec les 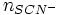
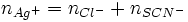
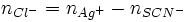
![[Cl^-] = \frac{ (C_{AgNO_{3}} \times V_{AgNO_{3}}) - (C_{KSCN} \times V_{KSCN}) }{V_{Echantillon}} \times dilutions](/pictures/frwiki/97/a184c49853b2e27395469590cdf69f53.png)
![m_{NaCl} = [Cl^-]\times V_{Echantillon} \times M_{NaCl} \,](/pictures/frwiki/55/703bc96e72638296afd1a4edb76e0725.png)
Intérêts du dosage
Dans le lait
La concentration des chlorures du lait est généralement de l'ordre de 1,6 à 1,8 g/L. Si le taux est plus faible, cela indique une dilution du lait.
Dans des produits à base de viande
Un trop fort taux de chlorures dans les produits carnés indique une fraude probable. Le sel augmente le pouvoir de rétention en eau des protéines et donc un gain de poids dû à l'eau. La concentration en sel dans une préparation à base de viande est en général de l'ordre de 4%.
- Portail de la chimie
Catégories : Technique de laboratoire | Méthode de la biochimie | Chimie analytique
Wikimedia Foundation. 2010.

