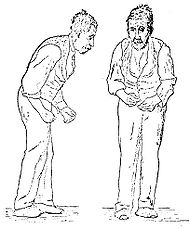
- Maladie de Parkinson
-
 Pour les articles homonymes, voir Parkinson.
Pour les articles homonymes, voir Parkinson.Maladie de Parkinson
Classification et ressources externesIllustration de la maladie de Parkinson par William Richard Gowers. CIM-10 G20, F02.3 CIM-9 332 OMIM 168600 DiseasesDB 9651 MedlinePlus 000755 eMedicine neuro/304 GeneReviews Parkinson Disease Overview La maladie de Parkinson est une maladie neurologique chronique dégénérative affectant le système nerveux central responsable de troubles essentiellement moteurs d'évolution progressive.
Ses causes sont mal connues. Le tableau clinique est la conséquence de la perte de neurones du locus niger (ou « substance noire ») et d'une atteinte des faisceaux nigro-striés. La maladie débute habituellement entre 45 et 70 ans. C'est la deuxième maladie neuro-dégénérative, après la maladie d'Alzheimer. La maladie de Parkinson se distingue des syndromes parkinsoniens qui sont généralement d'origines diverses, plus sévères et répondent peu au traitement.
Historique
Article détaillé : Histoire de la maladie de Parkinson. Une photographie de 1893 de Jean-Martin Charcot, qui fit d'importantes contributions dans la compréhension de la maladie et proposa de lui donner son nom actuel en l'honneur de James Parkinson.
Une photographie de 1893 de Jean-Martin Charcot, qui fit d'importantes contributions dans la compréhension de la maladie et proposa de lui donner son nom actuel en l'honneur de James Parkinson.
Plusieurs sources anciennes, incluant un papyrus de l'ancienne Égypte, un traité de médecine ayurvédique, la Bible ou des écrits de Galien, décrivent des symptômes ressemblant à ceux retrouvés dans la Maladie de Parkinson[1].
Après Galien (IIe siècle) on ne retrouve pas de descriptions décrivant un tableau de Parkinson jusqu'au XVIIe siècle[1]. Aux XVIIe et XVIIIe siècles, plusieurs auteurs écrivent sur le sujet, notamment Sylvius, Gaubius, Hunter et Chomel[1],[2],[3].
En 1817 un médecin anglais, James Parkinson, publie une description claire et détaillée de six patients présentant les symptômes de la maladie qui porte maintenant son nom, et qu'il dénomme alors paralysis agitans[4]. An Essay on the Shaking Palsy décrit le tremblement de repos caractéristique, la posture et la démarche anormales, la paralysie et la diminution de la force musculaire, ainsi que l'évolution de la maladie au fil du temps[4],[5]. Les premiers neurologues à avoir étudié la maladie sont Armand Trousseau, Gowers, Kinnier Wilson et Wilhelm Erb. Et particulièrement Jean-Martin Charcot, dont les études effectuées entre 1868 et 1881 constituent une étape majeure dans la compréhension de la maladie[4]. Il fit entre autres la distinction entre la rigidité, la faiblesse et la bradykinésie et défendit le renommage de la maladie en l'honneur de James Parkinson[4]
En 1912 Frederic Lewy décrit les particules microscopiques présentes dans les cerveaux atteints, plus tard appelées « corps de Lewy[4] ». En 1919 Konstantin Tretiakoff rapporte que la substantia nigra est la principale structure cérébrale touchée, fait qui ne sera reconnu que tardivement, après d'autres études publiées par Rolf Hassler en 1938[4]. Les modifications biochimiques au niveau cérébral furent identifiées dans les années 1950, surtout grâce aux travaux de Arvid Carlsson sur la dopamine, un neurotransmetteur sécrétée par le locus niger et dont la diminution joue une rôle majeur dans la maladie de Parkinson[6]. La démonstration d'une diminution cérébrale en dopamine dans la maladie de Parkinson a été publié en 1960 par Ehringer et Hornykiewicz [7]. En 1997, on découvre que l'alpha- synucléine est le composant principal des corps de Lewy[8].
Les anticholinergiques et la chirurgie (par lésion du faisceau pyramidal ou des ganglions de la base) étaient les seuls traitements disponibles jusqu'à l'arrivée de la levodopa, qui réduisit considérablement leur utilisation[2],[9]. La Levodopa fut synthétisée pour la première fois en 1911 par Casimir Funk, mais on s'y intéressa peu jusqu'à la moitié du XXe siècle[6]. Elle entra dans la pratique clinique en 1967 et apporta une véritable révolution dans la prise en charge thérapeutique de la maladie de Parkinson[6],[10]. A la fin des années 1980, la stimulation cérébrale profonde devint un nouveau traitement possible[11].
Épidémiologie
La maladie de Parkinson est la seconde maladie neurodégénérative la plus fréquente après la maladie d'Alzheimer[12].
Sa prévalence (proportion dans une population à un instant donné) dans les pays occidentaux est d'environ 0.3% dans la population générale. Elle augmente avec l’âge, atteignant 1% chez les plus de 60 ans, et jusqu'à 4% chez les plus de 80 ans[12]. Cependant, les études épidémiologiques dans cette tranche d'âge ne distinguent pas la maladie de Parkinson des syndromes parkinsoniens. L'âge moyen d'apparition de la maladie est d'environ 60 ans, même si 5 à 10% des cas, classés comme précoces, commencent entre 20 et 50 ans[13]. La maladie de Parkinson pourrait être moins fréquente chez les personnes d'ascendance africaine et asiatique, ce qui reste contesté[12]. Les hommes seraient plus souvent atteints que les femmes mais les études ne sont pas unanimes sur ce point[14].
L'incidence de la maladie de Parkinson est comprise entre 8 et 18 pour 100 000 années-personnes[12] (nombre de nouveaux cas pour 100.000 personnes par an).
De nombreux facteurs de risques ou facteurs protecteurs ont été proposés, cependant aucun lien entre un facteur et la maladie n'a jamais pu être démontré de façon rigoureuse. Les études épidémiologiques menées afin de tester la relation entre un facteur donné et la maladie ont souvent été défaillantes et contradictoires[12]. On avance souvent un risque accru chez les personnes exposées aux pesticides, et un risque réduit chez les fumeurs[12].
C'est une cause importante de handicap moteur chez les sujets âgés avec les accidents vasculaires cérébraux[15].
Facteurs de risque
Les facteurs environnementaux de type exposition aux métaux lourds et aux pesticides ont été privilégiés dans les années 1970. Néanmoins ces études sont actuellement remises en cause et la maladie est perçue comme sporadique sauf pour une proportion minoritaire[16].
La maladie de Parkinson était considéré comme une maladie non génétique ; néanmoins 15% des personnes avec la maladie de Parkinson ont un proche atteint[13] Au moins 5% des malades sont reconnues comme ayant une forme de la maladie liée à une mutation de gènes spécifiques[17].
 Un hélicoptère de l'armée américaine déversant de l'agent Orange sur les terres cultivables vietnamiennes lors de la guerre du Vietnam. L'exposition à l'agent Orange a été associé avec un risque accru de développer une MP.
Un hélicoptère de l'armée américaine déversant de l'agent Orange sur les terres cultivables vietnamiennes lors de la guerre du Vietnam. L'exposition à l'agent Orange a été associé avec un risque accru de développer une MP.
La MPTP est une neurotoxine de synthèse utilisée pour étudier la maladie chez le singe. Elle provoque les symptômes permanents de la maladie de Parkinson en détruisant certains neurones dopaminergiques dans la substantia nigra du cerveau. Ce mode d'action a permis l'émergence de théories considérant que l'exposition à certaines toxines environnementales pourraient augmenter le risque de survenue d'une MP[12].
Ainsi le risque pourrait doubler en cas d'exposition à certains pesticides, tels que la roténone ou le paraquat, et herbicides, tel que l'agent Orange[12],[18],[19].
Une étude sur l'agent Orange a retrouvé que certains facteurs d'exposition indirecte aux pesticides, par exemple la vie en milieu rural, augmentaient également le risque[19].
Un risque lié à l'exposition aux métaux lourds, qui s'accumuleraient dans la substantia nigra, a été suspecté, mais les études n'ont pas été concluantes[12].
Facteurs protecteurs
Le tabagisme entrainerait une réduction du risque de développer une maladie de Parkinson[20]. Ainsi le risque des fumeurs pourrait être réduit d'un tiers par rapport aux non-fumeurs[12]. Le mécanisme de cette protection reste inconnu, mais pourrait être du à l'effet stimulant de la nicotine sur la dopamine[12]. La fumée du tabac contient des composés qui agissent comme inhibiteurs de la monoamine oxydase et qui pourraient également contribuer à cet effet[21].
De même, la consommation de café, et notamment de caféine, pourrait avoir un rôle protecteur[22],[23].
Certains ont avancé que les antioxydants, comme la vitamine C et D, pourraient protéger de la maladie, mais les résultats des études ont été contradictoires et aucun effet positif n'a finalement été démontré[12].
De même les études sur l'éventuel effet protecteur des matières grasses et des acides gras se sont avérées peu concluantes[12].
Un possible rôle protecteur des œstrogènes et des anti-inflammatoires non-stéroïdiens a été suspecté mais reste à être démontré[12].
Physiopathologie
Le dérèglement du système dopaminergique est une caractéristique importante de cette maladie. Il existe dans certaines structures du cerveau un déficit de dopamine (un neurotransmetteur, molécule servant de messager chimique entre deux neurones, synthétisée dans une terminaison axonale ; le neurotransmetteur est libéré dans la fente synaptique en réponse à un influx nerveux). Les altérations cérébrales ne se limitent pas seulement à la sphère dopaminergique et de nombreux systèmes de neurotransmetteurs (sérotoninergiques, cholinergiques, glutamatergiques, adénosinergiques ou encore adrénergiques) sont également atteints.
Il y a eu de très nombreux progrès dans la physiopathologie de la maladie à la suite de la découverte de nombreux gènes impliqués dans des formes rares de la maladie[réf. souhaitée].
Les processus biologiques suspectés d'entraîner la perte neuronale sont variés : dysfonctionnement mitochondrial, apoptose, accumulation de protéines toxiques pour les neurones, stress oxydatif (le mécanisme de réparation de l'ADN est dégradé quand les neurones subissent un stress ; l'hyperactivation inappropriée de la protéine Cdk5 normalement présente dans les neurones, supprime l'enzyme APE1 nécessaire à la réparation de l'ADN, ce qui peut conduire à la destruction de neurones). On a récemment montré que la voie Cdk5-APE1 était perturbée chez des patients victimes de la maladie de Parkinson ou d'Alzheimer[24],[25],[26],[27] ...
Évolution
 Séquence d'événements cellulaires menant à la formation de corps de Lewy. La colonne centrale décrit le processus d'agrégation de l'aplha-synucléine. La colonne de gauche décrit les mécanismes biochimiques présidant au mécanisme. La colonne de droite inventorie les diverses organelles et cibles cellulaires possibles de l'alpha-synucléine lorsqu'elle s'accumule sous forme de fibrilles. Source : Cookson MR, « alpha-Synuclein and neuronal cell death », dans Mol Neurodegener, vol. 4, 2009[28].
Séquence d'événements cellulaires menant à la formation de corps de Lewy. La colonne centrale décrit le processus d'agrégation de l'aplha-synucléine. La colonne de gauche décrit les mécanismes biochimiques présidant au mécanisme. La colonne de droite inventorie les diverses organelles et cibles cellulaires possibles de l'alpha-synucléine lorsqu'elle s'accumule sous forme de fibrilles. Source : Cookson MR, « alpha-Synuclein and neuronal cell death », dans Mol Neurodegener, vol. 4, 2009[28].
Avec le chamboulement des classifications des maladies neurodégénératives, la maladie de Parkinson est classée depuis 1998, comme certaines maladies dégénératives plus rares, dans le groupe des (alpha-)synucléinopathies : dans ces pathologies, la protéine alpha-synucléine s'accumule et « empoisonne » les cellules. Il s'agit du principal composant des corps de Lewy, les indicateurs pathophysiologiques de la MP et du second composant en importance dans les plaques séniles distinctives de la maladie d'Alzheimer[29].
Les symptômes moteurs n'apparaissent que lorsque 70 % des neurones de la substance noire ont été détruits[30]. Les tubercules olfactifs et le locus cœruleus sont affectés précocement, ce qui entraîne des troubles de l'olfaction et du sommeil (agitation nocturne et cauchemars) initiaux[31],[32].
- Les troubles du sommeil paradoxal entraînant des mouvements violents et, dans certains cas, des blessures chez le conjoint, apparaissent en moyenne 13 ans avant les premiers symptômes moteurs.
- L'anosmie (déficit d'olfaction) étant présente, selon certaines études, chez 100 % des patients atteints de MP, son apparition, fréquemment considérée comme un aspect normal du vieillissement, pourrait être un symptôme avant-coureur plus alarmant. Selon une étude hollandaise, l'anosmie prédirait 5 ans à l'avance la maladie dans 12,5 % des cas — une performance cependant trop modeste pour appliquer le test d'anosmie isolément à toute la population[33].
- La fatigue, un autre symptôme omniprésent chez les parkinsoniens, pourrait découler d'un processus ayant pour origine une dégénérescence de l'innervation du cœur. La présence de corps de Lewy dans cet organe et dans les nerfs sympathiques qui l'excitent, chez des patients atteints de MP, appuient cette hypothèse. Les nerfs du cœur pourraient bien être atteints avant le système sympathique.
- La constipation, un symptôme encore non élucidé observé par James Parkinson, pourrait résulter d'une dégénérescence semblable, puisque des corps de Lewy tapissent diverses régions du tube digestif chez plusieurs, sinon tous les parkinsoniens. Une vaste étude prospective a montré que les personnes souffrant de constipation à l'âge adulte étaient plus de quatre fois plus à risque que les autres d'être atteintes de MP plus tard. Les corps de Lewy dans le tube digestif et la constipation qui en résulte, selon l'hypothèse, pourraient être les premiers signes avant-coureurs de maladie, puisqu'ils apparaîtraient plus de 15 ans avant le diagnostic[32].
- Une personnalité parkinsonienne a été décrite : elle serait caractérisée par une forme de rigidité psychologique qui annoncerait la rigidité motrice, un souci de contrôle et un perfectionnisme qui correspondent, en outre, à la description de l'état hypodopaminergique, qui est caractérisé principalement par un déficit dans la recherche de nouveauté (novelty seeking)[34].
Ultérieurement, des structures impliquées dans la régulation motrice (substance noire) situées dans la partie haute du tronc cérébral vont être atteintes et entraîner les signes moteurs caractéristiques de la maladie.
Enfin, après plusieurs décennies d'évolution, des structures corticales peuvent être touchées.
Causes
Les causes de cette maladie ne sont pas encore déterminées. Elle pourrait être la conséquence de l'interaction entre une prédisposition génétique (surtout chez des sujets de moins de 50 ans[35]) et des co-facteurs environnementaux. On suspecte depuis de nombreuses années des toxiques environnementaux, métaux lourds et pesticides notamment, mais sans preuves d'une cause unique. On a récemment aussi suspecté puis confirmé que la bactérie Helicobacter pylori pouvait contribuer à la survenue de la maladie de Parkinson[36].
- L'exposition aux pesticides ; elle augmenterait le risque de près de 70 % : 5 % des personnes exposées aux pesticides risqueraient de développer la maladie contre 3 % pour la population générale[37]. Cette maladie est effectivement plus fréquente en milieu rural qu'urbain. Un modèle animal confirme la responsabilité d'un pesticide dans la constitution d'un syndrome parkinsonien[38]. Les organochlorés seraient les premiers responsables (risque jusqu'à 2,4 fois plus élevé que la normale). Le risque est multiplié par trois si certains pesticides sont associés[39]. En France, la Sécurité sociale a reconnu en 2006 un cas de maladie de Parkinson comme maladie professionnelle pour un ancien salarié agricole[40].
- Un traumatisme crânien pourrait être facteur de risque. En effet, on en trouve fréquemment dans les antécédents des parkinsoniens[41].
- Le métier ? En France, cette pathologie ne figure pas dans le tableau des maladies professionnelles, malgré quelques exceptions[42].
En réaction, la Fédération CFE-CGC de la Chimie a souhaité, en septembre 2006, vouloir attirer « l'attention des employeurs sur les attitudes préventives à faire adopter aux salariés en cas de manipulation des pesticides », car les protections individuelles complètes (bottes, gants, masque et combinaison) sont encore trop rarement utilisées.
- Causes génétiques : Plusieurs gènes actifs ont été identifiés dans des familles de parkinsoniens
- Des mutations du gène LRRK-2 (leucine-rich repeat kinase 2) : la découverte récente du gène LRRK2 qui code la dardarine, a révolutionné la génétique de la maladie de Parkinson puisqu’une seule mutation, G2019S, explique à elle seule une proportion importante des formes autosomiques dominantes de la maladie de Parkinson et aussi, de façon très intéressante, des formes communes idiopathiques, dans certains sous-groupes de patients parkinsoniens. La fréquence de la mutation G2019S varie considérablement selon l’origine géographique et ethnique des populations étudiées. Très rare en Asie (<0,1%) et en Afrique sub-saharienne, elle peut atteindre 40% en Afrique du Nord dans les formes familiales et sporadiques de la maladie de Parkinson. La mutation G2019S joue aussi un rôle important chez les patients d’origine juive ashkénaze et sépharade (10-15% des cas isolés) et dans une moindre mesure chez les patients originaires de la péninsule ibérique (3-6% des cas isolés). Elle est très rare en Europe du Nord. La plupart des patients d'Afrique du Nord, Juifs et Européens partagent le même haplotype indiquant l’existence d’un effet fondateur unique[43],[44].
- L'atteinte d'autres gènes a été décrite mais est sensiblement plus rare (c'est le cas, en particulier, de la maladie de Gaucher).
- Le gène Pyridoxal kinase est anormalement activé chez les malades[45],[46] ; une mutation de ce gène modifierait la quantité ou l'activité des enzymes Pyridoxal kinase (PDXK) qui transforme la vitamine B6 en sa forme active indispensable à production de dopamine. Or, un vieillissement prématuré puis la mort des cellules produisant la dopamine est toujours associé à la maladie de Parkinson. Dans ce cas des thérapies individualisées sont à l'avenir espérées ;
- Synergies entre facteurs génétiques et environnementaux, dont habitudes alimentaires ; la vitamine B6 semblant notamment jouer un rôle important (facteur de risque, facteur d'efficacité du traitement)[43].'
Diagnostic
Le diagnostic doit être évoqué devant la constatation de symptômes bien particuliers :
- Hypertonie musculaire extrapyramidale que l'on appelle « plastique » par opposition à l'hypertonie spastique, c’est-à-dire qu'on a la sensation de « tuyau de plomb » lors de la mobilisation passive du membre. Cette rigidité peut céder par à-coups (aspect de roue dentée). L'attitude générale est en flexion (Cyphose dorsale, membres semi-fléchis) et donne un aspect penché en avant. Elle est augmentée par la manœuvre de Froment, persiste en décubitus (signe de l'oreiller).
- Tremblement de repos des extrémités notamment du pouce : le patient semble compter sa monnaie, ou rouler de la mie de pain. Il est lent et régulier, pouvant plus rarement persister dans l'attitude. Classiquement, il disparait lors des mouvements volontaires et du sommeil, est augmenté par les efforts de concentration tels que le calcul mental, et respecte le cou et le chef mais peut toucher le menton.
- Akinésie : elle consiste en une rareté et une lenteur des mouvements (bradykynésie). Elle se manifeste aussi par une perturbation de la mimique et des mouvements automatiques comme ceux de la marche. C'est le signe le plus important de la maladie. Le patient a un visage impassible, la bouche entrouverte, clignant rarement des yeux. La marche est lente à petits pas, parfois entrecoupée d'arrêts avec piétinement. Elle est parfois rapide (festination), le malade penché en avant paraissant courir après son centre de gravité. Il y a toujours perte du ballant des bras. Les mouvements alternatifs rapides des membres (épreuve des marionnettes) sont mal réalisés.
Le diagnostic est parfois difficile, les symptômes pouvant donner l'aspect d'une dépression ou avoir une allure rhumatismale.
D'autres symptômes peuvent être rencontrés plus ou moins tardivement : dépression, chutes, hypersalivation, réflexe oculo-palpébral inépuisable, une micrographie (la calligraphie diminue en amplitude), une dysarthrie (troubles de la parole), troubles de la déglutition, troubles du comportement en sommeil paradoxal, hypotension orthostatique, troubles urinaires... L'altération de l'odorat est l'un des premiers signes même si elle est difficile à évaluer[47]. Des troubles cognitifs voire une démence peuvent survenir chez le patient âgé.
Le diagnostic de maladie de Parkinson est habituellement clinique. Il repose sur la mise en évidence d'une akinésie associée à un autre symptôme (rigidité, tremblement de repos, ou trouble postural). Il existe un certain nombre d'affections neurologiques avec des symptômes semblables mais qui souvent répondent peu au traitement. Ces affections sont regroupées sous le terme de syndromes parkinsoniens (paralysie supranucléaire progressive, atrophie multisystématisée, etc.). En théorie, la certitude du diagnostic n'est obtenue que par l'étude histologique du cerveau mais les critères diagnostiques actuellement définis permettent de faire le diagnostic sans trop de difficultés. Dans certains cas, on peut avoir recours à la réalisation d'une scintigraphie cérébrale (DATscan) qui permet de montrer l'atteinte du striatum. Le scanner cérébral et l'imagerie par résonance magnétique sont normaux mais permettent d'éliminer d'autres maladies pouvant avoir des signes proches.
Sous l'influence des traitements, les symptômes vont se modifier. On voit apparaitre des mouvements anormaux (dyskinésies) pouvant être parfois très impressionnants. Ce sont des mouvements parasites très variés des mouvements volontaires (ouverture-fermeture des yeux, grimace, mouvements de langue, de rotation de la tête, d'ascension d'une épaule, d'enroulement du bras ou de la jambe...)
Diagnostic différentiel
Autres syndromes
- Syndrome parkinsonien postneuroleptiques (butyrophénones, phénothiazines) mais aussi neuroleptiques atypiques et neuroleptiques cachés (ex: Primpéran : Métoclopramide). Il a également été décrit après l'emploi de certaines herbes (dont le kava[48]).
- Maladie à corps de Lewy : syndrome parkinsonien débutant chez le sujet âgé rapidement associé à des troubles cognitifs, des troubles attentionnels, du sommeil et des hallucinations visuelles.
- Manganisme : intoxication chronique au manganèse par inhalation dans certaines professions (soudeurs, etc) ou ingestion (teneur de manganèse trop importante de l'eau) pouvant provoquer un syndrome parkinsonien[49].
et exceptionnellement :
- Maladie de Wilson : Diagnostic à évoquer chez un sujet jeune avec des antécédents familiaux.
- Paralysie supranucléaire progressive (P.S.P.) ou maladie de Steele-Richardson-Olszewski.
- Atrophie multi-systématisée : signes extrapyramidaux associés plus ou moins à des signes pyramidaux, dysautonomiques (hypotension orthostatique, impuissance) ou cérébelleux (troubles de l'équilibre).
- Dégénérescence cortico-basale : affection rare se traduisant par une apraxie, des signes extrapyramidaux unilatéraux.
- Rares intoxications : MPTP (toxicomanie), pesticides...
- Parkinson vasculaire : accidents vasculaires touchant les noyaux gris centraux. La distinction entre un syndrome parkinsonien d'origine vasculaire et une maladie de Parkinson peur être difficile ; on peut s'aider de tests olfactifs qui montre de meilleures réponses lorsque la cause est vasculaire[50].
- Hydrocéphalie à pression normale.
Tremblements non parkinsoniens
Il existe plus d'une vingtaine d'autres causes de tremblements, notamment la plus fréquente, le tremblement essentiel, qui est un tremblement lors des mouvements (ou dans le maintien d'attitude : tremblement postural), et non de repos, comme le tremblement parkinsonien. Seul un diagnostic posé par un neurologue permet de confirmer l'existence d'une pathologie précise.
Traitements
 Michael J. Fox, atteint de la maladie, recevant un doctorat honoris causa de l'Université de New York pour sa contribution à la recherche (2008).
Michael J. Fox, atteint de la maladie, recevant un doctorat honoris causa de l'Université de New York pour sa contribution à la recherche (2008).
Médicaments
Actuellement, aucun médicament n'a démontré d'efficacité sur la progression de la maladie : il n'existe pas de traitement curatif de la maladie. Les traitements médicamenteux restent donc aujourd'hui encore purement symptomatiques (agissant sur les symptômes). Les symptômes sont rangés en deux catégories : moteurs et non-moteurs[51].
Symptômes moteurs
La DOPA
La L-DOPA est le traitement le plus utilisé car le plus actif. Ce médicament va être transformé en dopamine et utilisé par l’organisme. La transformation se passe dans le système nerveux central mais aussi dans tout l’organisme par la DOPA décarboxylase au niveau sanguin. Pour cette raison, ce traitement est couplé à un inhibiteur de la décarboxylase périphérique ou de la catéchol-O-méthyl transférase (COMT) qui permet de diminuer la transformation périphérique et ainsi de diminuer les effets secondaires tout en multipliant par 10 la disponibilité au niveau du système nerveux central. Les effets secondaires comme des nausées ou des vomissements sont devenus rares lorsque l'on augmente les doses progressivement.
La L-DOPA a une demi vie (temps au bout duquel la molécule est à moitié éliminée de l'organisme) comprise entre 1h30 et 3h. Les prises du médicament seront donc répétées et régulières tout au long de la journée afin de maintenir un taux sanguin stable, et donc un effet clinique permanent. L'effet des médicaments va se modifier au cours du temps en raison d'une augmentation de la sensibilité des récepteurs cérébraux à la L-DOPA et de la diminution de la durée d'action de chaque prise de médicaments. Ces deux particularités vont respectivement entraîner des fluctuations d'effet et des dyskinésies (mouvements involontaires). Les fluctuations motrices peuvent être précoces. Le malade présente des états de blocage au cours de la journée imposant des modifications d'horaires et l'utilisation de formes à libération prolongée. Les dyskinésies surviennent le plus souvent au moment où les taux de L-DOPA sont le plus importants dans le sang. Elles peuvent être retardées par la prise d'agonistes dopaminergiques. Lorsque celles-ci surviennent, il est recommandé de diminuer la dose de la prise unitaire de L-DOPA.
Diminution des effets secondaires
Les effets secondaires de la DOPA sont dus en bonne partie à son effet sur d'autres neurotransmetteurs et sur le métabolisme et le transport d'autres acides aminés. Il était donc souhaitable de veiller à ce que tyrosine, tryptophane, 5-hydroxytryptophane, sérotonine, cystéine, cystine et méthionine soient à des concentrations optimales, d'autant plus que la maladie de Parkinson diminue également les concentrations de sérotonine et de noradrénaline. En 2011, une étude sur 254 patients atteints de la maladie à divers degrés (certains avaient épuisé toutes les options couramment utilisées) a confirmé que les parkinsoniens avaient effectivement un besoin accru de plusieurs de ces molécules et que leur administration diminuait ou supprimait totalement les effets secondaires de la DOPA tout en préservant ses effets thérapeutiques, si bien qu'il a été possible de hausser librement la dose de DOPA pour atteindre les meilleurs résultats possibles. Ce protocole, baptisé OCT, est centré sur l'importante primordiale du transporteur de cations OCT. Les mesures de sérotonine et de dopamine urinaires permettent d'assurer un suivi rapproché de l'efficacité et de l'innocuité d'un traitement traditionnel longtemps perçu comme ayant de grands bienfaits contrebalancés par des hauts risques[52].
Les agonistes de la dopamine
La deuxième grande catégorie de traitement médicamenteux est la classe des agonistes dopaminergiques: bromocriptine, cabergoline, pramipexole, ropinirole, pirebidil, lisurdide, apomorphine. Ces substances agissent directement sur les récepteurs post synaptiques de la voie nigro-striée.. Elles sont moins efficaces sur les symptômes moteurs que la L-DOPA. Elles sont néanmoins utilisées en premier intention chez le sujet jeune car elles retardent l'utilisation de la L-DOPA, qui favorise l'apparition de dyskinésies. Ces médicaments peuvent entrainer des effets indésirables à type de nausées, vomissements , oedèmes, hallucinations et troubles du contrôle des pulsions. La dernière classe thérapeutique agit en inhibant la monoamine oxidase, enzyme qui catabolise la dopamine . Les deux molécules utilisées dans ce but sont la sélégiline et la rasagiline. Ceux-ci peuvent remplacer pendant une courte durée la L-dopa au début de la maladie. Ils sont utilisés parfois en première intention surtout chez les patients les plus jeunes afin d'économiser la L-dopa.
Les facteurs neurotrophes
Les facteurs neurotrophes forment une famille disparate de messagers cellulaires ayant pour rôle ou pour effet de stimuler le développement des neurones et leur survie une fois qu'ils sont à maturité. Ils sont également impliqués dans le processus de plasticité cérébrale qui est mis en mouvement suite à une atteinte au cerveau. Parmi ceux-ci, le facteur neurotrophe dérivé de la glie (GDNF) s'avère particulièrement prometteur dans la maladie de Parkinson. Un dispositif d'injection est installé chirurgicalement à la base du cerveau pour que le GDNF soit administré directement dans le putamen. Le facteur neurotrophe est injecté quotidiennement et l'on observe des améliorations variant autour de 40 % sur les échelles de gravité de la maladie (échelle UPDRS). La procédure comporte des dangers d'infections, comme toute intervention nécessitant un port permanent; le port doit alors être enlevé.
La Fondation Michael J. Fox subventionne la recherche sur une voie d'administration moins coûteuse et risquée, la voie intranasale, qui permet d'outrepasser la barrière hématoencéphalique.
Article détaillé : GDNF.Les antioxydants
L'acide urique, mieux connu pour son rôle dans la goutte, est aussi un antioxydant présent chez l'homme et les grands singes dont les concentrations sont inversement proportionelles à la gravité des symptômes dans la maladie de Parkinson[53]. La susceptibilité de la substance noire à l'oxydation est due à sa teneur en fer, qui accélère le taux de production de « rouille » cellulaire. Même la DOPA et la dopamine peuvent devenir toxiques au contact de métaux de transition comme le fer et le cuivre. L'acide urique est particulièrement intéressant dans la MP en raison de sa capacité à lier ces métaux, en plus de ses capacités antioxydantes intrinsèques[53]. L'acide urique et les autres antioxydants peuvent être mesurés dans des laboratoires spécialisés par l'entremise des hôpitaux et des spécialistes prenant en charge le patient[54].
Autres
D'autres traitements médicamenteux existent en particulier pour optimiser l'efficacité de la L-DOPA: tolcapone peut être proposée[55], entacapone.
L'importance de l'effet placebo est à noter dans cette maladie, avec une amélioration de près de 15 % des cas[56].
Le traitement de la maladie de Parkinson a fait l'objet d'une conférence de consensus française dont les conclusions ont été reprises dans les recommandations de la Haute Autorité de Santé[57].
Symptômes non-moteurs
Les symptômes non-moteurs peuvent apparaître avant les symptômes moteurs. On relève
- la dysautonomie
- l'insomnie
- la somnolence diurne
- la fatigue
- la douleur
- des symptômes neuropsychiatriques[51]
Mesures diététiques
Une alimentation riche en protéines pourrait réduire l'efficacité de la levodopa par compétition au niveau de son absorption intestinale. Mais les études n'ont pas confirmé l'intérêt d'une diète en protéines. La prise du médicament en début de repas est parfois conseillée.
Exercices physiques
La pratique régulière d'exercices (éventuellement dans le cadre d'activités physiques adaptées) est essentielle pour maintenir mobilité, flexibilité, équilibre et pour combattre les effets et symptômes secondaires. De plus, la pratique régulière d'un sport permet d'augmenter la sécrétion naturelle de dopamine[58]. Les résultats concrets des effets de la réadaptation physique sur la maladie de Parkinson montrent une amélioration fonctionnelle notable[59].
A l'initiative de la Mutualité Française par exemple, des groupes de musicothérapie active utilisant le chant font l'objet d'essais aux résultats très prometteurs.
Rééducation orthophonique
Pour les troubles de la parole, la déglutition et la micrographie. Elle est encore trop souvent prescrite par les médecins tardivement.
Traitements chirurgicaux
Un traitement chirurgical des symptômes par implantation d'électrodes de stimulation est disponible depuis 1998 en Europe, 2000 aux États-Unis. Il a été développé chez l'homme par Alim-Louis Benabid et Pierre Pollak à Grenoble en 1993, suite à des études menées sur le primate par Abdelhamid Benazzouz à Bordeaux. Cette technique de stimulation cérébrale profonde réduit fortement les trois symptômes moteurs de la maladie. Une électrode est implantée dans le noyau subthalamique, et un neuro-stimulateur y envoie des impulsions électriques, ce qui semble rétablir le fonctionnement normal du système. Ce traitement ne concerne qu'environ 10 % des patients, du fait de la lourdeur de l'opération et de critères d'inclusion très stricts (stade de la maladie, sensibilité à la L-DOPA, âge, etc.). Cette technique ne doit être réalisée que par des équipes expertes. Elle permet d'obtenir de manière continue des effets similaires à ceux de la L-DOPA et de limiter les dyskinésies et fluctuations motrices. Il peut être réalisé par un dispositif robotisé.
La greffe des cellules fœtales est une technique qui consiste à injecter par voie stéréotaxique des cellules issues de produits d'avortement dans le striatum des patients. La difficulté d'obtention des cellules, la lourdeur de la méthode et la nécessité d'immunosuppression ont limité le développement de cette technique au profit de la stimulation intracérébrale chronique.
Un autre traitement par stimulation électrique du cortex moteur est à l'étude depuis 2004 et avait donné des premiers résultats encourageants. Ce traitement étant moins lourd que le précédent, les chercheurs espéraient ainsi pouvoir en faire bénéficier un plus grand nombre de patients[60]. Mais ces premiers résultats n'ont pas été confirmés et cette piste est quasiment abandonnée.
Perspectives thérapeutiques
Thérapie génique
Cette technique consiste à injecter dans certains zones du système nerveux central des vecteurs viraux porteurs de certains gènes. Ces gènes vont être intégrés dans le génome des cellules hôtes et secréter des substances neuroprotectrices ou des enzymes intervenant dans la synthèse de neuromédiateurs. Des études préliminaires ont montré des premiers résultats positifs en ce qui concerne la tolérance chez l'homme, mais l'efficacité clinique reste à démontrer[61].
Cellules souches
Il s'agit d'une piste thérapeutique majeure qui consiste à transplanter des cellules souches dans le système nerveux. Ces cellules sont totipotentes et peuvent en théorie se transformer en cellules neurales. Il existe encore de nombreux obstacles, en particulier liés au risque de cancérisation, avant d'envisager une utilisation thérapeutique chez l'homme. Les résultats restent inconstants, avec une amélioration plus visible chez les jeunes patients[62].
Autres
Un traitement par stimulation électrique de la moelle épinière est également à l'étude et vient de donner (en mars 2009) des résultats très prometteurs lors des premiers tests sur des souris et des rats[63],[64] .
Pronostic
Le risque de mortalité est à peu près doublé par rapport à une population non parkinsonienne, la cause la plus fréquente étant probablement les infections pulmonaires[55].
Les chutes sont une complication fréquente de la maladie[55].
Impact sur l'entourage de la personne malade
En France, le conjoint d'une personne atteint de la maladie de Parkinson lui consacre en moyenne 8 heures par jour. 52 % des conjoints de personne souffrant de la maladie de Parkinson limitent les sorties du domicile sans le patient. 47 % des conjoints parkinsoniens font chambre à part ou utilisent des lits jumeaux, 46 % ont recours à une aide à domicile[65].
Au Québec, Chloé Sainte-Marie et Gilles Carle ont fondé le Réseau des aidants pour « sortir de l’isolement, être reconnus et pouvoir compter sur de l’aide[66],[67] ».
Société et médias
Personnalités
Personnes célèbres atteintes d'une maladie de Parkinson :
- Le pape Jean-Paul II
- Le prédicateur évangéliste Billy Graham[68]
- L'acteur canadien Michael J. Fox
- Le romancier, poète et illustrateur anglais, Mervyn Peake
- Le boxeur américain Mohamed Ali
- Le basketteur américain Brian Grant
- Le metteur en scène québécois Gilles Carle
- Le pilote automobile américain Phil Hill
- Le chanteur américain Maurice White, membre du groupe Earth, Wind and Fire
- L'homme d'état Yasser Arafat
- Le militaire et président espagnol Francisco Franco
- Le président chinois Mao Zedong
- Probablement Adolf Hitler[69]
- L'actrice et humoriste française Sylvie Joly[70]
Références
- García Ruiz PJ, « Prehistoria de la enfermedad de Parkinson », dans Neurologia, vol. 19, no 10, décembre 2004, p. 735–7 [lien PMID]
- Lanska DJ, « Chapter 33: the history of movement disorders », dans Handb. Clin. Neurol., vol. 95, 2010, p. 501–46 [lien PMID, lien DOI]
- Koehler PJ, Keyser A, « Tremor in Latin texts of Dutch physicians: 16th–18th centuries », dans Mov. Disord., vol. 12, no 5, septembre 1997, p. 798–806 [lien PMID, lien DOI]
- Lees AJ, « Unresolved issues relating to the shaking palsy on the celebration of James Parkinson's 250th birthday », dans Mov. Disord., vol. 22, no Suppl 17, septembre 2007, p. S327–34 [lien PMID, lien DOI]
- Louis ED, « The shaking palsy, the first forty-five years: a journey through the British literature », dans Mov. Disord., vol. 12, no 6, novembre 1997, p. 1068–72 [lien PMID, lien DOI]
- Fahn S, « The history of dopamine and levodopa in the treatment of Parkinson's disease », dans Mov. Disord., vol. 23, no Suppl 3, 2008, p. S497–508 [lien PMID, lien DOI]
- Ehringer, H. & Hornykiewicz, O., 1960 : Verteilung von noradrenalin und dopamin (3-hydroxytyramin) in gerhirn des menshenen und ihr verhalten bei erkankungen des extrapyramidalen systems. Klin Wochenschr, vol. 38, p. 1236-9
- Schulz-Schaeffer WJ, « The synaptic pathology of alpha-synuclein aggregation in dementia with Lewy bodies, Parkinson's disease and Parkinson's disease dementia », dans Acta Neuropathol., vol. 120, no 2, août 2010, p. 131–43 [lien PMID, lien DOI]
- Guridi J, Lozano AM, « A brief history of pallidotomy », dans Neurosurgery, vol. 41, no 5, novembre 1997, p. 1169–80; discussion 1180–3 [lien PMID, lien DOI]
- Hornykiewicz O, « L-DOPA: from a biologically inactive amino acid to a successful therapeutic agent », dans Amino Acids, vol. 23, no 1–3, 2002, p. 65–70 [lien PMID, lien DOI]
- Coffey RJ, « Deep brain stimulation devices: a brief technical history and review », dans Artif. Organs, vol. 33, no 3, mars 2009, p. 208–20 [lien PMID, lien DOI]
- de Lau LM, Breteler MM, « Epidemiology of Parkinson's disease », dans Lancet Neurol., vol. 5, no 6, juin 2006, p. 525–35 [lien PMID, lien DOI]
- Samii A, Nutt JG, Ransom BR, « Parkinson's disease », dans Lancet, vol. 363, no 9423, mai 2004, p. 1783–93 [lien PMID, lien DOI]
- Twelves D, Perkins KS, Counsell C, Systematic review of incidence studies of Parkinson's disease, Mov Disord 2003;18:19-31
- La lettre du neurologue, Janvier 2004, Epidémiologie de la maladie de Parkinson ; p13 à 15
- Erreur dans la syntaxe du modèle ArticleCollège des Enseignants de Neurologie, « Référentiel National », dans , février 2008 [texte intégral]
- Lesage S, Brice A, « Parkinson's disease: from monogenic forms to genetic susceptibility factors », dans Hum. Mol. Genet., vol. 18, no R1, avril 2009, p. R48–59 [lien PMID, lien DOI]
- Tanner CM, Kamel F, Ross GW, et al., « Rotenone, Paraquat and Parkinson's Disease », dans Environ. Health Perspect, janvier 2011 [lien PMID, lien DOI]
- (en) Veterans and Agent Orange: Update 2008, Washington D.C., The National Academies press, 2009 (ISBN 0-309-13884-1), « Neurologic disorders », p. 510–45
- Allam MF, Campbell MJ, Hofman A, Del Castillo AS, Navajas R Fernández-Crehuet, Smoking and Parkinson's disease: systematic review of prospective studies, Mov Disord, 2004;19:614-621
- Castagnoli K, Murugesan T, « Tobacco leaf, smoke and smoking, MAO inhibitors, Parkinson's disease and neuroprotection; are there links? », dans Neurotoxicology, vol. 25, no 1–2, 2004 Jan, p. 279–91 [lien PMID, lien DOI]
- Costa J, Lunet N, Santos C, Santos J, Vaz-Carneiro A, « Caffeine exposure and the risk of Parkinson's disease: a systematic review and meta-analysis of observational studies », dans J. Alzheimers Dis., vol. 20, no Suppl 1, 2010, p. S221–38 [lien PMID, lien DOI]
- Hernán MA, Takkouche B, Caamaño-Isoma F et als. A meta-analysis of coffee drinking, cigarette smoking, and risk of Parkinson’s disease, Ann Neurol, 2002;52:276–84
- Patrice D. Smith ; Cyclin-dependent kinase 5 is a mediator of dopaminergic neuron loss in a mouse model of Parkinson's disease ; PNAS vol. 100 no. 23 13650-13655 ; doi:10.1073/pnas.2232515100 ; [article complet en ligne depuis 2003/10/31], avant publication du 2003/11/11
- Dianbo Qu et al. ; Role of Cdk5-Mediated Phosphorylation of Prx2 in MPTP Toxicity and Parkinson's Disease ; Neuron, Volume 55, Issue 1, 37-52, 5 July 2007 ; doi:10.1016/j.neuron.2007.05.033,
- Serge Przedborski ; Peroxiredoxin-2 links Cdk5 to neurodegeneration ; . Nat. Med. 13, 907 - 909 (2007) ;doi:10.1038/nm0807-907
- Serge Przedborski ; Peroxiredoxin-2 links Cdk5 to neurodegeneration
- Cookson MR, « alpha-Synuclein and neuronal cell death », dans Mol Neurodegener, vol. 4, 2009, p. 9 [texte intégral, lien PMID, lien DOI]
- Krüger R, Müller T, Riess O, « Involvement of alpha-synuclein in Parkinson's disease and other neurodegenerative disorders », dans J Neural Transm, vol. 107, no 1, 2000, p. 31–40 [lien PMID]
- Parkinson's Progress
- Siderowf A, Stern MB, « Premotor Parkinson's disease: clinical features, detection, and prospects for treatment », dans Ann. Neurol., vol. 64 Suppl 2, décembre 2008, p. S139–47 [lien PMID, lien DOI]
- Langston JW, « The Parkinson's complex: parkinsonism is just the tip of the iceberg », dans Ann. Neurol., vol. 59, no 4, avril 2006, p. 591–6 [lien PMID, lien DOI]
- (en) Berendse HW, Ponsen MM, « Diagnosing premotor Parkinson's disease using a two-step approach combining olfactory testing and DAT SPECT imaging », dans Parkinsonism Relat. Disord., vol. 15 Suppl 3, décembre 2009, p. S26–30 [lien PMID, lien DOI]
- Ronald F. Pfeiffer,Iván Bódis-Wollner. Parkinson's disease and nonmotor dysfunction
- Étude de 161 paires de jumeaux
- Dr Testerman Traci, Bacteria 'linked' to Parkinson's disease, BBC Online, consulté 2011/05/23
- (en)Pesticide exposure and risk for Parkinson's disease, A Ascherio, H Chen, M Weisskopf, E O'Reilly, M McCullough, E Calle, M Schwarzschild, M Thun, Annals of Neurology, 2006;60;197-203
- Giasson BI, Lee VMY, A new link between pesticides and Parkinson's disease, Nature Neuroscience, 2000;3:1227-1228
- Wang A, Costello S, Cockburn M et als. Parkinson’s disease risk from ambient exposure to pesticides, Europ J Epidemiol, 2011 DOI: 10.1007/s10654-011-9574-5
- Brève de l'AFP reprise par le Journal Le monde (2009/06/16)
- Rugbjerg K, Ritz B, Korbo L, Martinussen N, Olsen JH, Risk of Parkinson’s disease after hospital contact for head injury: population based case-control study, BMJ, 2008;337:a2494
- Le 12 mai 2006, pour la première fois, un tribunal des affaires de sécurité sociale (TASS) (celui de Bourges, Département du Cher) a reconnu comme maladie professionnelle la maladie de Parkinson dont souffrait un ancien salarié agricole, M. V., 52 ans ayant développé les symptômes de cette maladie à 44 ans (en 1998) alors qu'il devait manipuler de grandes quantités de produits phytosanitaires au cours de sa vie professionnelle.
- Healy DG, Falchi M, O-Sullivan SS et als. Phenotype, genotype, and worldwide genetic penetrance of LRRK2-associated Parkinson's disease: a case-control study, Lancet Neurol, 2008;7: 583-590
- Suzanne Lesage, LRRK2, gène majeur de la maladie de Parkinson dans les pays du Maghreb, Edudit, Volume 22, numéro 5, mai 2006, p. 470-471
- Article du centre Helmholtz de Munich (11/01/2010)
- Article de la LMU - (11/01/2010)
- Doty RL, Bromley SM, Stern MB, Olfactory testing as an aid in the diagnosis of Parkinson's disease: development of optimal discrimination criteria, Neurodegeneration, 1995;4:93-97
- Meseguer E, Taboara R, Sánchez V, Mena MA, Campos V, De Yébenes J García, Life-threatening Parkinsonism induced by kava kava, Mov Disord, 2002;17:193-196
- Document sur le manganisme publié par l'Institut de recherche Robert Sauvé en Santé et en Sécurité du Travail
- (en) L'olfaction permet de différencier un syndrome parkinsonien d'origine vasculaire d'une maladie de Parkinson
- Tysnes OB, Müller B, Larsen JP, « Are dysautonomic and sensory symptoms present in early Parkinson's disease? », dans Acta Neurol. Scand., Suppl., no 190, 2010, p. 72–7 [lien PMID, lien DOI]
- Hinz M, Stein A, Uncini T, « Amino acid management of Parkinson's disease: a case study », dans Int J Gen Med, vol. 4, 2011, p. 165–74 [texte intégral, lien PMID, lien DOI]
- Ascherio A, LeWitt PA, Xu K, et al., « Urate as a predictor of the rate of clinical decline in Parkinson disease », dans Arch. Neurol., vol. 66, no 12, décembre 2009, p. 1460–8 [lien PMID, lien DOI]
- Schipper HM, « Redox neurology: visions of an emerging subspecialty », dans Ann. N. Y. Acad. Sci., vol. 1012, mars 2004, p. 342–55 [lien PMID]
- Lees AJ, Hardy J, Revesz T, Parkinson's disease, Lancet, 2009;373:2055-2066
- Goetz CG, Wuu J, McDermott MP et als. Placebo response in Parkinson's disease: comparisons among 11 trials covering medical and surgical interventions, Mov Disord, 2008;23:690-699
- has-sante.fr
- Rôle du sport sur le circuit de la récompense
- Keus SH, Bloem BR, Hendriks EJ et als. Evidence-based analysis of physical therapy in Parkinson's disease with recommendations for practice and research, Mov Disord, 2007;22:451-460
- CEA Direction des sciences du vivant : Stimulation du cortex moteur dans le traitement de la forme évoluée de la maladie de Parkinson
- Marks WJ, Ostrem JL, Verhagen L et als. Safety and tolerability of intraputaminal delivery of CERE-120 (adeno-associated virus serotype 2-neurturin) to patients with idiopathic Parkinson's disease: an open-label, phase I trial, Lancet Neurol, 2008;7:400-408
- Freed CR, Greene PE, Breeze RE et als. Transplantation of embryonic dopamine neurons for severe Parkinson's disease, N Engl J Med, 2001;344:710-719
- Fuentes R, Petersson P, Siesser WB, Caron MG, Nicolelis MA, Spinal cord stimulation restores locomotion in animal models of Parkinson's disease, Science, 2009;323:1578-1582 sciencemag.org]
- Un simulateur de la moelle épinière offre un nouvel espoir contre Parkinson
- Etude Compas
- Communiqué de presse - lancement du Réseau des aidants
- reseaudesaidants.org, le site Internet du réseau
- CBC News Indepth: Billy Graham
- Adolf Hitler's Parkinson's disease and an attempt to analyse his personality structure, Franz Gerstenbrand, Elisabeth Karamat, Ludwig Boltzmann lnstitut für Restaurafive Neurologie, Neurologisches Krankenhaus Maria Theresien Schlössl, Hofzeile 18–20, A-1190 Wien, Austria b A-2020 Oberfellabrunn 72, Austria
- Sylvie Joly souffre de la maladie de Parkinson, Libération, 8/10/2010
Annexes
Liens externes
- Pharmacologie de la maladie de Parkinson sur le site de l'université de Rennes
- Site de l'Association France Parkinson
- Site de l'Association Belge Parkinson
Articles connexes
- Corossol (neurotoxicité des fruits de la famille des annonacées)
Catégories :- Maladie neurodégénérative
- Maladie en gériatrie
Wikimedia Foundation. 2010.