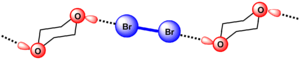- Liaisons Halogènes
-
Liaison halogène
Il existe un monde parallèle à celui de la liaison hydrogène (HB), qui est celui de la liaison halogène (XB) qui s'établit entre les atomes d'halogènes électrodéficients (appauvris en densité électronique), facilement polarisables tels que l'iode (I) et le brome (Br), et les entités riches en densité électronique comme les dérivés azotés et oxyénés (amines, éthers, amides, etc). Les applications pratiques et potentielles de la liaison halogène sont aussi vastes que celles de son analogue: la liaison hydrogène.
Sommaire
Définition
Une liaison halogène (XB) est une interaction non covalente entre un halogène appauvri en électron (polarisé δ+), acide de Lewis, et une base de Lewis (polarisée δ-). L'appellation liaison halogène est introduite pour faire le parallèle avec la liaison hydrogène. Par ailleurs, les halogènes sont aussi connus pour former des liaisons covalentes avec les autres atomes le carbone, l'azote, l'oxygène, etc. Une liaison halogène (interaction halogène) fait essentiellement référence à une interaction non covalente où l'atome d'halogène agit comme entité électrophile.
Liaison
 Figure 1: Comparaison entre liaison hydrogène et liaison halogène. Dans les deux cas, D (donneur) est un atome, groupement d'atomes, ou une molécule qui participe à la formation de l'interaction par l'espèce électrodéficiente (H ou X). H est l'atome d'hydrogène dans la liaison hydrogène HB, et X est l'atome d'halogène participant à la liaison halogène XB. A (accepteur) est l'entité riche en électron.
Figure 1: Comparaison entre liaison hydrogène et liaison halogène. Dans les deux cas, D (donneur) est un atome, groupement d'atomes, ou une molécule qui participe à la formation de l'interaction par l'espèce électrodéficiente (H ou X). H est l'atome d'hydrogène dans la liaison hydrogène HB, et X est l'atome d'halogène participant à la liaison halogène XB. A (accepteur) est l'entité riche en électron.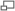
- Analogie XB & HB
Une analogie existe entre la liaison halogène (XB) et la liaison hydrogène (HB).[1] Dans les deux cas de liaisons, il s'agit d'une interaction entre un donneur d'électron et un accepteur d'électron. La différence entre les deux formes d'interaction réside dans la nature du site donneur. Dans le cas de la liaison hydrogène, l'hydrogène est l'accepteur d'électron et interagit de manière non-covalente en acceptant une densité électronique de la part d'une espèce riche en électron (exemple l'interaction O-H...O dans l'eau). Tandis que dans le cas de la liaison halogène, l'atome d'halogène est l'accepteur d'électron. Les transferts électroniques entre les deux espèces provoquent l'interpénétration des volumes de van der Waals.[2]
- Qui participe?
Les études expérimentaux et les considérations théoriques ont montré que les atomes d'halogènes qui peuvent participer la formation d'une liaison halogène sont : l'iode (I), le brome (Br), le chlore (Cl), et par fois le fluor (F). Tous les quatre sont capables de se comporter comme donneurs dans les liaisons halogènes (XB). La force de ces liaisons varient selon l'halogène engagé. Une tendance général ressorte : I > Br > Cl > F, dans la plupart des cas, c'est l'iode donne lieu aux interactions les plus fortes.
Les dihalogènes (I2, Br2, etc.) ont tendance à former des liaisons halogènes fortes. Toutefois, la force et l'efficacité de des interactions produites par le chlore et le fluor dépendent de la nature du donneur D. En effet, si l'halogène est lié à un groupement fortement électroattracteur, il en résulte probablement des interactions plus fortes.[3]
- Caractéristiques
Les liaisons halogènes sont caractérisées par leur force, spécificité, directionnalité ce qui conduit des structures avec des architectures bien définies pouvant être raisonnablement prévues. La force de ces interactions varie entre 5 et 180 kJ/mol. Cette force des liaisons XB permet de la mettre en compétition avec les liaisons HB. Par ailleurs, les atomes D, X et A participant à la formation Halogène ont tendance à s'aligner et à former de angles se rapprochant le plus de 180°, déjà démontré par Hassel dans le cas du complexe entre le dibrome et 1,4-dioxane. Un autre facteur qui contribue à la force d'une liaison halogène est lié à la faible distance entre l'halogène (acide de Lewis, donneur XB) et la base de Lewis (accepteur XB). La nature attractive de l'interaction affecte la distance entre le donneur et l'accepteur qui est inférieur à la somme des rayons de van der Waals. La force de cette interaction augmente quand la distance entre l'halogène et l'accepteur diminue.
Un peu d'histoire
En 1863, Frederick Guthrie a rapporté pour la première fois la tendance qu'ont les halogènes à former des adduits avec les espèces électrodonneurs.[4] En effet, l'ajout de I2 à une solution saturée de nitrate d'ammonium NH4NO3, conduit à la formation de NH3I2. Ce dernier se décompose spontanément en ammoniac (NH3) et iode (I2 lorsqu'il est exposé à l'air. Ces constations ont permis à Guthrie de conclure que le composé est de formule NH3I2 et qu'il s'agit d'un adduit obtenu par interaction non covalente et qu'il ne s'agit pas de la formation d'une liaison covalente N-I.
Grâce à la théorie de Robert S. Mulliken,[5],[6] élaboré au milieu des années cinquantes (1950), sur les complexes obtenus par un effet de transfert d'électrons entre les donneurs et les accepteurs, une meilleure compréhension des mécanismes à travers lesquels les liaisons halogènes peuvent avoir lieu a été possible.
Mise en évidence
Les techniques spectroscopiques, la diffraction des rayons X (DRX), et les calculs théoriques ont permis de mieux comprendre la nature et les mécanismes des interactions halogènes.
par la DRX
La première preuve cristallographique de la formation de la liaison halogène a été apporté Hassel en 1954. Il a pu élucider la structure de la dibromo-1,4-dioxanate par diffraction des rayons X.[7] Il a ainsi montré que la cohésion de la structure du cristal est assurée par des liaisons halogènes entre le brome et l'oxygène. La présence d'une interaction entre le brome et l'oxygène induit une diminution de la distance O-Br dans le cristal (2.71 Å) qui est de ~20% inférieure à la somme des rayons de van der Waals de l'oxygène et du brome(3.35 Å). Un alingation des atomes participant à la liaison halogène est aussi constaté, en effet l'angle entre les liaisons O-Br et Br-Br est proche de 180°. Ceci a permis à Hassel de conclure que que les atomes d'halogènes sont directement liés au pair d'électron n du donneur et la direction de la liaison coïncide avec les axes des orbitales des doublets libres dans les composés donneurs.[8]
par les calculs théoriques
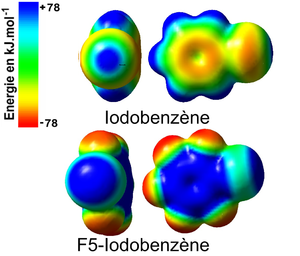
Les calculs théoriques ab-initio permettent d'accéder à de nombreux paramètres électroniques au sein des édifices moléculaires halogénées tels que les charges partielles des atomes, la densité électronique, les distances interatomiques, la polarisabilité, etc. En effet, l'étude de la répartition de la densité électronique et les surfaces de potentiels électrostatiques des dérivés halogénés montrent l'existence d'une zone chargée positivement sur à la surface des halogènes fortement polarisable tels que l'iode (I) ou le brome (Br). Cette zone est appelé trou σ (sigma). L'apparition du trou σ peut être corréler avec l'effet inductif attracteur qu'exerce les atomes ou les groupements d'atomes sur le nuage électronique de l'halogène en question. Ainsi, par exemple, l'étude de distribution de la densité électronique à la surface de l'iodobenzène et du pentafluoroiodobenzène en se basant sur la théorie de la perturbation de Møller-Plesset du second ordre (MP2)[9] suivie par la cartographie de la répartition de la densité à la surface de ces molécules (surface de van der Waals ~ 0.002e/Å2) révèle une zone centrée autour de l'axe de la liaison C-I où l'iode est polarisé positivement (zone bleu) et le noyau aromatique à une forte densité électronique ainsi que et les atomes de fluor (zone rouge). L'augmentation de l'effet attracteur par la substitution des hydrogènes par des fluors accentue et augmente la taille du trou σ.
Politlzer et coll.[10] ont montré que l'établissement de liaisons halogènes est intimement lié à la présence des trous σ à la surface des halogènes. La taille du trou σ est calculée en considérant la force de répulsion électrostatique obtenue entre la zone chargée positivement et un charge positive entière fictive. Elle est exprimée en kJ/mol.
par spectroscopie IR et RMN
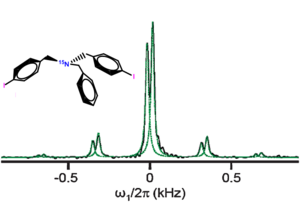
Les études spectroscopiques notamment par la spectroscopie de rotation, la spectroscpie microonde à transformée de Fourier, la spectroscopie infrarouge à transformée de Fourier (FTIR), etc. ont fourni un bon nombre de preuves supplémentaires de la formation des liaisons halogènes.[11] Par exemple, la spectroscopie FTIR a permis de voir la présence des interactions XB à travers un léger changement de la fréquence de vibration des liaisons covalentes C-X.[12] Plus récemment, la RMN de l'azote 15 a été exploitée avec succès afin de mettre en évidence la présence de liaisons halogènes dans une molécule enrichie à l'azote N15 et contenant deux atomes d'iode.[13] Ainsi, la CP-MAS RMN (la RMN de l'état solide à polarisation croisée) a montré la présence de deux signaux relatifs à deux liaisons halogènes au sein du solide du fait que l'azote N15 interagit avec deux iodes situés dans deux positions cristallographiques différentes.
Applications
Les interactions halogènes ont servi pour l'élaboration de cristaux liquides, des polymères conducteurs, matériaux nanoporeux, etc. Par ailleurs, les liaisons halogènes gouvernent probablement la reconnaissance des médicaments ou des hormones halogénés par leurs sites de reconnaissance respectifs.
Ingénierie des cristaux
L'ingénierie des cristaux est un domaine récent de la recherche qui jette un pont entre la chimie de l'état solide et la chimie supramoléculaire.[14] Ce champ de recherche est par excellence interdisciplinaire car il fait appelle des disciplines classiques sans relation apparente telles que tant la cristallographie, la chimie organique, chimie organique et la chimie analytique. En 1971, Schmidt a initié ce champ en publiant un article sur la photodimérisation à l'état solide.[15] Une définition récente identifie l'ingénierie des cristaux comme l'exploitation des interactions intermoléculaires pour la cristallisation et le développement de nouveaux composés ayant des propriétés physicochimiques intéressantes. Avant la découverte de la liaison halogène, l'approche pour l'ingénierie des cristaux faisait appel à la liaison hydrogène, la chimie de coordination et les interactions inter-ionique pour le développement matériaux à base de cristaux liquides ou de cristaux solides. De plus, la liaison halogène est utilisé pour organiser les sels des radicaux-cations, pour fabriquer des fils moléculaires conducteurs, et pour créer des édifices à base de cristaux liquides. De nouveaux matériaux à base de liaison halogène sont aussi apparus.[16]
- Cristaux liquides (LCs)
 Figure 7: Image de cristaux liquides par Bruce et al.
Figure 7: Image de cristaux liquides par Bruce et al.
La nature particulière de l'interaction halogène peut servir comme nouvel outil pour élaborer des cristaux. Effectivement, en 2004, Loc Nguyen et al. ont été les premiers à exploiter les liaisons halogènes pour l'élaboration de cristaux liquides en utilisation comme précurseurs de départ alkoxystilbazoles et pentafluoroiodobenzene.[17] Par ailleurs, divers alkoxystilbazoles ont été utilisés pour la fabrications pour de matériaux pour l'optique non linéaire.[18]
Resnati et coll. ont préparé des complexes à partir de l'iodopentafluorobenzene et des 4-alkoxystilbazoles. La DRX de ces complexes a révélée une courte distance N-I égale à 2.81 Å ce qui est inférieure à la somme des rayons de VdW (3.53 Å) tandis que l'angle B-X...A égale à 168.4°. La faible distance de l'interaction N—I est en faveur d'une liaison très forte. Par ailleurs, la diffraction des rayons X ne montre pas interaction du type quadripolaire. L'utilisation du bromopentafluorobenzène comme acide de Lewis avec les 4-alkoxystilbazoles ne permet de former des complexes. Ces résultats ont a permit de mettre en évidence l'effet de la polarisabilité de l'atome d'halogène.
- Preparation of poly(diiododiacetylene)[19]
En l'an 2000, le prix Nobel de chimie fut décerné à Alan J. Heeger, Alan MacDiarmid, et Hideki Shirakawa qui ont découvert que le polyacétylène est un matériau conducteur et dont la conductivité est multiplé par un facteur 108 par oxydation avec le diiode (I2). Malgré la difficulté de le préparer, depuis lors un grand nombre de travaux ont essayé de mimer la squelette conjugué de ce polymère, par exemple le poly(p-phénylvinylène) à cause des nombreuses applications pratiques des polymères conjugués. En effet, ils sont utilisées pour l'élaboration des des cellules photovoltaïques, diodes, transistor à effet de champ, capteurs chimiques,etc.
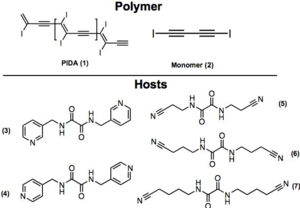
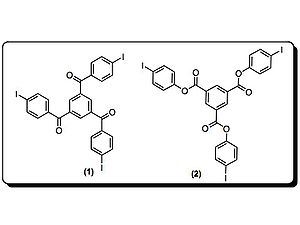
Goroff et al. ont préparé des poly(diiododiacetylene) ordonnés (PIDA) via le réarrangement du monomère (2) modulée par les liaisons halogènes. PIDA est excellant précurseur pour d'autres polymères conjugués, vue que l'iode peut être facilement échangé. Actuellement, la coupure de la liaison covalente C-I est possible par réduction électrochimique.
Crystal structures of monomer (2) are disordered materials of varying composition and connectivity. Hosts (3-7) were investigated for their molecular packing, primarily by studying co-crystals of monomer (2) and respective host. Both (3) and (4) pre-organized monomer (2), but steric crowding around the iodines prevented successful topological polymerization of the monomer. Hosts 5-7 utilize hydrogen bonds and halogen bonds to hold monomer (2) at an optimal distance from each other to facilitate polymerization. In fact, when host 7 was used, polymerization occurred spontaneously upon isolation of the co-crystals. Crystal structures show the polymer strands are all parallel to the hydrogen-bonding network, and the host nitriles are each halogen-bonded to iodine atoms. Interestingly, half of the iodine atoms in (1) in the crystal are in close contact to the oxalamide oxygen atoms. Oxygen atoms of host 7 are acting as both hydrogen and halogen bond acceptors.
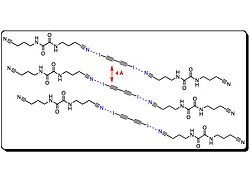
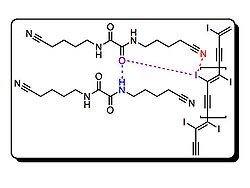 Above is a representation of a crystal structure of 1 and 7. As shown, the oxalamide oxygen (in purple) forms a hydrogen bond with the amide below (blue dashed line) and forms a weak halogen bond with the iodine on 1 (purple dashed line). This weak halogen bond further stabilizes this co-crystal. Halogen bond between the nitrile and iodine is represented with a red dashed line.
Above is a representation of a crystal structure of 1 and 7. As shown, the oxalamide oxygen (in purple) forms a hydrogen bond with the amide below (blue dashed line) and forms a weak halogen bond with the iodine on 1 (purple dashed line). This weak halogen bond further stabilizes this co-crystal. Halogen bond between the nitrile and iodine is represented with a red dashed line.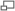
- Structures poreuses
Porous structures have a variety of uses. Many chemists and material scientists are working to improve metal-organic frameworks (MOFs) to store hydrogen to use in cars. These highly organized crystalline inclusion complexes have potential uses in catalysis and molecular separation devices. Molecular organization is oftentimes controlled via intermolecular forces such as hydrogen bonding. However, utilizing hydrogen bonding often limits the range of pore sizes available due to close packing.
Pigge, et al., utilized halogen bonding interactions between amines, nitrogen heterocycles, carbonyl groups, and other organic halides, to construct their porous structures. This is significant because organic crystalline networks mediated by halogen bonds, an interaction significantly weaker than hydrogen bond, are rare.[20]
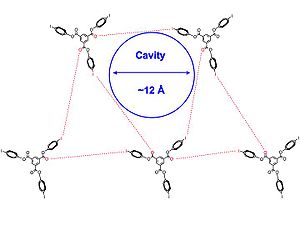
Crystal structures of 1 and 2 [below] were obtained in a variety of solvents, such as dichloromethane, pyridine, and benzene. The authors note that the porous inclusion complexes appear to be mediated in part by unprecedented I-p interactions and by halogen bond between iodine and carbonyl groups. The crystal structure [shown below] come together in a triangular array and molecules of 2 are approximately symmetric. Additionally, all of the sets of halogen bonding interactions are not identical, and all of the intermolecular interactions between halogen and halogen bond acceptor slightly exceed the sum of the Van Der Waals radius, signifying a slightly weaker halogen bond, which leads to more flexibility in the structure. The 2D layers stack parallel to each other to produce channels filled with solvent.
Solvent interactions are also noted in the formation of the hexagonal structures, especially in pyridine and chloroforme. Initially, crystals that form these solutions form channeled structures. Over time, new needle-like solvate-free structures form are packed tighter together, and these needles are actually the thermodynamically favored crystal. The authors hope to use this information to better understand the complementary nature of hydrogen bonds and halogen bonds in order to design small molecules predict structures.
Les liaisons halogènes dans les systèmes biologiques
For some time, the significance of halogen bonding to biological macromolecular structure was overlooked. Based on single-crystal structures in the protein data bank (PDB) (July 2004 version), a study by Auffinger and others on single crystals structures with 3 Å resolution or better entered into the PDB revealed that over 100 halogen bonds were found in six halogenated-based nucleic acid structures and sixty-six protein-substrate complexes for halogen-oxygen interactions. Although not as frequent as halogen-oxygen interactions, halogen-nitrogen and halogen-sulfur contacts were identified as well.[21] These scientific findings provide a unique basis for elucidating the role of halogen bonding in biological systems.
On the bio-molecular level, halogen bonding is important for substrate specificity, binding and molecular folding.[22] In the case of protein-ligand interactions, the most common charge-transfer bonds with polarizable halogens involve backbone carbonyls and/or hydroxyl and carboxylate groups of amino acid residues. Typically in DNA and protein-ligand complexes, the bond distance between Lewis base donor atoms (eg. O, S, N) and Lewis acid (halogen) is shorter than the sum of their Van der Waals radius. Depending on the structural and chemical environment, halogen bonding interactions can be weak or strong. In the case of some protein-ligand complexes, halogen bonds are energetically and geometrically comparable to that of hydrogen bonding if the donor-acceptor directionality remains consistent. This intermolecular interaction has been shown to be stabilizing and a conformational determinant in protein-ligand and DNA structures.
For molecular recognition and binding, halogen bonding can be significant. An example of this assertion in drug design is the substrate specificity for the binding of IDD 594 to human aldose reductase.[23] E.I. Howard reported the best resolution for this monomeric enzyme. This biological macromolecule consists of 316 residues, and it reduces aldoses, corticosteroids, and aldehydes. D-sorbitol, a product of the enzymatic conversion of D-glucose, is thought to contribute to the downstream effects of the pathology of diabetes.[24] Hence, inhibiting this enzyme has therapeutic merit.
Aldehyde-based and carboxylate inhibitors are effective but toxic because the functional activity of aldehyde reductase is impaired. Carboxylate and aldehyde inhibitors were shown to hydrogen bond with Trp 111, Tyr 48, and His 110. The “specificity pocket,” created as a result of inhibitor binding, consists of Leu 300, Ala 299, Phe 122, Thr 113, and Trp 111. For inhibitors to be effective, the key residues of interaction were identified to be Thr 113 and Trp 111. IDD 594 was designed such that the halogen would provide selectivity and be potent. Upon binding, this compound induces a conformational change that causes halogen bonding to occur between the oxygen of the Thr and the bromine of the inhibitor. The bond distance was measured to be 2.973(4) Å. It is this O—Br halogen bond that contributes to the large potency of this inhibitor for human aldose reductase rather than aldehyde reductase.
 Within the specificity pocket of the protein-inhibitor complex, a short Br--O halogen bond contributes to inhibitor potency.[25]
Within the specificity pocket of the protein-inhibitor complex, a short Br--O halogen bond contributes to inhibitor potency.[25]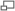
Notes et références
- ↑ P.A. Kollman et L.C. Allen, « Theory of the Hydrogen Bond », dans Chem. Rev., vol. 72, no 3, 1972, p. 283-303 [texte intégral]
- ↑ P. Metrangolo et G. Resnati, « Halogen Bonding: A Paradigm in Supramolecular Chemistry », dans Chem. Eur. J., vol. 7, no 12, 2001, p. 2511 - 2519 [texte intégral]
- ↑ P. Metrangolo, H. Neukirch, T. Pilati et G. Resnati, « Halogen Bonding Based Recognition Processes: A World Parallel to Hydrogen Bonding », dans Acc. Chem. Res., vol. 38, no 5, 2005, p. 386–395 [texte intégral]
- ↑ F. Guthrie, « XXVIII. On the Iodide of Iodammonium », dans J. Chem. Soc., vol. 16, 1863, p. 239–244 [texte intégral]
- ↑ R. S. Mulliken, « Electronic Population Analysis on LCAO-MO Molecular Wave Functions. I », dans J. Chem. Phys., vol. 23, 1955, p. 1833-1840. [texte intégral]
- ↑ R. S. Mulliken, « Electronic Population Analysis on LCAO-MO Molecular Wave Functions. II. Overlap Populations, Bond Orders, and Covalent Bond Energies », dans J. Chem. Phys., vol. 23, 1955, p. 1841-1846. [texte intégral]
- ↑ O Hassel et J Hvoslef, « The Structure of Bromine 1,4-Dioxanate », dans Acta. Chem. Scand., vol. 8, 1954, p. 873-873 [texte intégral]
- ↑ O Hassel, « Structural Aspects of Interatomic Charge-Transfer Bonding », dans Science, vol. 170, 1970, p. 497–502 [texte intégral]
- ↑ C. Møller et M. S. Plesset, « Note on an Approximation Treatment for Many-Electron Systems », dans Phys. Rev., vol. 46, no 7, 1934, p. 618-622 [texte intégral]
- ↑ P. Politzer, P. Lane, M. C. Concha, Y. Ma et J. S. Murray, « An overview of halogen bonding », dans J. Molecul. Model., vol. 13, no 2, 2007, p. 305-311 [texte intégral]
- ↑ A. C. Legon, Halogen Bonding : Fundamentals and Applications, vol. 126, P. Metrangolo & G.Resnati, coll. « Structure and Bonding », Berlin Heidelberg, 2008, 230 p. (ISBN 978-3-540-74329-3), p. 17-64
- ↑ J. Xu, X. Liu, J. K.-P. Ng, T. Lin et C. He, « Trimeric supramolecular liquid crystals induced by halogen bonds », dans J. Mater. Chem., vol. 16, no 45, 2006, p. 3540 - 3545 [texte intégral]
- ↑ M. Weingarth, N. Raouafi, B. Jouvelet, L. Duma, G. Bodenhausen, K. Boujlel, B. Scöllhorn et P. Tekley, « Revealing molecular self-assembly and geometry of non-covalent halogen bonding by solid-state NMR spectroscopy », dans Chem. Commun., no 45, 2008, p. 5981-5983 [texte intégral]
- ↑ D. Braga, G. R. Desiraju, J. S. Miller, A. G. Orpen et S. L. Price, « Innovation in crystal engineering », dans CrysEngComm, vol. 4, 2002, p. 500-509 [texte intégral]
- ↑ G. M. J. Schmidt, « Photodimerization in the solid state », dans Pure Appl. Chem., vol. 27, no 4, 1971, p. 647–678 [texte intégral]
- ↑ P. Metrangolo, G. Resnati, T. Pilati, R. Liantonio et F. Meyer, « Engineering Functional Materials by Halogen Bonding », dans J. Polym. Sci. Part A: Polym. Chem., vol. 45, no 1, 2007, p. 1–14 [texte intégral lien DOI]
- ↑ H. Loc Nguyen, P. N. Horton, M. B. Hursthouse, A. C. Legon et D. W. Bruce, « Halogen Bonding: A New Interaction for Liquid Crystal Formation », dans J. Am. Chem. Soc., vol. 126, no 1, 2004, p. 16–17 [texte intégral lien DOI]
- ↑ D. W. Bruce, « The Materials Chemistry of Alkoxystilbazoles and Their Metal Complexes », dans Adv. Inorg. Chem, vol. 52, 2001, p. 151–204 [lien DOI]
- ↑ A. Sun, J. W. Lauher et N. S. Goroff, « Preparation of Poly(Diiododiacetylene), an Ordered Conjugated Polymer of Carbon and Iodine », dans Science, vol. 312, 2006, p. 1030–1034 [lien DOI]
- ↑ « »
- ↑ « »
- ↑ « »
- ↑ « »
- ↑ « »
- ↑ « »
Catégorie : Liaison chimique
Wikimedia Foundation. 2010.