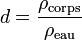- Gravité spécifique
-
Densité
 Pour les articles homonymes, voir Densité (homonymie).
Pour les articles homonymes, voir Densité (homonymie).La densité ou densité relative d'un corps est le rapport de sa masse volumique à la masse volumique d'un corps pris comme référence. Le corps de référence est l'eau pure à 4 °C pour les liquides et les solides. Dans le cas de gaz ou de vapeur, le corps de référence gazeux est l'air, à la même température et sous la même pression. La densité est une grandeur sans dimension et sa valeur s'exprime sans unité de mesure[1].
Sommaire
Histoire et terminologie
La densité d'un corps est une notion de physique ancienne, apparue au XVIIe siècle. Cette grandeur caractéristique d'un corps, exprimée par un nombre sans dimension a un usage commun. Elle est souvent définie succinctement dans les dictionnaires savant ou encyclopédique[2].
Son origine est lointaine et alchimique, comme le suggère Gaston Tissandier dans ses cours à la société polymatique de Paris après 1865. Le mot français densité provient du latin densitas, désignant l'épaisseur, la compacité, voire l'opacité. Les alchimistes, fanatiques de la pureté des corps et des corrélations astrologiques et numériques, ont cherché à comparer par des critères reproductibles l'eau, les métaux, et toutes les substances qu'ils pouvaient purifier, distiller, sublimer.
Par la pesée d'un même volume de matière pure, ils ont invariablement retrouvé les classements des planètes déjà connus :
- Soleil ou l'or : 19,25
- Mercure ou le vif-argent : 13,56
- Saturne ou le plomb : 11,35
- Lune ou l'argent : 10,47
- Vénus ou le cuivre : 10,78
- Jupiter ou l'étain : 7,29
- Mars ou le fer : 7,20
Ces nombres qu'ils obtenaient plus ou moins précisément selon la qualité de leur appareillage et leur manipulation désignent déjà des absolus numériques par rapport à l'eau pure la plus dense, sur laquelle flotte la glace.
La science expérimentale à partir de 1610 a repris leurs appareils, protocoles et mesures dans des buts d'identification, d'analyse et de synthèse, et pour donner lentement naissance à la chimie et aux mesures physiques concernant la matière. Des techniques précises de mesure de densité de solutions salines sont mises au point par Antoine Baumé. Divers courants rationalistes, en particulier après 1790, ont balayé une grande part de conceptions héritées ressenties comme d'anciens legs superstitieux. Ces hommes de science ont voulu valoriser le terme densité en prenant modèle sur la science anglaise, que les spécialistes de la mécanique céleste considèrent exemplaire. Les pays anglo-saxons, très marqués par l'alchimie ainsi que la vie et la pensée de Isaac Newton l'attestent, density désigne la masse volumique et relative density la densité dès le dix-huitième siècle.
Émile Littré définit la densité comme le « rapport de la masse d'un corps à son volume », c'est-à-dire comme la masse volumique. Le scientifique rationaliste Laplace, admirateur de Newton, cité en référence[3], utilise en 1810 la densité en synonyme de masse volumique. Le BIPM lui-même associe encore, en 1960, les termes densité et masse volumique[4].
Néanmoins la mesure expérimentale directe de la masse volumique s'appuie toujours sur une pesée hydrostatique avec comme référence une masse d'eau liquide. C'est une mesure de densité relative[5]. La « densité relative » étant la seule grandeur mesurable expérimentalement sa forme courte « densité » est généralement préférée. Le mot densité est, d'après Littré, l'expression moderne du terme « densité relative ». La masse volumique reste le synonyme moderne des expressions désuètes « densité absolue » ou « densité propre »[6].
Enfin, il ne faut pas confondre la densité d'un corps, sans dimension, avec la densité particulaire, définie par une unité, puisque cette dernière densité d'une grandeur est un rapport statistique d'une population donnée sur un élément d'espace (longueur, surface ou volume) utilisé pour décompter cette population, comme c'est le cas pour la densité surfacique de population, la densité de charge, la concentration molaire.
Expression de la densité
La densité, notée d, s'exprime de la sorte :
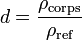
où ρcorps est la masse volumique du corps considéré, et ρref est la masse volumique du corps de référence.
Densité des gaz
La densité des gaz est calculée à partir de la densité de l'air[7]. La valeur de référence prise est la masse d'un litre d'air à 0 °C sous une pression de 760 mmHg, soit 1,29349 g.
On a ainsi
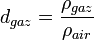
Il existe une façon commode de relier la masse molaire M d'un gaz et sa densité. En effet, en considérant un gaz parfait, PV = nRT d'où :
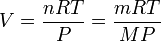 avec
avec 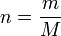
On a donc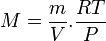 ou
ou 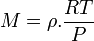
et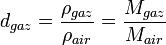 avec
avec 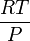 pris identique pour l'air et le gaz considéré.
pris identique pour l'air et le gaz considéré.En tenant compte de la composition de l'air et des masses molaires respectives (78% de diazote, 21% de dioxygène et 1% d'argon environ), il est facile de montrer que : Mair = 29g.mol − 1, soit Mgaz = 29.d
Par exemple, la densité du dihydrogène est
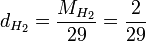
Soit
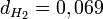 environ.
environ.Il découle de cette relation que plus un gaz a une masse molaire élevée, plus il est dense. Il est ainsi facile de prévoir que le dioxyde de carbone (CO2) sera plus dense que l'air et que les gaz les moins denses sont le dihydrogène et l'hélium.
Le composé gazeux le plus dense à température ambiante est l'hexafluorure de soufre,SF6.
Densité pour les solides et les liquides
Le plus souvent, l'eau est utilisée comme corps de référence pour la densité des liquides et des solides. Dans ce cas, la masse volumique de l'eau est prise égale à 1 000 kg.m-3 (ou à 1 kg.dm-3, ou à 1 kg/L, ou encore 1 g/cm3). Il s'agit de la masse volumique de l'eau à 3,98 °C[5] et à pression atmosphérique. En effet, l'eau possède une particularité parmi les liquides : sa densité et sa masse volumique sont maximales, non pas à sa température de fusion (0 °C) comme la plupart des liquides, mais à 3,98 °C. Or en métrologie, le fait de prendre comme référence une propriété physique qui passe par un extremum est très intéressant : au voisinage de cet extremum la propriété physique varie très peu. Ainsi au voisinage de 3,98 °C, une imprécision sur la détermination de la température exacte affecte très peu la masse volumique de l'eau et donc le résultat d'une mesure de densité.
La densité devient :
où ρcorps est la masse volumique du corps considéré et ρeau est la masse volumique de l'eau (1000 kg/m3).
Pour corriger les valeurs mesurées à d'autres températures que la température de référence, il faut exploiter la courbe de variation de la masse volumique de l'eau en fonction de la température pour en déduire la masse volumique des matériaux à la température des mesures.
Densité et flottabilité
La densité peut indiquer la flottabilité d'un corps par rapport à l'eau douce. En effet, si la densité d'un corps est supérieure à 1 comme pour une vis métallique (voir illustration) le corps en question coule dans l'eau. À l'inverse, si la densité d'un corps est inférieure à 1 comme pour un bouchon de liège (voir illustration) le corps en question flotte sur l'eau. Dans l'eau de mer ou une solution saline à gradient de salinité, ces chiffres sont à ajuster.
Cas particulier de l'eau liquide
D'une manière générale quand un corps liquide refroidit sa densité augmente et devient maximale à la température de solidification. De plus le corps solide est généralement plus dense que le corps liquide. L'eau fait exception : sa densité maximale est atteinte non pas à 0 °C mais à 3,98 °C et la glace est moins dense que l'eau liquide. Cette particularité permet à l'eau tiède, à l'eau très froide et à la glace de flotter sur de l'eau à 3,98 °C. Si l'eau se comportait comme la plupart des autres corps, la glace tomberait au fond des lacs, des rivières et des océans, où la vie serait alors pratiquement impossible, du moins sous la forme que nous connaissons.
Parmi les métaux moins denses à l'état solide qu'à l'état liquide, il existe l'argent et le bismuth. Cela pose des problèmes importants lors du moulage, à cause du gonflement qui accompagne la solidification.
Densité des principaux métaux utilisés
Métaux usuels symbole densité Platine Pt 21,5 Or Au 19,25 Mercure Hg 13,56 Plomb Pb 11,35 Argent Ag 10,47 Bismuth Bi 9,82 Cuivre Cu 8,78 Nickel Ni 8,27 Etain Sn 7,29 Fer Fe 7,20 Zinc Zn 6,86 Aluminium Al 2,70 Magnésium Mg 1,43 Sodium Na 0,97 Les quatorze métaux usuels du tableau ci-dessus ont été choisis en 1886 par Gaston Tissandier[8].
Densité et flottation des minerais métalliques
Les minerais qui contiennent de fortes teneurs en métaux lourds ou les métaux denses à l'état natif dispersés dans une gangue peuvent être séparés facilement des impuretés terreuses par effet de masse ou d'inertie, c'est-à-dire de moindre entraînement, dans un flux d'eau sur un plan incliné. C'est la séparation gravimétrique.
D'autres minerais, plus légers, peuvent être rendus flottables à l'aide de savons ou corps tensioactifs spécifiques dans des bains plus ou moins agités. Ce sont les procédés industriels de flottation.
Densité des liquides biologiques en médecine
Les densités ne servent que rarement en sciences médicales. Dans un ouvrage de référence, on ne trouve que le liquide sudoral du test de mucoviscidose et le liquide d'épanchement séreux[9]. L'essentiel des données est exprimé en concentrations massique ou molaire.
Il est fréquent, fruit de la confusion avec la terminologie anglo-saxonne exposée plus haut, que ce qui soit appelé densité des urines, du sang ou de tout liquide biologique, soit simplement la masse volumique exprimée en g/L du liquide. Ainsi, la densité du sang que l'on peut lire sur les résultat de laboratoire est supérieure à 1000 (g/L).
Annexes
Notes et références
- ↑ Bureau international des poids et mesures (BIPM), « Unité des grandeurs sans dimension »
- ↑ J.P. Mathieu, A. Kastler, P. Fleury, Dictionnaire de Physique, 2eédition, Masson Eyrolles, Paris, 1985 (ISBN 2-225-80479-6) ou simplement Le Petit Larousse 2008, éd. Larousse, Paris (ISBN 978-2-03-582503-2), p. 303
- ↑ Littré, « Définition du mot densité »
- ↑ « Résolution 12 de la 11e réunion de la CGPM (1960) », sur le site bipm.org
- ↑ a et b P. Giacomo, « Rapport BIPM-1970/03. Masses volumiques »
- ↑ Élie Lévy, Dictionnaire de physique, PUF, Paris, 1988, p. 217
- ↑ Mémento technique de l'eau Tome 1, Degrémont, 1989, Annexe Formulaire
- ↑ Les récréations scientifiques ou l'enseignement par les jeux, la physique sans appareil, la chimie sans laboratoire, la maison d'un amateur de science..., Paris Masson, 1886, 323 pages
- ↑ Dictionnaire des constantes biologiques et physiques en médecine, applications cliniques pratiques, 6° édition, Maloine, Paris, 1991 ISBN 2-224-01907-6
Articles connexes
- Portail de la physique
Catégories : Grandeur sans dimension | Propriété chimique
Wikimedia Foundation. 2010.