- E-330
-
Acide citrique
Acide citrique 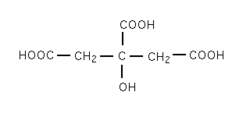
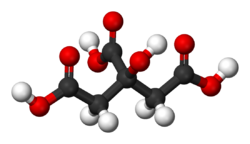
Formule semi-développée et représentation 3D de l'acide citrique. Général Nom IUPAC acide 3-carboxy-3-hydroxypentanedioïque Synonymes acide 2-hydroxy-1,2,3-Propanetricarboxylique No CAS (anhydre)
(monohydrate)No EINECS PubChem No E E330 FEMA Apparence cristaux incolores. (anhydre)[1].
cristaux blancs, faiblement deliquescents. (monohydrate)[2]Propriétés chimiques Formule brute C6H8O7 [Isomères] Masse molaire 192,1235 g∙mol-1
C 37,51 %, H 4,2 %, O 58,29 %,pKa 3,13
4,76
6,40Propriétés physiques T° fusion 426 K (153 °C)[3] T° ébullition Se décompose au-dessous du point d'ébullition à 175 °C[2] Solubilité Soluble dans l'eau 592 g⋅L-1 à 20 °C)[3].
Soluble dans l'éthanol (383 g⋅L-1 à 25 °C).
Insoluble dans le chloroforme.Masse volumique 1.5 g/cm³[2] T° d’auto-inflammation 1 010 °C[2] Point d’éclair 100 °C[1] Limites d’explosivité dans l’air en volume % dans l'air : 0.28-2.29[1] Précautions Directive 67/548/EEC 
XiPhrases R : 36, Phrases S : 26, SIMDUT[5],[6] Acide citrique :
Acide citrique monohydraté :

Inhalation Toux. Essoufflement. Mal de gorge. Peau Rougeur. Yeux Rougeur. Douleur. Ingestion Douleurs abdominales. Mal de gorge. autre Combustible. Les particules finement dispersées forment des mélanges explosifs dans l'air.[4] Écotoxicologie LogP -1.7[1] Unités du SI & CNTP, sauf indication contraire. L'acide citrique est un triacide carboxylique de formule C6H8O7.
Sommaire
Description
L'acide citrique joue un rôle central dans le métabolisme de tous les organismes vivants.
L'acide citrique est naturellement présent dans le citron en grande quantité (il intervient pour plus de 95 % dans l'acidité de ce fruit). C'est en fait un intermédiaire du métabolisme des organismes aérobies, et c'est aussi l'autre nom du cycle de Krebs (cycle de l'acide citrique). Il est formé, au cours de ce cycle, par condensation d'acétyl-CoA et d'oxaloacétate, par la citrate synthétase. L'homme, par exemple, en produit environ 2 kilogrammes par jour, qui sont décomposés immédiatement.
L'acide citrique est biodégradable et n'est pas toxique pour l'homme ni pour l'environnement. Cependant, il est irritant et peut provoquer des brûlures s'il entre en contact prolongé avec des muqueuses : il doit donc être utilisé avec quelques précautions (port de gants notamment).
La dissociation de l'acide citrique se fait en trois étapes réversibles.
Usages
- L'acide citrique est un additif alimentaire (numéro E330[7]) utilisé dans l'industrie alimentaire comme acidifiant (soda), correcteur d’acidité, agent de levuration, dans la composition d'arôme (Numéro FEMA/GRAS 2306);
- produits cosmétiques et pharmaceutiques ;
- peut provoquer des allergies cutanées, il est donc à manipuler avec précaution ;
- boissons gazeuses sous forme de citrate de magnésium (Mg3(C6H5O7)2,4H2O
- anticoagulant sanguin ;
- réduction de la rouille ;
- fabrication de pâte à modeler artisanale ;
- fongicide, bactéricide, anti-algues (lutte contre les lichen).
- complexant du fer dans les vins pour retarder la casse ferrique
- L'acide citrique est également utilisé comme bain d'arrêt en photographie argentique.
Histoire et production
En Angleterre, en 1869, un médecin a obtenu, sous forme cristalline, de l'acide citrique. En mélangeant du jus de citron saturé avec du lait de Chaux, que l'on décompose par de l'acide sulfurique, on obtient de l'acide citrique. L'intermédiaire de cette réaction est le citrate de calcium.
Bien que, dès 1893, on ait eu l'idée que des champignons filamenteux contenaient de l'acide citrique, ce n'est qu'en 1923 que le citrate a été isolé d'une culture fongique fermentée. Cette méthode effectuée en laboratoire à petite échelle (sur pétris) a été élargie pour soutenir la demande d'acide citrique où il est maintenant produit dans de larges réservoirs rotatifs. On le prépare donc par fermentation d'une solution sucrée, telle la mélasse.
En Belgique, Alphonse Cappuyns, étudiant à Leuven, commença à étudier la production d'acide citrique par voie biologique en 1916. D'abord en cultivant des 'citromyces' (?) sur du sucre raffiné, ensuite avec des 'Aspergillus Niger-schimmel'. La production industrielle économique par voie biologique devint possible et une société belgo-italienne, 'La Citrique Belge' fut fondée en 1929.
Acide citrique et vin
L’acide citrique est présent dans les raisins de tout cépage et en plus grande quantité dans les moûts concentrés par la pourriture ou le passerillage des raisins. Les teneurs en acide citrique des vins sont très variables. Beaucoup de vins rouges en sont dépourvus. En effet, parallèlement à la fermentation malolactique qu'elles provoquent, beaucoup de bactéries lactiques font fermenter l’acide citrique, en donnant lieu surtout à la formation d’acide acétique. L’acide citrique possède à un haut degré la propriété d’engager le fer ferrique dans un anion complexe double. Pour cette raison, il est utilisé de façon courante dans le traitement de la casse ferrique. On l’utilise encore pour remonter l’acidité fixe et ainsi améliorer l’acidité gustative d’un vin surtout dans les vins blancs secs. Son emploi dans les vins rouges appelle quelques réserves, car il n’y est pas très stable et risque d’être fermenté par bactéries lactiques avec augmentation d’acidité volatile.
Notes et références
- ↑ a , b , c et d ACIDE CITRIQUE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- ↑ a , b , c et d ACIDE CITRIQUE, MONOHYDRATE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- ↑ a et b (en)Citric acid RN: 77-92-9 sur ChemIDplus
- ↑ Fiches Internationales de Sécurité Chimique : ACIDE CITRIQUE - ICSC: 0855 sur NIOSH
- ↑ « Acide citrique » dans la base de données de produits chimiques Reptox de la CSST (organisme canadien responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- ↑ « Acide citrique monohydraté » dans la base de données de produits chimiques Reptox de la CSST (organisme canadien responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- ↑ Parlement européen et Conseil de l'europe, « La Directive 95/2/CE concernant les additifs alimentaires autres que les colorants et les édulcorants », dans Journal officiel de l'Union européenne, no L 61, 20/02/1995, p. 1-56 [texte intégral (page consultée le 19/05/2008)]. [pdf]
Annexes
Articles connexes
Liens et documents externes
- (en) CITRIC ACID COMPENDIUM OF FOOD ADDITIVE SPECIFICATIONS - Addendum 7 - Joint FAO/WHO Expert Committee on Food Additives 53rd session - Rome, 1-10 June 1999
- Portail de la chimie
Catégories : Produit chimique irritant | Produit chimique corrosif | Acide dicarboxylique | Intermédiaire de métabolisme | Produit chimique domestique | Saveur acide | Régulateur alimentaire de pH | Séquestrant
Wikimedia Foundation. 2010.

