- Bromométhane
-
Bromométhane 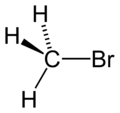
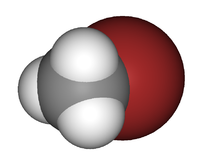
Général Synonymes Bromure de méthyle
MonobromométhaneNo CAS No EINECS PubChem ChEBI SMILES InChI Apparence gaz comprimé liquéfié, incolore et inodore[1]. Propriétés chimiques Formule brute CH3Br [Isomères] Masse molaire[3] 94,939 ± 0,002 g·mol-1
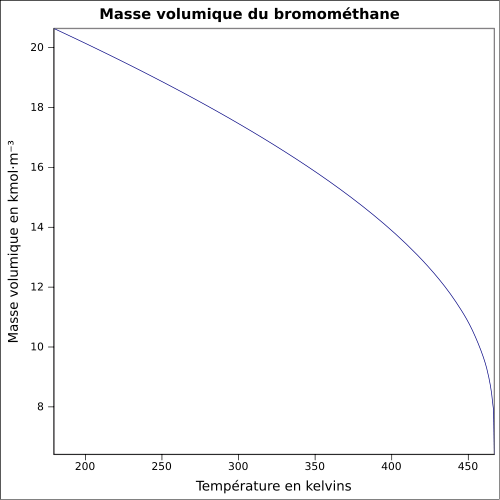
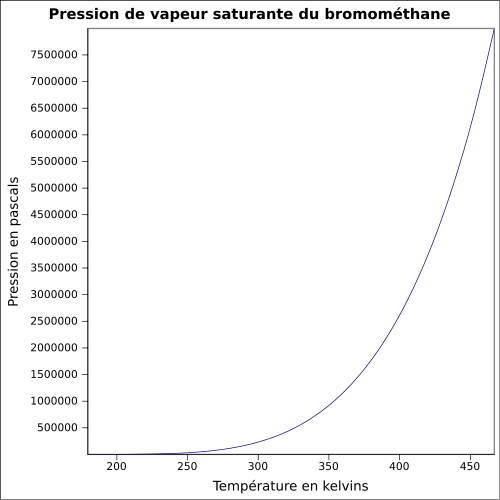
C 12,65 %, H 3,19 %, Br 84,16 %,Moment dipolaire 1,8203 ± 0,0004 D [2] Propriétés physiques T° fusion -93,66 °C [4] T° ébullition 3,56 °C [4] Solubilité dans l'eau à 20 °C : 1.5 ml/100 ml[1] Masse volumique 3,9739 g·cm-3 (0 °C,1 013 mbar) [4] T° d'auto-inflammation 537 °C[1] Point d’éclair < 194 °C [4] Limites d’explosivité dans l’air 8,6–20 %vol [4] Pression de vapeur saturante 1,89 bar à 20 °C
2,6 bar à 30 °C
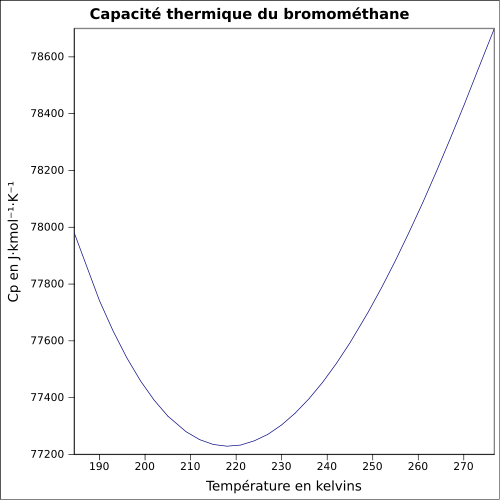
4,9 bar à 50 °C [4]Point critique (194 °C), 52,3 bar, 0,577 kg·l-1 [4] Point triple (-93,7 °C), 0,002 bar [4] Thermochimie S0liquide, 1 bar 155,14 J·K-1·mol-1 [6] ΔfH0gaz -34,3 kJ·mol-1 [6] ΔfH0liquide -60,6 kJ·mol-1 [6] ΔfusH° 6,0 kJ·mol-1 à -93,65 °C [6] ΔvapH° 23,24 kJ·mol-1 [6] Cp 114,6 J·K-1·mol-1 (liquide,9,85 °C) [6] Propriétés électroniques 1re énergie d'ionisation 10,541 ± 0,003 eV (gaz)[8] Précautions Directive 67/548/EEC[10] 
T
NPhrases R : 23/25, 36/37/38, 48/20, 50, 59, 68, Phrases S : 1/2, 15, 27, 36/39, 38, 45, 59, 61, Transport[4] 26 1062 NFPA 704 SIMDUT[11] 

SGH[12] 



DangerClassification du CIRC Groupe 3 : Inclassable quant à sa cancérogénicité pour l'Homme[9] Ingestion Autre dépression
du système nerveux central.
Dommages au foie et aux reins.
Arrêt respiratoire.Écotoxicologie LogP 1,19 [1] Seuil de l’odorat bas : 20 ppm
haut : 1 000 ppm[13]Unités du SI & CNTP, sauf indication contraire. Le bromométhane ou bromure de méthyle est un composé chimique organique halogéné dont la formule chimique est la suivante : CH3Br.
C'est un gaz toxique, sans couleur et ininflammable sans odeur distinctive. Ses propriétés chimiques sont tout à fait semblables à celle du chlorométhane. Le bromométhane est commercialisé sous différents noms dont les plus connus sont l’Embafume et le Terabol. Il est aussi connu sous l'appellation R40B1. C'est un pesticide (insecticide), de la famille des biocides. Il fait partie des gaz qui détruisent la couche protectrice d'ozone. Il fait partie des gaz réfrigérants.
Sommaire
Origine
Le bromométhane existe en petite quantité dans la nature où il se forme naturellement dans l’océan, probablement synthétisé par les algues et le varech. Il provient également de certaines plantes terrestres, notamment celles de la famille des brassica. Industriellement, il est fabriqué par réaction du méthanol avec l’acide bromhydrique.
Utilisations
Jusqu'à ce que sa production et son usage aient été proscrits par le protocole de Montréal, il était couramment et massivement employé comme agent de stérilisation des sols, principalement pour la production de semences mais également pour certaines cultures maraîchères comme les fraises.
Dans la production de semences, à la différence des cultures végétales, il est d'une importance vitale d’éviter de contaminer la récolte avec d’autres variétés de graines de la même espèce. Par conséquent, les herbicides sélectifs ne peuvent pas être employés. Même s'il est dangereux d'employer le bromométhane, son usage est considérablement plus sûr et plus efficace que celui des rares autres produits disponibles pour la stérilisation des sols. La suppression de son utilisation pour la production de semences a eu comme conséquence des changements importants dans les pratiques culturales, avec un recours accru aux techniques de désherbage mécanique et aux périodes de jachère.Le bromométhane a été également utilisé comme fumigant d'usage universel pour éliminer une grande variété de nuisibles, des rats aux insectes, en passant par les champignons microscopiques. Il l'est encore pour certains usages (désinfection de bois importés). Il sert également de précurseur pour la fabrication d'autres produits chimiques, et il a été utilisé comme solvant pour l’extraction des huiles à partir des graines et comme dégraissant de la laine.
Lorsque le protocole de Montréal a sévèrement restreint l'utilisation du bromométhane au plan international, certains pays, dont les États-Unis ont incité à des dérogations pour l’emploi du produit en usage contrôlé. En 2004, la dernière année pour laquelle les données sont disponibles, plus de 3000 tonnes de bromométhane ont été pulvérisées dans les champs californiens.
Destruction de la couche d’ozone
Le bromométhane est sur la liste des substances interdites par le protocole de Montréal à cause des risques de destruction de la couche d’ozone. Puisque le brome est 60 fois plus nocif que le chlore, même une faible quantité de bromométhane suffit à causer des dommages considérables à la couche d'ozone. En 2005 et 2006, cependant, on lui a accordé une dérogation pour un usage contrôlé dans le cadre du protocole de Montréal.
Controverses
Le bromométhane est utilisé pour préparer les terrains de golf et le gazon des surfaces utilisées pour différentes compétitions sportives, en particulier dans les Bermudes. Le protocole de Montréal stipule que l'usage du bromométhane doit être interdit. L’administration de George W. Bush a adopté des dérogations pour empêcher la désorganisation des marchés.
Une évaluation des risques a été mise à jour en 2010 par l'EFSA [14]
Effets sur la santé
S’il est inhalé à une concentration élevée pendant une période courte, il provoque des maux de tête, des vertiges, des nausées, des vomissements des malaises. Ces symptômes peuvent être suivis de signes d'excitation nerveuse, convulsions et même de troubles psychiques aigus à type d’agitation maniaque. L’inhalation prolongée à des concentrations plus faibles peut causer une irritation bronchique et des troubles pulmonaires.
Le liquide brûle la peau, provoque des démangeaisons et un érythème, puis des phlyctènes plusieurs heures après contact. Le liquide et le gaz provoquent des brûlures oculaires sévères.
Les niveaux d'exposition pouvant provoquer la mort varient de 1 600 à 60 000 ppm, suivant la durée de l'exposition.
Les atteintes respiratoires, rénales, et neurologiques concernent davantage de personnes. Aucun cas d’effets graves à long terme sur le système nerveux n'a été noté chez l’homme à la suite d’une exposition à des niveaux faibles, mais des études sur les lapins et les singes ont montré des lésions qualifiées de modérées à graves.
Production et dégradation
Les sources de production du CH3Br comprennent la production océanique, les émissions des plantes et des marais, la combustion de la biomasse, la fumigation des sols, et les gaz d’échappement des véhicules fonctionnant au carburant plombé, ainsi que l’industrie, la production de biens de consommation durable et de denrées périssables. Sa production industrielle décline, mais n'a pas été stoppée, y compris en France[15]
La dégradation du polluant se fait par décomposition photochimique dans l'atmosphère (réaction avec le radical chimique hydroxyle(OH)) et par oxydation[16] (qui donne comme produits secondaires BrC(O)CH3 et BrC(O)H), ou par photodécomposition à des altitudes plus élevées.
A ces moyens d’élimination il faut ajouter les pertes (adsorption, dégradation) dans les sols, la dégradation chimique et biologique dans l'océan, et un certain recyclage par les plantes vertes.Notes et références
- BROMURE DE METHYLE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- (en) David R. Lide, Handbook of chemistry and physics, CRC, 16 juin 2008, 89e éd., 2736 p. (ISBN 142006679X et 978-1420066791), p. 9-50
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- Entrée de « Bromomethane » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 19 février 2009 (JavaScript nécessaire)
- (en) Robert H. Perry et Donald W. Green, Perry's Chemical Engineers' Handbook, USA, McGraw-Hill, 1997, 7e éd., 2400 p. (ISBN 0-07-049841-5), p. 2-50
- (en) « Methyl bromide » sur NIST/WebBook, consulté le
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams, vol. 1, 2 et 3, Huston, Texas, Gulf Pub. Co., 1996 (ISBN 0-88415-857-8, ISBN 0-88415-858-6, ISBN 0-88415-859-4)
- (en) David R. Lide, Handbook of chemistry and physics, CRC, 2008, 89e éd., 2736 p. (ISBN 9781420066791), p. 10-205
- IARC Working Group on the Evaluation of Carcinogenic Risks to Humans, « Evaluations Globales de la Cancérogénicité pour l'Homme, Groupe 3 : Inclassables quant à leur cancérogénicité pour l'Homme » sur http://monographs.iarc.fr, CIRC, 16 janvier 2009. Consulté le 22 août 2009
- « bromométhane » sur ESIS, consulté le 4 février 2010
- « Bromométhane » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- Methyl bromide sur hazmap.nlm.nih.gov. Consulté le 14 novembre 2009
- EFSA 12/01/11 <Peer Review of the pesticide risk assessment of the active substance methyl bromide
- |http://www.ifen.fr/uploads/media/couche_ozone_01.pdf Données actuelles et prospectives de production pour la France]
- Atmospheric Oxidation Mechanism of Bromoethane
Liens externes
- (fr)Fiche toxicologique de l'INRS
- (fr)Fiche canadienne sur la Lutte antiparasitaire durable et intégrée suppression du bromure de méthyle, 41p,
- MSDS : Hazardous Chemical Database
- ChemSub Online (Bromométhane).