- Dodécaédrane
-
Dodécaédrane 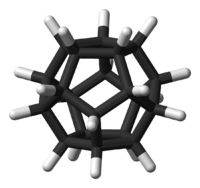
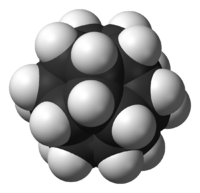
Général Nom IUPAC (C20-Ih)[5]fullerane Synonymes - hexadécahydro-5,2,1,6,3,4-[2,3]butanediyl[1,4]diylidènedipentaléno[2,1,6-cde:2',1',6'-gha]pentalène
- undécacyclo[9.9.0.02,9.03,7.04,20.05,18.06,16.08,15.010,14.012,19.013,17]icosane
No CAS PubChem ChEBI SMILES InChI Propriétés chimiques Formule brute C20H20 [Isomères] Masse molaire[1] 260,3728 ± 0,0174 g·mol-1
C 92,26 %, H 7,74 %,Propriétés physiques T° fusion > 450 °C Unités du SI & CNTP, sauf indication contraire. Le dodécaédrane est un composé organique de formule C20H20 et synthétisé pour la première fois par Leo Paquette (en) de l'Ohio State University (Université d'État de l'Ohio) en 1982, essentiellement en raison de la « plaisante et esthétique symétrie de la structure dodécaédrique »[2],[3].Dans cette molécule[4], chaque sommet d'un dodécaèdre est occupé par un atome de carbone qui est lié à trois autres atomes de carbone occupant les sommets voisins et à un atome d'hydrogène. L'angle de 108 ° dans chaque pentagone régulier est proche de l'angle idéal de liaison de 109,5 ° pour une hybridation sp3 des orbitales atomiques du carbone. La molécule a une symétrie Ih (comme le buckminsterfullerène, C60, un icosaèdre tronqué). Ainsi son spectre RMN du proton consiste en un unique déplacement chimique à 3,38 ppm. C'est un des hydrocarbures de Platon comme le cubane et le tétraédrane ; il n'existe pas naturellement.
Synthèse totale
Sur plus de 30 ans, plusieurs groupes de recherche ont activement poursuivi la synthèse totale du dodécaédrane comme but. Un article de revue publié en 1978 compilait juste les différentes stratégies qui existaient jusque là[5]. Le premier essai fut lancé en 1964 par Robert Burns Woodward avec la synthèse du triquinacène (en) qu'il espérait capable de se dimériser simplement en dodécaèdrène. D'autres groupes ont ensuite rejoint la course, par exemple Philip Eaton et Paul von Ragué Schleyer (en).
La synthèse de Leo Paquette (en) de 1982 nécessite 29 étapes avec comme composés de départ le cyclopentadiène (2 équivalents = 10 atomes de carbone), l'éthynedicarboxylate de diméthyl (1 équivalent = 4 atomes de carbone) et le allyltriméthylsilane (2 équivalents = 6 atomes de carbone).
Au début de la procédure[6], deux molécules de cyclopentadiène 1 sont couplées ensemble par réaction avec du sodium élémentaire (formant un complexe cyclopendadiènyl) et de l'iode, pour former du dihydrofulvalène 2. Ensuite une réaction de Diels-Alder en tandem (en) avec le diméthyl acétylènedicarboxylate 3 forme la séquence désirée pentadiène-acétylène-pentadiène dans l'adduit symétrique 4. Une quantité égale de l'adduit asymétrique 4b est produite et est écartée.
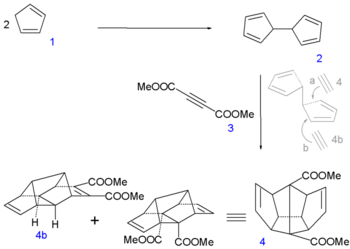
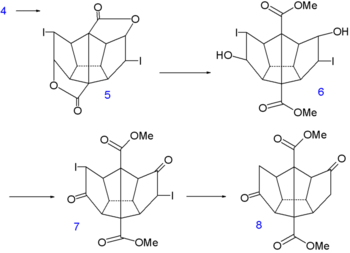
Synthèse du dodécaédrane - partie I Synthèse du dodécaédrane - partie II Dans l'étape suivante de la synthèse[7], des atomes d'iode sont temporairement introduits via une iodo lactamisation du diacide de 4 vers la dilactone 5. Puis les groupes lactone sont ouverts avec du méthanol ce qui donne le composé 6 dont les groupes alcool sont convertis en cétone dans 7 par une oxydation de Jones et les atomes d'iode sont réduits dans 8 avec un couple zinc-cuivre (en).
Les six derniers atomes de carbone sont insérés par une addition nucléophile, sur les groupes cétone, des carbanions 10 obtenus par l'action du n-butyllithium sur l'allyltriméthylsilane 9. Dans l'étape suivante, le vinyl silane 11 réagit avec l'acide peracétique dans l'acide acétique via une substitution radicalaire (en) vers la dilactone 12, suivi par une alkylation de Friedel-Crafts intramoléculaire (en) avec le pentoxyde de phosphore vers la dicétone 13. Ce composé contient les 20 atomes de carbone requis et est aussi symétrique ce qui facilitera la construction des cinq liaisons carbone-carbone restantes.
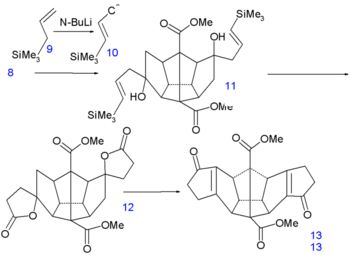
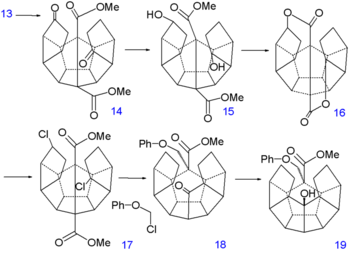
Synthèse du dodécaédrane - partie III Synthèse du dodécaédrane - partie IV La réduction des doubles liaisons de 13 vers 14 est faite par hydrogénation avec du palladium sur charbon actif et celle des groupes cétone vers des groupes alcool dans 15 par le borohydrure de sodium. Le remplacement des hydroxyl par des atomes de chlore dans 17 via une substitution nucléophile aliphatique (chlorure de tosyle) prend place via l'ouverture de la dilactone 16. La première réaction de formation de liaison C-C est une espèce d'alkylation de Birch (lithium, ammoniac) dont un anion intermédiaire est piégé par le chlorométhyl phényl éther, l'autre atome de chlore de 17 est simplement réduit. Cet appendice phénoxy temporaire va plus loin prévenir une énolisation indésirable. Le groupe cétone nouvellement formé dans 18 forme alors une autre liaison C-C par une réaction de Norrish (en) photochimique dans 19.
Le groupe alcool de 19 est induit dans une réaction d'élimination avec le TsOH pour former l'alcène 20. La double liaison est réduite par l'hydrazine dans 21 qui, subissant successivement une autre réduction par le DIBAL vers l'alcool et une oxydation avec le chlorochromate de pyridinium, forme l'aldéhyde 22. Une seconde réaction de Norrish ajoute alors une autre liaison C-C sur l'alcool 23. Le groupe phénoxy ayant accompli son service est éliminé en plusieurs étapes : réduction de Birch vers le diol 24, oxydation avec le chlorochromate de pyridinium qui produit le cétoaldéhyde 25 et condensation de Claisen inverse vers la cétone 26.
Une troisième réaction de Norrish produit l'alcool 27, une seconde déshydratation, 28 et une autre réduction 29. À ce point, la synthèse aboutit à un composé sans aucun groupe fonctionnel. La liaison C-C manquante est mise en place par une déshydrogénation sous pression d'hydrogène avec du palladium sur charbon actif à 250 °C vers le dodécaédrane 30.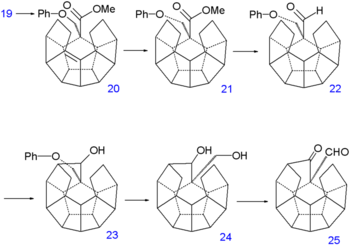
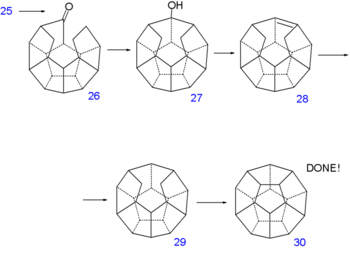
Synthèse du dodécaédrane - partie V Synthèse du dodécaédrane - partie VI Notes et références
(en) Cet article est partiellement ou en totalité issu d’une traduction de l’article de Wikipédia en anglais intitulé « Dodecahedrane ».
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- (en) Dodecahedrane, Robert J. Ternansky, Douglas W. Balogh, and Leo A. Paquette; J. Am. Chem. Soc.; 1982; 104(16) pp 4503-4504. DOI:10.1021/ja00380a040
- (en) Total synthesis of dodecahedrane, Leo A. Paquette, Robert J. Ternansky, Douglas W. Balogh, and Gary Kentgen; (1983); Journal of the American Chemical Society 105(16) pp 5446–5450. [10.1021/ja00354a043 Abstract]
- nom IUPAC : hexadécahydro-5,2,1,6,3,4-[2,3]butanediyl[1,4]diylidènedipentalèno[2,1,6-cde:2',1',6'-gha]pentalène; numéro CAS :
- Towards dodecahedrane, Philip E. Eaton; Tetrahedron(en); 1979; Vol. 35; 19; pp 2189-2223. DOI:10.1016/0040-4020(79)80114-3
- Domino Diels-Alder reactions. I. Applications to the rapid construction of polyfused cyclopentanoid systems, Leo A. Paquette and Matthew J. Wyvratt; J. Am. Chem. Soc.; 1974; 96(14) pp. 4671 - 4673. DOI:10.1021/ja00821a052
- Topologically spherical molecules. Synthesis of a pair of C2-symmetric hexaquinane dilactones and insights into their chemical reactivity. An efficient .pi.-mediated 1,6-dicarbonyl reduction, Leo A. Paquette, Matthew J. Wyvratt, Otto Schallner, Jean L. Muthard, William J. Begley, Robert M. Blankenship, and Douglas Balogh, J. Org. Chem.; 1979; 44(21) pp 3616 - 3630. DOI:10.1021/jo01335a003
Wikimedia Foundation. 2010.
