- Asymétrie moléculaire
-
Chiralité (chimie)
Le concept de la chiralité existe également dans d'autres domaines.
 Pour les articles homonymes, voir Chiralité.
Pour les articles homonymes, voir Chiralité.En chimie, un composé chimique est chiral, du grec « χειρ » (la main), s'il n'est pas superposable à son image dans un miroir. Si une molécule est chirale, elle possède deux formes énantiomères : une lévogyre (« qui tourne à gauche », en latin laevus : gauche) et une dextrogyre (« qui tourne à droite », en latin dextro : droite) qui font tourner un rayonnement polarisé de manière opposée.
Sommaire
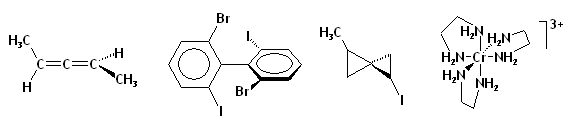
Molécules chirales
La chiralité peut être comparée à un simple problème de chaussures. Tous les enfants ont déjà été confrontés à un problème de chiralité en mettant le pied droit dans la chaussure gauche et inversement. Une chaussure est un objet chiral car elle n'est pas superposable à son image dans un miroir, tout comme les mains. Les molécules peuvent également être des objets chiraux.
Molécules contenant un « carbone asymétrique »
La distribution d'atomes différents dans l'espace, par exemple autour d'un point, peut conduire à des situations non superposables dans un miroir, donc des objets différents. En général, le carbone tétravalent peut accepter 4 substituants différents sur chacune de ses 4 liaisons, ce qui donne lieu à deux formes non-superposables dans un miroir, des énantiomères dénommés R et S [1]:
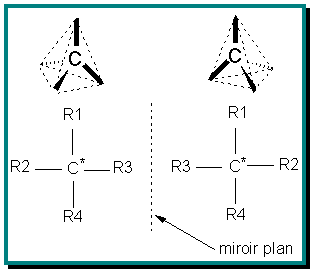
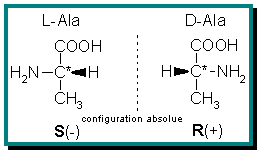
Un tel atome de carbone est habituellement appelé « carbone asymétrique ». La présence d'un tel atome de carbone dans une molécule la rend chirale. Il existe toutefois des exceptions à cette règle, pour les molécules contenant plus d'un carbone asymétrique ( composés méso, voir plus bas). Par exemple, les acides aminés (sauf la glycine) sont des molécules chirales : un acide aminé et son image dans un miroir ne sont pas superposables car la molécule contient un atome de carbone asymétrique (lié à 4 atomes ou groupements d'atomes différents). Voici un exemple : l'acide aminé Alanine (deux énantiomères nommés D et L[2] ce qui correspond aux configurations absolues - définies par l'UIPAC- R et S).
Il est à noter que le concept d'atome de carbone asymétrique, s'il a été utilisé du point de vue historique et est encore employé fréquemment dans l'enseignement de la chimie, ne correspond pas aux recommandations actuelles de l'IUPAC. En effet, le terme correct est chiralité centrale autour d'un atome de carbone. Le carbone portant 4 substituant non identiques est un centre de chiralité[3].
Autres molécules chirales
La chiralité n'est pas limitée au carbone ou aux autres atomes tétravalents :
- complexes métalliques octaédriques et métallocènes peuvent être chiraux. Le cas le plus fréquent est celui des complexes comportant trois ligands bidentes qui donne lieu à un environnement chiral[4].
- molécules possédant un axe de chiralité comme les allènes, les biphényles et les composés spiro.
- molécules possédant un plan de chiralité comme le Z-cyclooctène
- molécules présentant une hélicité comme les hélicènes et de nombreux polymères d'origine biologique comme les protéines et les acides nucléiques.
Formellement, c'est la la symétrie de la molécule qui détermine si elle est chirale ou non chirale (elle est alors appelée achirale). Dans la pratique, une molécule est chirale si et seulement si elle est dépourvue de tout axe de rotation impropre d'ordre n (n entier strictement positif), noté Sn. Il s'agit de la rotation de la molécule de nπ autour de l'axe, suivie d'une réflexion par rapport à un plan perpendiculaire à cet axe. Un axe de rotation impropre d'ordre 1 (S1) est un plan de symétrie (noté σ) et un axe de rotation impropre d'ordre 2 (S2) est un centre de symétrie (noté i).
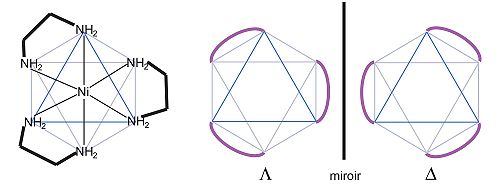
Les énantiomères de complexes métalliques octaédriques possédant 3 ligands bidentes sont dénommés Δ (delta, droit) et Λ (lambda, gauche) et déterminés comme suit :
On dispose l'octèdre sur une face qui regroupe un bout de chaque ligand (on le regarde selon un axe de symétrie d'ordre 3 , la symétrie du complexe est D3), les sommets de l'octaèdre se répartissent sur deux plans. Si un sommet du plan supérieur est lié par un ligand au sommet à sa droite sur le plan inférieur, le complexe est dit droit ou Δ. En revanche, si le sommet inférieur est à sa gauche, le complexe est gauche ou Λ.
Les énantiomères d'allènes, biphényles et des composés spiro sont déterminés par des règles précises de l'IUPAC et sont dénommés aR et aS[5] (a=axe).
Les énantiomères de molécules possédant un plan de chiralité comme le Z-cyclooctène sont notés pR et pS[6] (p=plan).
Pour les molécules comportant un enroulement hélicoïdal, les énantiomères correspondent aux deux sens d'enroulement de l'hélice et sont nommés P (plus) pour l'hélice de pas droit et M (moins) pour l'hélice de pas gauche[7].
Aspects historiques
Une solution faisant tourner le plan de polarisation d'un faisceau de lumière polarisée dans le sens inverse des aiguilles d'une montre contient un isomère optique (−) (c'est le contraire pour un isomère optique (+)). L'effet magnéto-optique est à l'origine de ce phénomène. Cette propriété a été observée pour la première fois par Jean-Baptiste Biot en 1815 et a acquis une importance considérable dans l'industrie des sucres, la chimie analytique et l'industrie pharmaceutique. Louis Pasteur a montré en 1848 que l'activité optique est liée à la chiralité[8](Critère de Pasteur).
En chimie de coordination
Article détaillé : Alfred Werner.Si la chiralité est un propriété très présente dans l'histoire et le présent de la chimie organique qui a pour objet les molécules à base de carbone, il faut souligner l'importance de la chiralité dans l'histoire de la chimie de coordination qui s'interesse aux complexes métallique. C'est sur la base d'arguments basés sur la chiralité qu'Alfred Werner a postulé l'importance de la géométrie octaédrique pour les complexes très communs des métaux de transition qui possèdent 6 ligands. Pour prouver leurs théories, Werner et ses collaborateurs ont dû isoler les formes énantiomériquement pures de complexes métalliques. Par ailleurs, ils ont aussi prouvé que la chiralité en chimie n'était pas seulement associée au carbone en isolant le premier complexe énantiomériquement pur qui ne contenait aucun atome de carbone. Pour ces travaux, il a reçu le prix Nobel de chimie en 1913.
Un objet chiral, deux énantiomères
Un objet chiral ne possède que deux formes différentes possibles appelées énantiomères (du grec enantios « opposé »). Ainsi une chaussure est un objet chiral avec deux énantiomères : la chaussure droite et la chaussure gauche.
C'est exactement pareil pour les molécules : dès qu'une molécule possède une symétrie suffisamment basse, elle existe nécessairement sous la forme de deux énantiomères qui ont les mêmes propriétés physiques symétriques (solubilité, température d'ébullition, etc.) ; ils peuvent cependant être différenciés par une propriété optique, la déviation de la lumière polarisée : l'un des composés la dévie à droite et l'autre à gauche. Par exemple, l'acide lactique existe en deux formes énantiomères : l'acide lévo-lactique et l'acide dextro-lactique.
Nomenclature
Au XIXe siècle, on a montré que certains composés en solution dévient le plan de polarisation de la lumière polarisée. Il y en a qui le dévient à gauche (angle -α) et d'autres à droite (angle +α). Et c'est le cas pour nos énantiomères : il y en a un qui dévie la lumière à droite, il est dit dextrogyre (d), et l'autre qui la dévie à gauche, il est lévogyre (l) au même degré. Ceci permet de les différencier. La nomenclature D/L fait référence elle à la configuration absolue, c'est-à-dire à l'arrangement spatial du composé par référence à l'alanine, un des acides aminés naturels.
Un mot sur la nomenclature utilisée pour désigner la configuration d'un centre de chiralité (l'arrangement dans l'espace des substituants de l'atome tétravalent) : les chimistes disent R/S pour « Rectus, droit » ou « Sinister, gauche » (nomenclature officielle de Cahn-Ingold-Prelog), mais les biologistes continuent d'utiliser l'ancien système D/L. Le premier système est fondé un ordre de priorité convenu des quatre différents substituants du carbone asymétrique ; le système D/L est une désignation graphique dû à Emil Fischer et utilise, pour établir la désignation à donner à une molécule chirale, des corrélations chimiques compliquées à partir du glycéraldéhyde. Il n'y a aucune relation entre les deux systèmes, qui sont basés sur des critères totalement différents. De plus, dans les deux cas, il n'y a aucune relation entre la configuration et les propriétés optiques (dextrogyre ou lévogyre).
Règles de Cahn, Ingold et Prelog
Exemple d'application des règles de Cahn, Ingold et Prelog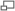
La nomenclature R/S définit la configuration absolue puisqu'elle est applicable à tous types de molécules, sur le base de critères non-ambigus. À chaque carbone asymétrique (C*) est attribué un descripteur R ou S en donnant à chacun de ses substituants une priorité selon le numéro atomique de l'atome lié au C* (la plus grande priorité étant accordée au substituant titulaire du numéro atomique le plus élevé). Si deux substituants sont liés au C* par le même atome, il faut, pour attribuer la priorité, se référer aux autres atomes liés à ce dernier, et ainsi de suite. Ensuite, il s'agit de savoir si les trois substituants prioritaires sont présentés d'une façon horaire (en plaçant conventionnellement le substituant le moins prioritaire à l'arrière) ou anti-horaire. L'isomère R est donc vers la droite, soit une configuration où les substituants prioritaires « tournent » dans le sens horaire. L'isomère S correspond à la rotation anti-horaire. Plusieurs carbones peuvent être asymétriques, donc pour présenter le nom complet de la molécule, on ajoute, devant le nom de la molécule (xR, yS)-, où x et y sont les numéros de position des carbones asymétriques et R et S sont les configurations possibles à chaque carbone chiral. On peut donc avoir du (2S,5R)-5-chlorohexan-2-ol, du (2S,5S)-5-chlorohexan-2-ol, du (2R,5R)-5-chlorohexan-2-ol ou encore du (2R,5S)-5-chlorohexan-2-ol. Parmi ces quatre diastéréoisomères, il y a deux paires d'énantiomères (2S,5R et 2R,5S, puis 2S,5S et 2R,5R) où les chiralités des deux centres stéréogènes ont leurs configurations inversées. En général, n centres d'asymétrie donneront 2n diastéréomères, dont 2n-1 paires d'énantiomères.[9]
Quel énantiomère en biologie ?
Une molécule chirale, un seul énantiomère « naturel » (biologique)
Où est le problème pour la vie ?
Aujourd'hui, les acides aminés « naturels » qui constituent les êtres vivants sont tous L alors que, lorsqu'on les synthétise dans des conditions symétriques (expérience de Miller par exemple), on obtient un mélange 50/50 des formes L et D : c'est un mélange racémique. C'est semblable pour les sucres : tous les glucides « naturels » (biologiques) sont de la série D[10] De manière générale, dans le vivant, un seul énantiomère a été sélectionné à chaque fois que le problème s'est posé. Par exemple, seule la forme L de la vitamine C est assimilée par l'organisme.
Pourquoi et comment la vie a-t-elle systématiquement privilégié une des deux formes ? Comment, c'est un mystère[11]. Mais on peut facilement comprendre pourquoi : c'est une économie de moyens. La vie de tous les jours nous en offre des exemples réussis et d'autres ratés. Ainsi, sauf cas très spéciaux, c'est une grosse économie de moyens que, de par le monde, toutes les vis et tous les écrous soient de pas droit (donc des objets chiraux) ; imaginons la pagaille si les vis et les écrous étaient vendus en mélange racémique (50/50)... Pour la même raison d'économie les deux moteurs d'un avion bimoteur tournent dans le même sens. Par contre la marine militaire s'offre le luxe d'équiper ses bâtiments de paires d'hélices tournant en sens inverse.
On peut « voir » dans certains cadres une « compétition » entre 2 formes asymétriques, comme par exemple le sens de circulation sur route, ou sur rails adjacents. Ainsi dans le monde certains états font rouler à droite et d'autres à gauche. Par exemple, dans les deux pays les plus peuplés au monde, l'Inde et la Chine, on ne conduit pas du même côté : à gauche en Inde et à droite en Chine. Pour un constructeur étranger, il faudra donc prévoir deux chaines de montage pour exporter un même modèle d'automobile. Ce qui constitue un gaspillage énorme que la nature a su éviter. En France, les trains se croisent sur leur droite, ils roulent à gauche sur les rails adjacents ; sauf en Alsace où c'est l'inverse.Pour un début d'explication sur la façon dont l'excès d'un type d'énantiomères des molécules biologiques a été généré, des chercheurs se sont tournés vers l'espace où les phénomènes de radiation peuvent opérer à grande échelle, et c'est l'hypothèse des chercheurs du Argonne National Laboratory aux Etats-Unis[12]. La traversée de corps à forte orientation chirale produit une lumière polarisée. De fortes sources de lumière polarisée ayant été détectées dans la nébuleuse d'Orion[13], on suppose qu'il s'y trouve de grandes quantités de molécules énantiomériquement pures.
Propriétés biologiques différentes des énantiomères
Deux énantiomères possèdent des propriétés identiques dans un environnement symétrique. Ainsi un gant de cuisine plat et symétrique conviendra de la même façon à une main droite ou gauche. Par contre un gant droit ne convient pas à une main gauche. En biochimie, un récepteur lui-même chiral peut donc discriminer entre deux molécules énantiomères. Or, nous sommes construits avec des briques élémentaires chirales (acides aminés, sucres, etc.) et, pour ce qui est du vivant, les conséquences de cette situation sont multiples, tout dépendant de la molécule et de son récepteur biologique :
- Un énantiomère peut être doué d'une propriété biologique intéressante, insecticide par exemple, alors que l'autre demeure totalement inactif. C'est le cas de la deltaméthrine.
- Deux énantiomères peuvent avoir des propriétés différentes. Citons comme exemple l'odeur caractéristique du fenouil et de l'aneth, qui est due à l'un des énantiomères de la carvone, tandis que l'arôme de menthe verte est dû à l'autre. De même façon, les deux énantiomères du citronellal donnent les arômes de citron et d'orange.
Ces propriétés peuvent parfois différer de manière beaucoup plus dramatique : par exemple, l'un peut être un médicament efficace et l'autre un poison. Ce danger n'avait pas été compris jusque dans les années 1970. Auparavant, pour des raisons de coût, il était naturel et courant de synthétiser des médicaments sous forme racémique, en postulant qu'un énantiomère était actif et que l'autre n'avait aucune activité biologique. La thalidomide est un exemple classique d'une faillite dramatique de cette hypothèse : l'analgésique a été commercialisée sous forme racémique, mais l'enantiomère censé être inactif s'est avéré provoquer des malformations fœtales (activité tératogène). Néanmoins, les deux formes pouvant se convertir l'une en l'autre in vivo, il l'effet tératogène n'aurait pas été évité en n'administrant qu'une forme.
Références
- ↑ de Rectus et Sinister, droit et gauche en latin.
- ↑ de D : Dextrogyre et L: Lévogyre c'est à dire tournant à droite ou tournant à gauche ce qui se réfère au pouvoir rotatoire de chaque énantiomère et n'est donc pas absolu : un énantiomère R peut être D ou L selon la molécule et respectivement pour l'énantiomère S.
- ↑ (en) Alexander von Zelewsky, Stereochemistry of Coordination Compounds, Wiley, 1996, New York
- ↑ Contrairement au cas du carbone ou de tout autre atome portant 4 subsituants en géométrie tétraédrique, il n'y a pas ici de chiralité centrée sur un atome (le métal), c'est l'enroulement des ligands qui est globalement responsable de la chiralité (chiralité axiale).
- ↑ Nomenclature de la chiralité axiale
- ↑ Cyclènes
- ↑ hélicité
- ↑ Gallica : "Dissymétrie moléculaire" de Louis Pasteur
- ↑ Dans les cas où la moitié des centres asymétriques miroitent l'autre moitié, et qu'il y a donc un plan de symétrie qui divise la molécule en deux moitiés identiques, l'énantiomère sera superposable et on désigne cet isomère méso, ce qui réduit le nombre de stéréoisomères.
- ↑ . Il n'y a aucun rapport entre la désignation L chez les acides aminés « naturels » et D pour les sucres « naturels », sauf que l'arrangement spatial chez les uns est donné par la biosynthèse à partir des autres à l'aide des procédés énantiospécifiques et énantiosélectifs catalysés par des enzymes. Ces désignations font suite à une convention graphique élaborée par le chimiste Emil Fischer pour différencier les énantiomères et n'ont pas nécessairement rapport avec la direction de la déviation de la lumière polarisée désignée par l (lévogyre) et d (dextrogyre).
- ↑ Uwe Meierhenrich, Amino acids and the asymmetry of life, Springer-Verlag, 2008. ISBN 978-3-540-76885-2
- ↑ [1]
- ↑ Article du CNRS
Voir aussi
Articles connexes
Liens externes
Isomérie en chimie organique Isomèrie de constitution squelette - position - fonction Stéréoisomérie chiralité - carbone asymétrique - stéréocentre - activité optique - configuration absolue
énantiomérie (mélange racémique) - diastéréoisomérie - diastéréoisomérie géométrique - anomérie
synthèse asymétrique - stéréosélectivité - stéréospécificitéAutres conformérie - mésomérie - tautomérie - Portail de la chimie
Catégorie : Stéréochimie
Wikimedia Foundation. 2010.