- Octaoxygène
-
Oxygène solide
L'oxygène solide désigne le dioxygène O2 refroidi en-dessous de son point de congélation, soit 54,36 K (–218,79 °C) à pression atmosphérique. Comme l'oxygène liquide, il est d'apparence claire avec une légère teinte bleutée due à l'absorption de la lumière rouge (et non à la diffusion Rayleigh donnant la couleur bleue de l'atmosphère). Les molécules de dioxygène O2 sont particulièrement étudiées car elles comptent parmi les rares molécules dotées d'un moment magnétique et qu'elles en sont la plus simple, étant diatomiques. Il en résulte que la structure cristalline de l'oxygène solide serait déterminée par le spin des molécules de dioxygène[1] à travers leur moment magnétique[2]. A très haute pression, l'oxygène solide cesse d'être isolant pour devenir métallique[3] et devient même supraconducteur aux très basses températures[4].
Sommaire
Transitions de phase
La structure de l'oxygène solide est étudiée depuis les années 1920 et six phases cristallines sont à présent décrites de façon certaine[1],[5] :
- Phase α bleu clair à pression atmosphérique et à moins de –249,35 °C à cristaux monocliniques
- Phase β bleu pâle, à pression atmosphérique et moins de –229,35 °C à cristaux rhomboédriques (débute la conversion en tétraoxygène O4) à pression atmosphérique et température élevée)
- Phase γ rose à pression atmosphérique et moins de –218,79 °C à cristaux cubiques
- Phase δ orange à température ambiante sous une pression d'environ 9 GPa
- Phase ε rouge à noire, à température ambiante et pression supérieure à 10 GPa
- Phase ζ métallique sous une pression supérieure à 96 GPa
L'oxygène commence par se solidifier à pression atmosphérique sous une phase dite « β » à cristaux rhomboédriques, puis, en augmentant la pression, connaît une transition en phase δ orange à 9 GPa et en phase ε rouge à 10 GPa ; la couleur rouge s'assombrit au fur et à mesure qu'on augmente la pression, jusqu'à devenir noire. En poursuivant la compression de la phase ε, une transition s'opère vers 96 GPa vers la phase ζ métallique[5].
Structure de l'oxygène rouge
La transition de phase à 10 GPa s'accompagne d'une nette diminution de volume[6] et d'un changement de couleur de l'orange bleuté au rouge profond[7]. Cette phase ε a été découverte en 1979 mais sa structure est demeurée obscure. A partir de son spectre d'absorptioninfrarouge, on a émis l'hypothèse en 1999 qu'il pouvait s'agir de molécules de tétraoxygène O4 disposées dans un réseau cristallin[8]. Il est apparu néanmoins en 2006 par diffractométrie de rayons X que cette phase ε est en fait constituée de molécules d'octaoxygène O8[9],[10]. Cette structure n'avait pas été prédite[5], s'agissant d'un groupe O8 rhomboédrique[11] de quatre molécules de dioxygène O2 :
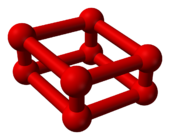

Modèle d'une molécule O8
comme complexe (O2)4Arrangement cristallin de
la phase ε (oxygène rouge)Les dimensions des complexes O8 à 11 GPa sont de[5] :
- 120 pm pour les liaisons O=O des molécules de dioxygène O2
- 234 pm pour les liaisons O2–O2 dans les tétramères (O2)4
- 266 pm entre tétramères (O2)4
L'oxygène rouge est une phase assez inhabituelle, en ce qu'elle a une couleur rouge très prononcée, une très forte absorption infrarouge et que ses propriétés magnétiques changent radicalement[1]. Les études par diffractométrie de rayons X et spectrométrie ont révélé une symétrie monoclinique C2/m, tandis que sa forte absorption dans l'infrarouge a été attribuée à l'association des molécules de dioxygène O2 dans de grands complexes.
Oxygène métallique
La phase ζ d'oxygène métallique apparaît au-delà de 96 GPa par compression de la phase ε d'oxygène rouge[6]. Elle a été découverte en 1990 sous une pression de 132 GPa[3]. Elle présente un éclat métallique[12] et devient supraconductrice à basse température[4],[5]
Notes et références
- ↑ a , b et c Freiman, Y. A. & Jodl, H. J., « Solid oxygen », dans Phys. Rep., vol. 401, 2004, p. 1–228 [lien DOI]
- ↑ Goncharenko, I. N., Makarova, O. L. & Ulivi, L., « Direct determination of the magnetic structure of the delta phase of oxygen », dans Phys. Rev. Lett., vol. 93, 2004, p. 055502 [lien DOI]
- ↑ a et b Desgreniers, S., Vohra, Y. K. & Ruoff, A. L., « Optical response of very high density solid oxygen to 132 GPa », dans J. Phys. Chem., vol. 94, 1990, p. 1117–1122 [lien DOI]
- ↑ a et b Shimizu, K., Suhara, K., Ikumo, M., Eremets, M. I. & Amaya, K., « Superconductivity in oxygen », dans Nature, vol. 393, 1998, p. 767–769 [lien DOI]
- ↑ a , b , c , d et e Solid Oxygen ε-Phase Crystal Structure Determined Along With The Discovery of a Red Oxygen O8 Cluster
- ↑ a et b Yuichi Akahama, « New High-Pressure Structural Transition of Oxygen at 96 GPa Associated with Metallization in a Molecular Solid », dans Physical Review Letters, vol. 74, no 23, June 1995, p. 4690–4694 [texte intégral lien DOI]
- ↑ Malcolm Nicol, « Oxygen Phase Equilibria near 298 K », dans Chemical Physics Letters, vol. 68, no 1, December 1979, p. 49–52 [lien DOI]
- ↑ Federico A. Gorelli, « The ε Phase of Solid Oxygen: Evidence of an O4 Molecule Lattice », dans Physical Review Letters, vol. 83, no 20, November 1999, p. 4093–4096 [texte intégral lien DOI]
- ↑ Hiroshi Fujihisa, Yuichi Akahama, Haruki Kawamura, Yasuo Ohishi, Osamu Shimomura, Hiroshi Yamawaki, Mami Sakashita, Yoshito Gotoh, Satoshi Takeya, and Kazumasa Honda, « O8 Cluster Structure of the Epsilon Phase of Solid Oxygen », dans Phys. Rev. Lett., vol. 97, 2006, p. 085503 [texte intégral lien DOI (pages consultées le 2008-01-10)]
- ↑ Lars F. Lundegaard, Gunnar Weck, Malcolm I. McMahon, Serge Desgreniers and Paul Loubeyre, « Observation of an O8 molecular lattice in the phase of solid oxygen », dans Nature, vol. 443, 2006, p. 201–204 [texte intégral lien DOI (pages consultées le 2008-01-10)]
- ↑ Steudel, Ralf, « Dark-Red O8 Molecules in Solid Oxygen: Rhomboid Clusters, Not S8-Like Rings », dans Angewandte Chemie International Edition, vol. 46, no 11, 2007, p. 1768–1771 [texte intégral lien DOI (pages consultées le 2008-01-10)]
- ↑ Peter P. Edwards, Friedrich Hensel, « Metallic Oxygen », dans ChemPhysChem, WILEY-VCH-Verlag, Weinheim, Germany, vol. 3, no 1, 2002, p. 53–56 [texte intégral lien DOI (pages consultées le 2008-01-08)]
Articles connexes
- Portail de la chimie
Catégorie : Oxygène
Wikimedia Foundation. 2010.
